经典名方阳和汤指纹图谱及功效关联物质预测分析
2023-02-21张泽康窦敏航王昌海赵玥瑛张馨雨杜守颖
张泽康,张 晴,窦敏航,王昌海,赵玥瑛,席 铖,张馨雨,孙 萌,董 爽,杜守颖,白 洁,陆 洋
经典名方阳和汤指纹图谱及功效关联物质预测分析
张泽康,张 晴,窦敏航,王昌海,赵玥瑛,席 铖,张馨雨,孙 萌,董 爽,杜守颖,白 洁*,陆 洋*
北京中医药大学中药学院,北京 102488
基于指纹图谱及网络药理学,建立阳和汤指纹图谱检测方法,并对其功效关联物质进行预测分析,为阳和汤质量控制提供参考依据。采用HPLC建立阳和汤指纹图谱,对共有峰进行归属和指认,并运用网络药理学构建阳和汤“成分-靶点-通路”网络关系图,进一步佐证阳和汤功效成分选择的合理性。阳和汤的HPLC指纹图谱共标定15个共有峰,通过对照品指认出2号峰5-羟甲基糠醛、5号峰芥子碱硫氰酸盐、8号峰甘草苷、9号峰毛蕊花糖苷、11号峰肉桂酸、12号峰桂皮醛、13号峰甘草酸、15号峰盐酸麻黄碱8个共有色谱峰,相似度均>0.83,主要药效物质群可以从药材-饮片-基准样品逐级较为完整的传递,且归属关系清晰明确;采用网络药理学对筛选出的8个活性成分进行“成分-靶点-通路”网络构建与分析,富集的通路中包括癌症信号通路、脂质和动脉粥样硬化信号通路、鞘脂信号通路、甲状腺激素信号通路等。根据成分、靶点以及通路之间的连接度,初步预测甘草酸、甘草苷、桂皮醛、肉桂酸、毛蕊花糖苷、芥子碱硫氰酸盐、盐酸麻黄碱7个活性成分可能通过调节这些信号通路达到温阳补血、散寒通滞的作用。通过HPLC指纹图谱结合网络药理学分析预测阳和汤治疗疾病的潜在功效关联物质,建立的方法操作便捷,稳定性好,可用于阳和汤的质量控制,也为深入研究阳和汤的质量标准和作用机制提供参考。
经典名方;阳和汤;指纹图谱;网络药理学;功效关联物质;芥子碱硫氰酸盐;5-羟甲基糠醛;甘草苷;毛蕊花糖苷;肉桂酸;桂皮醛;甘草酸;盐酸麻黄碱
经典名方是我国历代医家智慧的结晶,为推动经典名方现代化,国家药品监督管理局于2020年发布了《中药注册分类及申报资料要求》[1]通告,其中将中药注册分类中的第3类古代经典名方中药复方制剂细分为“3.1按古代经典名方目录管理的中药复方制剂”及“3.2其他来源于古代经典名方的中药复方制剂(以下简称‘3.2类’)”,3.2类包括未按古代经典名方目录管理的古代经典名方中药复方制剂和基于古代经典名方加减化裁的中药复方制剂,加强了对古典医籍精华的梳理和挖掘。为保证经典名方复方制剂质量疗效一致性,需构建药材、饮片、基准样品、制剂全过程的质量控制体系;为建立系统全面的质量检测方法,指纹图谱被列为质量评价的重要指标;为保障质量评价指标的科学性,需确认影响其品质的功效关联物质[2]。阳和汤出自清代王洪绪所著《外科证治全生集》,由熟地黄、鹿角胶、肉桂、炒白芥子、麻黄、姜炭、甘草7味药组成,具有温阳补血、散寒通滞的功效,主治阴疽。在现代临床中,阳和汤及其加减方常用于治疗乳腺癌等恶性肿瘤。
近年来,对于阳和汤的研究主要集中在对乳腺癌、糖尿病足病、心血管系统疾病、骨关节疾病等患者临床疗效的研究以及治疗机制的探讨,而关于其质量控制方面的文献报道较少,仅有窦建卫等[3-6]从成分定量分析、薄层色谱定性鉴别等方法对阳和汤全方中的部分单味药进行了质量研究,方法较为常规,且存在不足,如单味药基原、处方剂量等均缺乏考证,质量控制研究仅从单味药出发,缺乏对复方多成分、多靶点综合作用的观念等。基于此,本课题借鉴《古代经典名方中药复方制剂及其物质基准的申报资料要求(征求意见稿)》[7]相关内容,从整体性出发建立了阳和汤药材、饮片及基准样品的HPLC指纹图谱,并整合多学科技术方法,基于可测性、可追溯性、有效性综合预测,分析阳和汤治疗阳虚寒痰凝聚的功效关联物质,为后期阳和汤复方制剂全方位的质量控制及其作用机制研究奠定基础。
1 仪器与材料
1.1 仪器
Thermo Fisher U3000高效液相色谱仪,DAD检测器,CM7.2色谱工作站,赛默飞世尔科技(中国)有限公司;BSA 224S万分之一电子分析天平,赛多利斯科学仪器北京有限公司;JM-B100002十万分之一电子天平,余姚市纪铭称重校验设备有限公司;H22-X3型九阳电陶炉,杭州九阳生活电器有限公司;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司;KQ5200DA型数控超声波清洗器,昆山市超声仪器有限公司;FD-2A真空冷冻干燥机,北京博医康实验仪器有限公司;DZF-6051型真空干燥器,北京利康达圣科技有限公司。
1.2 试药
对照品5-羟甲基糠醛(批号H12M9Z61023,质量分数≥98.0%),购自上海源叶生物科技有限公司;对照品毛蕊花糖苷(批号111530-201914,质量分数95.2%)、桂皮醛(批号110710-202022,质量分数98.7%)、肉桂酸(批号110786-201604,质量分数98.8%)、芥子碱硫氰酸盐(批号111702- 202006,质量分数99.0%)、盐酸麻黄碱(批号171241-201809,质量分数100.0%)、甘草苷(批号111610-201908,质量分数95.0%)、甘草酸铵(批号110731-202021,质量分数96.2%),均购自中国食品药品检定研究院。乙腈、磷酸,色谱纯,美国Fisher公司;甲醇、三乙胺,分析纯,北京化工厂;纯净水,杭州娃哈哈集团有限公司;其他试剂均为分析纯。
阳和汤由熟地黄、鹿角胶、肉桂、炒白芥子、麻黄、姜炭和甘草7味药组成,其药材均购自道地产区或主产区。生地黄、肉桂、芥子、麻黄、干姜和甘草药材经北京中医药大学刘春生教授鉴定,分别为玄参科地黄属植物地黄Libosch.的新鲜或干燥块根、樟科樟属植物肉桂Presl的干燥树皮、十字花科白芥属植物白芥L.的干燥成熟种子、麻黄科麻黄属植物草麻黄Stapf的干燥草质茎、姜科姜属植物姜Rosc.的干燥根茎、豆科甘草属植物甘草Fisch.的干燥根和根茎。
本实验前期已按照《中国药典》2020年版各单味药材项下的检测方法对药材进行检测,含量均符合要求。按照《中国药典》2020年版各单味药材项下的饮片炮制要求炮制成肉桂、炒白芥子、麻黄、姜炭及甘草饮片(熟地黄、鹿角胶饮片由健民药业集团股份有限公司提供)。经检测饮片均符合《中国药典》2020年版项下相关规定。利用随机数表法将熟地黄、肉桂、炒白芥子、麻黄、姜炭、甘草6味饮片的不同批次随机组合,阳和汤批次组合具体信息见表1(其中15批次阳和汤组合信息中鹿角胶的批号均为20210901)。

表1 阳和汤组合信息
2 方法与结果
2.1 色谱条件
色谱柱为Zorbax SB-C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.05%磷酸水溶液(含0.05%三乙胺溶液),梯度洗脱:0~5 min,2%~3%乙腈;5~15 min,3%~5%乙腈;15~65 min,5%~30%乙腈;65~90 min,30%~70%乙腈;体积流量1.0 mL/min;检测波长210、260 nm;柱温35 ℃;进样量10 μL。
2.2 对照品溶液的制备
取各对照品适量,精密称定,加50%甲醇配制成含5-羟甲基糠醛17.90 μg/mL、毛蕊花糖苷17.72 μg/mL、桂皮醛22.64 μg/mL、肉桂酸13.47 μg/mL、芥子碱硫氰酸盐19.88 μg/mL、盐酸麻黄碱19.78 μg/mL、甘草苷15.60 μg/mL、甘草酸14.60 μg/mL的混合对照品溶液。
2.3 供试品溶液的制备
根据本课题组前期确定的处方比例[8]称取7味饮片量:熟地黄37.3 g、鹿角胶11.2 g、肉桂3.7 g、炒白芥子7.5 g、麻黄1.9 g、姜炭1.9 g、甘草3.7 g。置陶瓷锅中,加水450 mL,以武火(600 W)煮沸后,调节火力至200 W煎煮30 min,趁热用300目无纺布滤过,药渣再加水336 mL,同法煎煮30 min,合并2次滤液(将鹿角胶烊化至滤液中),放凉后加水调整体积至600 mL,精密移取煎液5 mL于20 mL西林瓶中,置于冷冻干燥机中冷冻干燥48 h,冻干温度−80 ℃,真空度(5±1)Pa。取出压盖密塞,即得阳和汤基准样品冻干粉。
取阳和汤基准样品冻干粉适量,置10 mL容量瓶中,加50%甲醇至刻度,摇匀,室温放置10 min,于10 000 r/min离心5 min,滤过,取续滤液,即得阳和汤基准样品供试品溶液。
2.4 方法学考察
2.4.1 参照峰选择 在本实验所建立的指纹图谱中,芥子碱硫氰酸盐化学性质稳定,峰面积居中且稳定、分离度佳、峰形对称、保留时间适中,因此,选择芥子碱硫氰酸盐为参照峰(s),以计算其余峰的相对峰面积和相对保留时间。
2.4.2 精密度试验 取阳和汤基准样品冻干粉适量,按照“2.3”项下方法制备供试品溶液,连续进样6次,按照“2.1”项下色谱条件进行测定,记录色谱图。以芥子碱硫氰酸盐为参照峰,计算各个共有峰的相对保留时间和相对峰面积。结果表明,各共有峰的相对保留时间RSD均<0.75%,相对峰面积RSD均<2.10%,表明仪器精密度良好。
2.4.3 重复性试验 取阳和汤基准样品冻干粉适量,按照“2.3”项下方法制备供试品溶液,平行制备6份,按照“2.1”项下色谱条件进行测定,记录色谱图。以芥子碱硫氰酸盐为参照峰,计算各个共有峰的相对保留时间和相对峰面积。结果表明,各共有峰的相对保留时间RSD均<小于0.23%,相对峰面积RSD均<3.05%,表明该方法的重复性良好,可用于阳和汤指纹图谱的检测。
2.4.4 稳定性试验 取阳和汤基准样品冻干粉适量,按照“2.3”项下方法制备供试品溶液,分别在制备后0、2、4、6、8、10、12、24 h进样,按照“2.1”项下色谱条件进行测定,记录色谱图。以芥子碱硫氰酸盐为参照峰,计算各个共有峰的相对保留时间和相对峰面积。结果表明,各共有峰的相对保留时间RSD均<0.12%,相对峰面积RSD均<2.34%,表明供试品溶液在24 h内稳定。
2.5 阳和汤基准样品指纹图谱的建立及相似度评价
取15批阳和汤基准样品供试品溶液与对照品溶液按色谱条件进行测定,记录色谱图。通过《中药色谱指纹图谱相似度评价系统》(2012版)软件,以S1为参照峰,采用中位数法,进行多点校正和色谱峰匹配,得到15批阳和汤基准样品指纹图谱叠加图、共有模式图和混合对照品图,共确认15个共有峰,指认8个色谱峰。结果见图1、2。
与对照指纹图谱相比,11批阳和汤基准样品指纹图谱的相似度均>0.90,表明阳和汤基准样品的相似度良好,主要物质群差异性小,制备工艺较为科学合理,形成的基准样品对照图谱能够作为衡量阳和汤基准样品的标准参照物,结果见表2。其中S1、S5、S6、S15相似度较低,本课题组在前期研究中发现[8],熟地黄饮片中5-羟甲基糠醛的含量对相似度结果影响较大,因此,后期研究中需严格控制熟地黄饮片的质量,从而保证阳和汤基准样品的整体质量。
2.6 阳和汤基准样品指纹图谱共有峰的归属
按供试品制备方法分别制备单味饮片供试品溶液、缺单味饮片供试品溶液和阳和汤基准样品供试品溶液。取阳和汤基准样品、单味饮片、缺单味饮片供试品溶液按“2.1”项色谱条件进行测定,记录色谱图。分别将阳和汤基准样品、单味饮片、缺单味饮片供试品溶液的色谱图进行叠加比较,对阳和汤基准样品指纹图谱的色谱峰进行归属分析,结果见图3和表3。

图1 15批阳和汤基准样品的指纹图谱叠加图
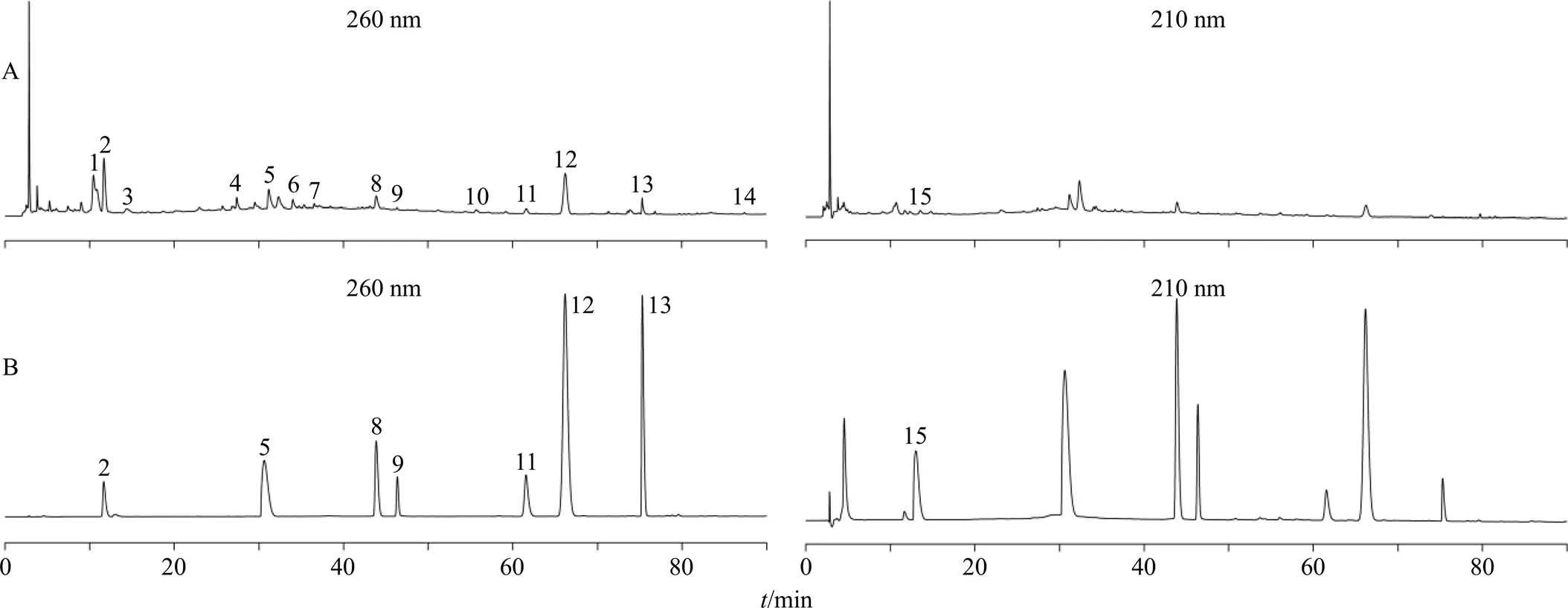
2-5-羟甲基糠醛 5-芥子碱硫氰酸盐 8-甘草苷 9-毛蕊花糖苷 11-肉桂酸 12-桂皮醛 13-甘草酸 15-盐酸麻黄碱

表2 15批阳和汤基准样品HPLC指纹图谱相似度
根据图3和表3对阳和汤基准样品指纹图谱中各共有峰进行归属分析,阳和汤基准样品指纹图谱共确认15个色谱峰,均可以在原料饮片中找到明确归属。具体归属情况为1、2、9号峰归属于熟地黄饮片;11、12号峰归属于肉桂饮片;3~7号峰归属于炒白芥子饮片;15号峰归属于麻黄饮片;8、10、13、14号峰归属于甘草饮片。经对照品比对指认8个色谱峰,分别为2号峰5-羟甲基糠醛、5号峰芥子碱硫氰酸盐、8号峰甘草苷、9号峰毛蕊花糖苷、11号峰肉桂酸、12号峰桂皮醛、13号峰甘草酸和15号峰盐酸麻黄碱,主要药效成分的指认率为53.3%。综上可知,阳和汤基准样品的物质群可清晰的追溯到饮片,且色谱峰归属明确,指认率较高。
从色谱峰个数与峰强度看,炒白芥子对指纹图谱的贡献最大,甘草、熟地黄、肉桂和麻黄对指纹图谱的贡献度依次递减,姜炭对指纹图谱的贡献最低。姜炭主要含挥发油类,其指标性成分6-姜辣素在饮片炮制过程中损失严重,导致含量大幅度下降,在阳和汤煎煮过程中由饮片转移至冻干粉的量极少,在此色谱条件下未检测出色谱峰。因此,姜炭饮片在本实验色谱条件下难以获得指纹图谱信息。
2.7 基于网络药理学的阳和汤功效关联物质预测分析
2.7.1 基于可测性及可追溯性的活性成分筛选 根据文献研究,熟地黄为阳和汤君药,其主要活性成分为环烯醚萜类和苯乙醇类化合物,包括梓醇、毛蕊花糖苷、地黄苷D、5-羟甲基糠醛、地黄多糖等,具有抗肿瘤、调节血糖血脂、提高免疫、抗心肌缺血及保护中枢神经等药理作用[9];鹿角胶的主要活性成分为动物蛋白、氨基酸和微量元素(钙、镁、锌、铁、铜、锰等)等,具有补血活血、抗骨质疏松等药理作用[10];肉桂的主要活性成分为挥发油类,具有抗菌抗炎、抗病毒等药理作用[11];炒白芥子的主要活性成分为白芥子苷及其衍生物和脂肪酸类等,具有镇咳、祛痰、平喘、抗炎镇痛等药理作用[12];麻黄的主要活性成分为生物碱类,具有发汗、镇咳平喘、抗菌等药理作用[13];姜炭的主要活性成分为姜辣素类,具有止呕等药理作用[14];甘草的主要活性成分为三萜类和黄酮类,具有抗肿瘤、抗菌抗炎、抗动脉粥样硬化等药理作用[15]。

图3 阳和汤专属性色谱图
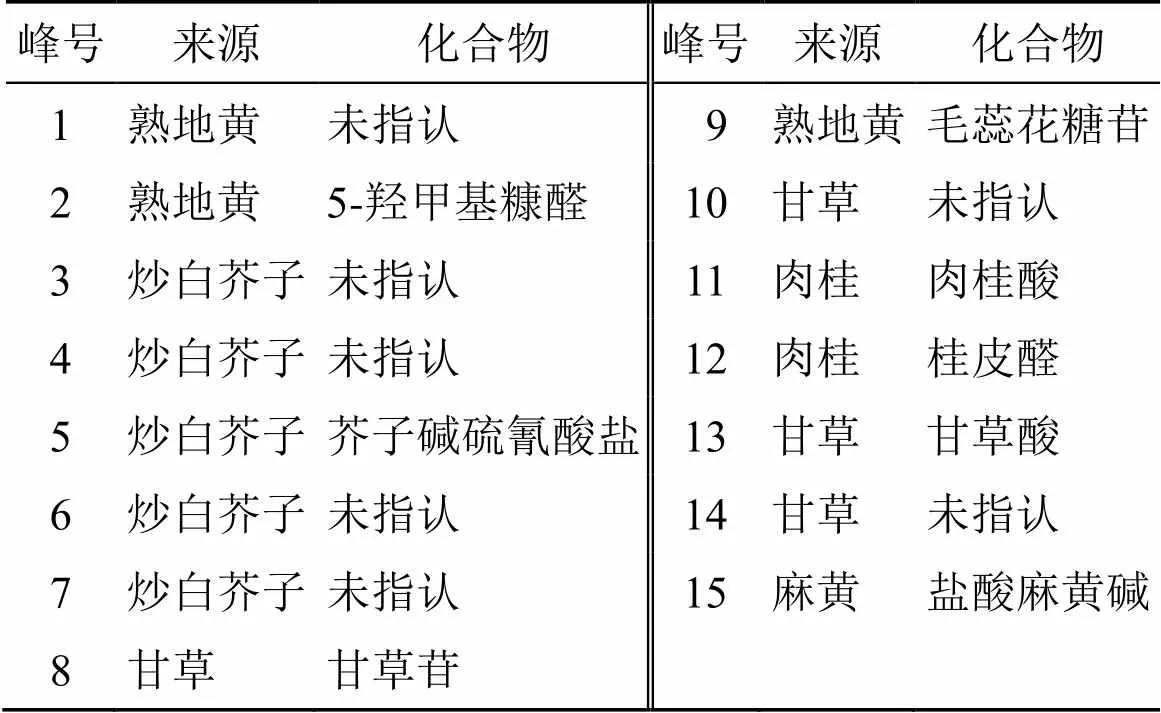
表3 阳和汤共有峰归属
《中国药典》2020年版对于组方药的控制主要为熟地黄的地黄苷D,鹿角胶的-羟脯氨酸、甘氨酸、丙氨酸、-脯氨酸,肉桂的桂皮醛,炒白芥子的芥子碱硫氰酸盐,麻黄的盐酸麻黄碱、盐酸伪麻黄碱,姜炭的6-姜辣素,甘草的甘草苷、甘草酸。基于文献研究及指纹图谱的可测性和可追溯性,确定指纹图谱中指认出的5-羟甲基糠醛、毛蕊花糖苷、桂皮醛、肉桂酸、芥子碱硫氰酸盐、盐酸麻黄碱、甘草苷、甘草酸8个活性成分为候选化合物。通过Pubchem Compound化合物数据库(https://pubchem. ncbi.nlm.nih.gov/)获取8个候选化合物的Canonical SMILES编号,为后续阳和汤“成分-靶点-通路”网络的构建做准备。
2.7.2 蛋白-蛋白互作(protein-protein interaction,PPI)网络构建 将8个候选化合物的Canonical SMILES编号导入swiss target prediction数据库(http://www.swisstargetprediction.ch/)进行对应的靶点预测,去除重复靶点,获得8个候选化合物共涉及469个作用靶点。将筛选出的469个作用靶点,导入STRING数据库(https://cn.string-db.org/),选择物种为“Homo sapiens”,选择最高置信度蛋白交互参数评分值>0.9的蛋白互作数据,获得PPI网络图,见图4。
将PPI网络图以TSV格式导入Cytoscape 3.8.0软件,并利用此软件筛选出度值≥24,介数中心性和接近中心性均大于中位数的靶点作为核心靶点,经筛选得到88个核心靶点,结果见表4。
2.7.3 基因本体(gene ontology,GO)功能富集分析和京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析 将筛选得到的88个核心靶点利用Metascape数据库(https://metascape.org/gp/index.html)对其进行GO功能富集分析和KEGG通路富集分析。选择物种为“Homo sapiens”,富集分析均以<0.01具有统计学意义。GO功能富集分析可以用于描述靶点在生物过程(biological process,BP)、细胞组分(cell component,CC)和分子功能(molecular function,MF)3大层面上的功能,共得到60个GO条目,如图5所示,其中BP占20个,CC占20个,MF占20个。BP显著富集在细胞对氮化合物的反应、对激素的反应、蛋白质磷酸化的正调节、细胞对有机环状化合物的反应等过程;CC显著富集在膜筏、细胞质核周区、突触后、膜侧、胞体等区域;MF显著富集在激酶结合、蛋白质结构域特异性结合、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性等功能。在KEGG通路富集分析中,前20条与阳和汤相关度较高的通路如图6所示,主要涉及癌症信号通路、脂质和动脉粥样硬化信号通路、鞘脂信号通路、甲状腺激素信号通路、糖尿病性心肌病信号通路等,表明88个核心靶点可能是主要通过调节这些通路来起到治疗或干预疾病的作用。

图4 靶点PPI网络图

表4 核心靶点性质
续表4

靶点名称度值介数中心性接近中心性 ADRB2肾上腺素能受体β(adrenergic receptor β)351 664.133 6330.001 034 PTGS2环氧合酶-2(cyclooxygenase-2)904 509.877 0620.001 176 F2凝血酶(thrombin)442 012.113 8390.001 068 MMP9基质金属蛋白酶9(matrix metalloproteinase 9)903 864.770 9270.001 160 ACHE乙酰胆碱酯酶(acetylcholinesterase)291 653.416 6710.001 024 PLG胞浆素原(plasminogen)41727.411 1400.001 035 TNF肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)16116 589.169 8230.001 333 DPP4二肽基肽酶IV(dipeptidyl peptidase IV)291 620.029 3710.001 009 NOS3内皮型一氧化氮合酶(nitric-oxide synthase, endothelial)712 279.959 3350.001 144 GSR谷胱甘肽还原酶(glutathione reductase)271 093.391 5050.001 038 SLC6A3多巴胺转运蛋白(dopamine transporter)392 028.972 1150.000 995 HPGDS造血型前列腺素D合成酶(hematopoietic prostaglandin D synthase)684 227.105 1270.001 140 DRD2多巴胺D2受体(dopamine D2 receptor)381 902.568 9330.001 036 GRIN1谷氨酸[NMDA]受体蛋白(glutamate [NMDA] receptor protein)341 710.135 0300.001 019 CNR1大麻素受体1(cannabinoid receptor 1)424 116.451 9400.001 049 CHRM1毒蕈碱乙酰胆碱受体M1(muscarinic acetylcholine receptor M1)261 574.821 3370.000 969 MAOA单胺氧化酶A(monoamine oxidase A)361 134.263 9300.000 962 MAOB单胺氧化酶B(monoamine oxidase B)381 580.851 1770.000 978 GARTGAR转甲酰酶(同源)[GAR transformylase (by homology)]311 244.991 9230.000 950 IL2白介素2(interleukin-2)691 567.120 0350.001 121 TYMS胸苷酸合酶(同源)[thymidylate synthase (by homology)]38930.104 6590.000 976 DHFR二氢叶酸还原酶(同源)[dihydrofolate reductase (by homology)]342 019.182 5120.001 004 LGALS4半乳糖凝集素4(galectin-4)281 557.122 8020.001 025 GSTP1谷胱甘肽S-转移酶P1(glutathione S-transferase P1)421 555.662 2020.001 046 OPRM1µ阿片受体(µ opioid receptor)271 075.336 7980.000 995 PRKCB蛋白激酶C β(protein kinase C β)451 345.542 8470.001 050 PRKCA蛋白激酶C α(protein kinase C α)581 973.421 3310.001 109 CFTR囊性纤维化跨膜电导调节剂(cystic fibrosis transmembrane conductance regulator)273 077.063 5340.001 012 NR3C1糖皮质激素受体(glucocorticoid receptor)643 390.862 2380.001 129 DNMT1DNA(胞嘧啶-5)-甲基转移酶1[DNA (cytosine-5)-methyltransferase 1]521 451.665 9610.001 066 AHR芳烃受体(aryl hydrocarbon receptor)341 302.863 0470.001 059 PGR孕激素受体(progesterone receptor)54992.412 1350.001 105 CYP19A1细胞色素P450 19A1(cytochrome P450 19A1)31756.166 2350.001 024 RELA核因子NF-κB p65亚基(nuclear factor NF-κB p65 subunit)722 203.598 2700.001 139 RXRA维甲酸X受体α(retinoid X receptor α)331 019.046 7860.001 020 PTK2黏着斑激酶1(focal adhesion kinase 1)54962.624 6800.001 068 CTSB组织蛋白(B和K)[cathepsin (B and K)]381 132.288 9600.001 021 BRD4含溴结构域蛋白4(bromodomain-containing protein 4)331 076.992 0860.001 003 PRKACAcAMP依赖性蛋白激酶α催化亚基(cAMP-dependent protein kinase α-catalytic subunit)491 996.515 8630.001 062 HDAC2组蛋白脱乙酰基酶2(histone deacetylase 2)48955.463 8070.001 044 HSPA1A热休克70 kDa蛋白1(heat shock 70 kDa protein 1)411 108.427 3220.001 074 KDM1A赖氨酸特异性组蛋白去甲基化酶1(lysine-specific histone demethylase 1)381 360.475 4260.000 993 PPP2CA丝氨酸/苏氨酸蛋白磷酸酶2A,催化亚基,α亚型(serine/threonine protein phosphatase431 016.475 1950.001 034 2A, catalytic subunit, α isoform) KDM6B赖氨酸专一性脱甲基酶6B(lysine-specific demethylase 6B)281 451.180 6140.000 949 NOS2诱导型一氧化氮合酶(同源)[nitric oxide synthase, inducible (by homology)]36987.414 7940.001 048
图5 阳和汤核心靶点GO功能富集分析
Fig. 5 Analysis of GO function enrichment of Yanghe Decoction core targets
2.7.4 “成分-靶点-通路”网络构建及分析 将筛选得到的阳和汤中的8个活性成分、88个核心靶点和20条核心通路,运用Cytoscape 3.8.0软件构建“成分-靶点-通路”网络关系图,见图7。从图中可以看出,阳和汤是通过多成分、多靶点、多通路的协同作用达到治疗疾病的目的。在8个活性成分中,除5-羟甲基糠醛外,甘草酸、甘草苷、桂皮醛、肉桂酸、毛蕊花糖苷、芥子碱硫氰酸盐和盐酸麻黄碱7个成分有较高的连接度;在88个核心靶点中,丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)、转录因子p65(transcription factor p65,RELA)、半胱氨酸蛋白酶3(caspase 3,CASP3)、磷脂酰肌醇3-激酶催化亚基α(phosphatidylinositol 3-kinase catalytic subunit α,PIK3CA)、蛋白激酶cAMP激活催化亚基α(protein kinase cAMP- activated catalytic subunit α,PRKACA)、丝裂原活化蛋白激酶14(mitogen-activated protein kinase 14,MAPK14)、蛋白激酶Cα(protein kinase Cα,PRKCA)、蛋白激酶C-β(protein kinase C-β,PRKCB)、B细胞淋巴瘤2样1(B-cell Lymphoma 2 Like 1,BCL2L1)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的连接度也高于其他靶点;在20条核心通路中,癌症信号通路、脂质和动脉粥样硬化信号通路、鞘脂信号通路、甲状腺激素信号通路的连接度相对较高。
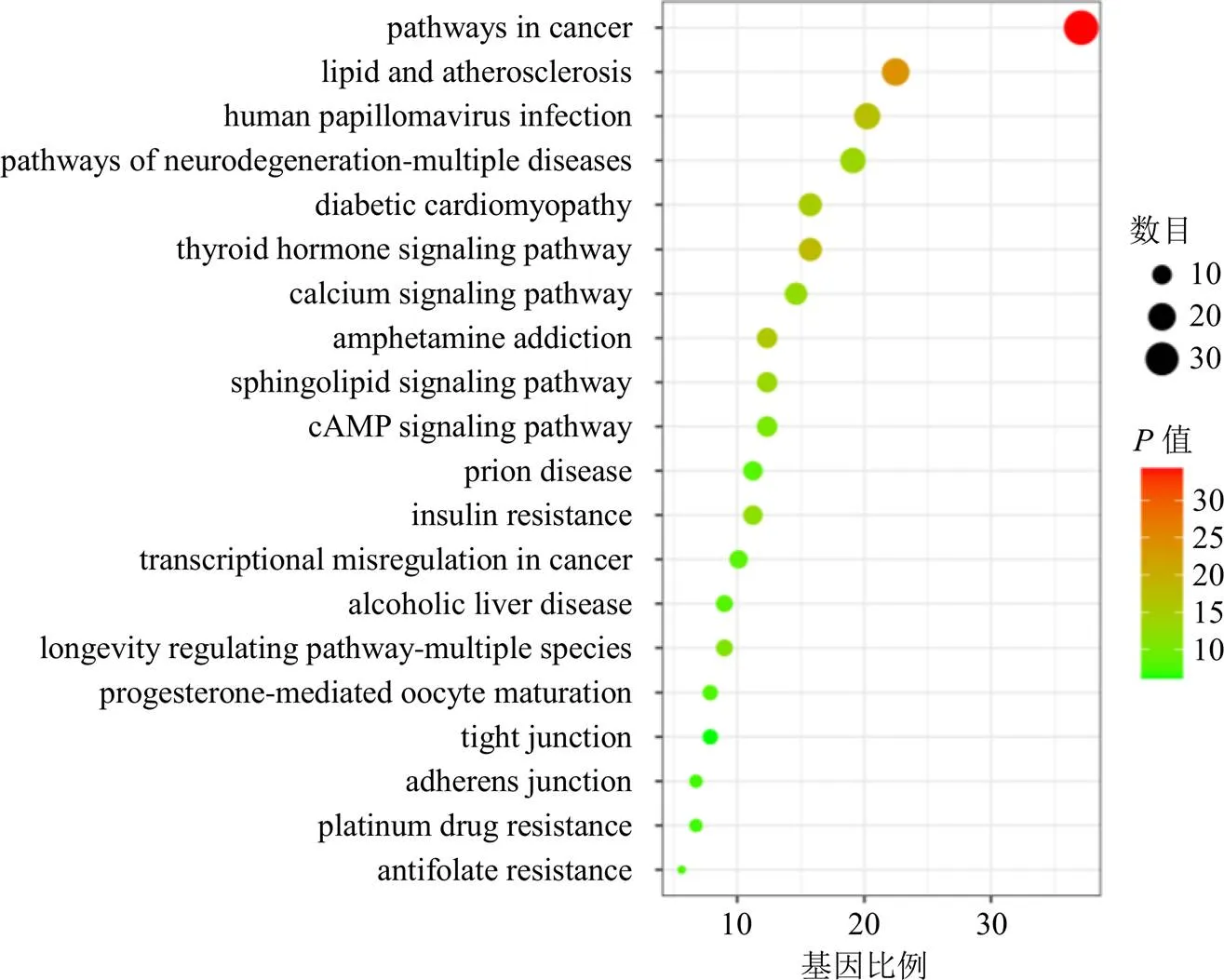
图6 KEGG富集通路分析结果

图7 “成分-靶点-通路”网络图
2.7.5 整合分析 阳和汤主治阴疽,现代临床治疗病症较为广泛,在恶性肿瘤[16]、神经系统疾病[17]、内分泌系统疾病[18]、免疫系统疾病[19]、泌尿系统疾病[20]、骨科[21]及妇科疾病[22]等方面均有显著疗效。在KEGG通路富集分析中显示,阳和汤主要涉及癌症信号通路、脂质和动脉粥样硬化信号通路、鞘脂信号通路、甲状腺激素信号通路等。恶性肿瘤作为消耗性疾病,患者多以阳虚为主,故中医治疗恶性肿瘤以“温阳通滞”为主[23-24]。
阳和汤作为温阳散寒通滞的经典方,临床上治疗恶性肿瘤应用广泛,尤其在诸多“阳虚型”癌症患者中疗效显著。研究发现,阳和汤通过抑制mTOR信号通路相关蛋白的磷酸化水平[25-26]、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路[27]及负调控STAT3通路等[28]来抑制肿瘤增殖并促进癌细胞凋亡。此外表皮生长因子受体(epithelial growth factor receptor,EGFR)通路与细胞周期和代谢紧密相关[29],缺氧诱导因子1α(hypoxia inducible factor 1α,HIF-1α)促进肿瘤的免疫逃逸[30],丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)参与癌症的转移[31]等,而阳和汤复方均与上述通路有密切的关系。高永翔等[32]通过研究发现阳和汤含药血清对乳腺癌MDA-MB-231、MCF-7、4T1、SK-BR-3细胞、胃癌MGC-803细胞均有抑制作用,并能影响细胞周期分布、诱导癌细胞凋亡,体内相关实验也有明显的抑瘤作用。
缺氧诱导因子(hypoxia inducible factor,HIF)信号通路可加速癌细胞生长,而阳和汤可显著降低HIF-1α的mRNA及蛋白表达[33],且能抑制乳腺癌细胞的跨内皮能力和血管生成能力,从而起到治疗作用。动脉粥样硬化是引起大多数心血管疾病的主因,发病机制复杂,目前越来越多的研究表明,鞘脂信号通路是脂质和动脉粥样硬化疾病的相关作用通路[34]。神经酰胺作为神经鞘脂代谢通路的中心分子[35],在动脉粥样硬化的早期形成阶段,神经酰胺对血管内皮具有保护作用,能够维持血管张力和血压稳态。
此外,抑制神经鞘磷脂合成酶(sphingomyelin synthase,SMS)活性可降低神经鞘磷脂水平,并能有效抑制炎症刺激下核因子-кB(nuclear factor-кB,NF-кB)的激活,而NF-кB是多种致动脉粥样硬化相关炎症基因的关键调控因子[36]。相关动物实验也表明,高脂饮食背景下的载脂蛋白E基因缺陷小鼠敲除SMS基因后,在降低炎症反应的同时,也能有效减少动脉粥样硬化病变[37]。自身免疫性甲状腺炎又称桥本甲状腺炎(Hashimoto’s thyroiditis,HT),HT病变过程也是炎性细胞因子异常表达的过程,现代药理研究发现[38],阳和汤加减方中所含主要活性成分能增加HT患者血清甲状腺激素浓度,可有效维持甲状腺激素水平稳定,且可显著降低血清炎性因子表达水平,抑制炎症反应。马丙娥等[39]实验研究已经证明阳和汤可抑制实验性自身免疫性甲状腺炎(experimental autoimmune thyroiditis,EAT)大鼠外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中STAT3通路激活并改善EAT大鼠的甲状腺功能,有效降低EAT大鼠血清中甲状腺抗体水平,缓解甲状腺炎症状。
上述文献研究表明,网络药理学预测的结果与现有相关文献较为接近,说明该研究方法具有一定的科学性和可靠性,为近一步阐述阳和汤的作用机制提供了依据。同时也与中药整体性的观念相吻合,阳和汤中多个活性成分可作用于多个核心靶点,从而干预多个作用通路,起到干预或治疗疾病的作用。基于指纹图谱和网络药理学研究,甘草酸、甘草苷、桂皮醛、肉桂酸、毛蕊花糖苷、芥子碱硫氰酸盐和盐酸麻黄碱7个成分具有传递性和溯源性,且与阳和汤的功能属性密切相关,可预测其为影响阳和汤品质的潜在功效关联物质。
3 讨论
本实验采用冻干粉形式保存基准样品,在优化供试品溶液条件时,分别以水、不同比例甲醇(25%、50%、75%)作为复溶溶剂考察冻干粉的复溶效果,结果发现50%甲醇作为复溶溶剂时,可使冻干粉完全溶解,各成分的相对峰面积最为接近,因此选择50%甲醇作为阳和汤基准样品冻干粉的复溶溶剂;在优化色谱条件时,考察了不同检测波长,不同流动相体系[乙腈-水、甲醇-水、甲醇-0.05%磷酸水溶液(含0.05%三乙胺)、乙腈-0.05%磷酸水溶液(0.05%三乙胺)],不同柱温(25、30、35 ℃)对色谱峰的影响。通过以上研究,确立阳和汤指纹图谱的分析方法:选取检测波长260 nm(5-羟甲基糠醛、毛蕊花糖苷、桂皮醛、肉桂酸、芥子碱硫氰酸盐、甘草苷、甘草酸)、210 nm(盐酸麻黄碱),流动相乙腈-0.05%磷酸水溶液(含0.05%三乙胺),柱温35 ℃。
经典名方药味众多,成分复杂,本实验以指纹图谱为指标,全面考察阳和汤原料饮片-基准样品的关键质量属性的传递性。结果显示,阳和汤基准样品共确认15个峰,指认8个色谱峰,均能在原料饮片中找到明确归属。但部分《中国药典》2020年版单味药项下规定的指标性成分未能检出,其中地黄苷D和盐酸伪麻黄碱在上述色谱条件下互相干扰,单独建立色谱条件进行全波长扫描,分析其3D图谱,2种成分仍彼此干扰,无法有效分离;鹿角胶主要成分为氨基酸类物质,水溶性大,含量低,且不具备HPLC-UV检测的结构特点,致使在上述色谱条件下不能检出;6-姜辣素对照品在上述色谱条件下可被检识,但其饮片在阳和汤基准样品指纹图谱中贡献度较低,可能是干姜在炒炭过程中挥发性成分极不稳定,逐渐挥发散失。对于上述存在的问题,本课题组后期将进一步深入研究,结合其他质量控制方法如超高效液相色谱-串联质谱(针对熟地黄、鹿角胶、麻黄中未检出的成分)、顶空固相微萃取-气相色谱-质谱(针对姜炭中挥发性成分)等进行全面的质量控制。
中药复方具有“多成分、多靶点和多途径”协同作用的特点,而网络药理学基于“疾病-基因-靶标-药物”相互作用网络,系统观察药物对疾病网络的干预与影响,这与中药复方多成分、多途径和多靶点协同作用的原理殊途同归[40]。本实验将指纹图谱与网络药理学相结合,通过对经典名方阳和汤进行指纹图谱研究,并采用网络药理学构建阳和汤的“成分-靶点-通路”网络,不仅对阳和汤质量控制指标成分的合理性进行了验证,而且揭示了阳和汤功效关联性的物质基础,为阳和汤发挥功效及药理作用机制的阐释提供了思路。但网络药理学仍存在一些局限性,后续仍需要通过一些药理实验进行验证以促进阳和汤质量标准的建立。
利益冲突 所有作者均声明不存在利益冲突
[1] 国家药品监督管理局. 关于发布《中药注册分类及申报资料要求》的通告(2020年第68号) [EB/OL]. [2020-09-27]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/2020092 8164311143.html.
[2] 王璐, 张礼欣, 贾奥蒙, 等. 基于指纹图谱和网络药理学对经典名方竹茹汤中葛根的质量标志物(Q-Marker)预测分析[J]. 中草药, 2021, 52(20): 6197-6207.
[3] 窦建卫, 尚荣国, 彭湃, 等. 提高阳和汤质量标准研究 [J]. 中医药信息, 2018, 35(1): 27-29.
[4] 窦建卫, 朱宇红, 王红英, 等. 阳和汤的质量标准研究 [J]. 陕西中医, 2017, 38(11): 1598-1599.
[5] 朱宇红, 刘甲平, 尚荣国, 等. 阳和汤质量控制研究 [J]. 陕西中医, 2017, 38(9): 1286-1287.
[6] 任晋茹, 李康乐, 尚荣国, 等. 高效液相色谱法测定阳和汤中毛蕊花糖苷和甘草苷两种成分 [J]. 西部中医药, 2019, 32(12): 20-22.
[7] 国家药监局综合司. 古代经典名方中药复方制剂及其物质基准的申报资料要求(征求意见稿) [EB/OL]. [2019-03-22]. https://www.nmpa.gov.cn/xxgk/zhqyj/ zhqyjyp/20190327150101694.html.
[8] 张泽康, 王昌海, 赵玥瑛, 等. 经典名方阳和汤基准样品的HPLC指纹图谱分析 [J/OL]. 中国实验方剂学杂志: 1-12. [2022-09-13]. https://kns.cnki.net/kcms/detail/ 11.3495.R.20220816.1222.015.html.
[9] 陈金鹏, 张克霞, 刘毅, 等. 地黄化学成分和药理作用的研究进展 [J]. 中草药, 2021, 52(6): 1772-1784.
[10] 李娜, 胡亚楠, 王晓雪, 等. 鹿角胶化学成分、药理作用及质量控制研究进展 [J]. 中药材, 2021, 44(7): 1777-1783.
[11] 高铭哲, 李婷, 田晨琪, 等. 肉桂化学成分与药理作用研究进展 [J]. 亚太传统医药, 2021, 17(11): 201-205.
[12] 孙银芳. 中药白芥子最新研究进展 [J]. 新中医, 2015, 47(10): 209-211.
[13] 卓小玉, 陈晶, 田明, 等. 麻黄的化学成分与药理作用研究进展 [J]. 中医药信息, 2021, 38(2): 80-83.
[14] 杜晶, 黄传辉. 姜炭的研究进展 [J]. 云南化工, 2021, 48(2): 8-11.
[15] 李娜, 张晨, 钟赣生, 等. 不同品种甘草化学成分、药理作用的研究进展及质量标志物(Q-Marker)预测分析[J]. 中草药, 2021, 52(24): 7680-7692.
[16] 韩懿存, 武颖烁, 尚艺婉, 等. 阳和汤治疗恶性肿瘤的研究进展 [J]. 中国比较医学杂志, 2022, 32(7): 109-117.
[17] 步兵. 加味阳和汤治疗化疗性周围神经病变的临床研究 [D]. 济南: 山东中医药大学, 2018.
[18] 郭建清. 分析阳和汤治疗早期糖尿病足的临床价值 [J]. 糖尿病新世界, 2021, 24(3): 186-188.
[19] 叶美杏, 陈君立, 黄艳华. 中药熏蒸联合阳和汤治疗中轴型脊柱关节炎的临床观察 [J]. 深圳中西医结合杂志, 2020, 30(20): 63-65.
[20] 刘永浩. 阳和汤治疗更年期尿道综合征疗效及对患者排尿情况和性激素水平的影响 [J]. 陕西中医, 2021, 42(5): 604-607.
[21] 刘伟恒, 黄其满, 吴剑强. 阳和汤联合塞来昔布治疗膝关节骨性关节炎的疗效及机制分析 [J]. 世界复合医学, 2022, 8(4): 105-108.
[22] 陈紫薇, 任梦雪, 郭利, 等. 浅谈阳和汤加减治疗阳虚寒凝型不孕症 [J]. 中国临床医生杂志, 2022, 50(9): 1128-1130.
[23] 许博文, 李杰, 曹璐畅, 等. 基于“阳化气, 阴成形”理论探讨扶阳消阴法在肿瘤临证中的应用 [J]. 中医杂志, 2020, 61(9): 772-775.
[24] 王红玲, 康斐, 黄兴. 基于“阳化气, 阴成形”理论探讨温阳法在恶性肿瘤中的应用 [J]. 中国中医基础医学杂志, 2019, 25(7): 999-1002.
[25] 赵天一. 基于PI3K/AKT/mTOR信号通路探讨阳和汤含药血清对人乳腺癌细胞增殖、凋亡的影响 [D]. 兰州: 甘肃中医药大学, 2017.
[26] 孙雪, 徐茜茜, 王星宇, 等. 阳和化岩汤对mTOR低表达型乳腺癌内分泌耐药细胞ER-PI3K/Akt/mTOR通路的作用机制 [J]. 海南医学院学报, 2020, 26(14): 1068-1073.
[27] 杨硕, 李康乐, 朱中博, 等. 阳和汤含药血清通过p38/STAT3信号通路对乳腺癌MCF-7细胞凋亡的影响 [J]. 中国实验方剂学杂志, 2020, 26(5): 6-10.
[28] Mao D, Feng L, Gong H. The antitumor and immunomodulatory effect of Yanghe Decoction in breast cancer is related to the modulation of the JAK/STAT signaling pathway [J]., 2018, 2018: 8460526.
[29] Lui V W Y, Grandis J R. EGFR-mediated cell cycle regulation [J]., 2002, 22(1A): 1-11.
[30] You L, Wu W D, Wang X,. The role of hypoxia-inducible factor 1 in tumor immune evasion [J]., 2021, 41(3): 1622-1643.
[31] del Barco Barrantes I, Nebreda A R. Roles of p38 MAPKs in invasion and metastasis [J]., 2012, 40(1): 79-84.
[32] 高永翔, 沈欣, 宗桂珍, 等. 阳和汤对裸鼠人癌移植瘤的抗肿瘤作用研究 [J]. 中国实验方剂学杂志, 2006, 12(7): 57-59.
[33] 肖玉洁, 王婷, 陈州华, 等. 阳和汤含药血清对缺氧乳腺癌干细胞MDA-MB-231增殖的抑制作用及其机制[J]. 中南药学, 2019, 17(8): 1219-1223.
[34] 廖思聪, 邱志东, 金俊飞. 神经鞘脂在动脉粥样硬化中的研究进展 [J]. 中国动脉硬化杂志, 2022, 30(8): 661-668.
[35] Yu Z M, Peng Q, Huang Y N. Potential therapeutic targets for atherosclerosis in sphingolipid metabolism [J].(), 2019, 133(6): 763-776.
[36] Hailemariam T K, Huan C M, Liu J,. Sphingomyelin synthase 2 deficiency attenuates NFkappaB activation [J]., 2008, 28(8): 1519-1526.
[37] Fan Y F, Shi F J, Liu J,. Selective reduction in the sphingomyelin content of atherogenic lipoproteins inhibits their retention in murine aortas and the subsequent development of atherosclerosis [J]., 2010, 30(11): 2114-2120.
[38] 杨凡, 莫涛, 周李芳, 等. 阳和汤加减治疗桥本甲状腺炎临床疗效及对血清炎性指标的影响 [J]. 现代中西医结合杂志, 2021, 30(24): 2700-2703.
[39] 马丙娥, 王建华, 赵正平, 等. 阳和汤对实验性自身免疫性甲状腺炎大鼠的治疗作用 [J]. 中医药导报, 2021, 27(1): 16-19.
[40] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读[J]. 中草药, 2021, 52(14): 4119-4129.
Fingerprints of classical prescription Yanghe Decoction and predictive analysis of its efficacy related substance
ZHANG Ze-kang, ZHANG Qing, DOU Min-hang, WANG Chang-hai, ZHAO Yue-ying, XI Cheng,ZHANG Xin-yu, SUN Meng, DONG Shuang, DU Shou-ying, BAI Jie, LU Yang
School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China
Based on fingerprint and network pharmacology, a fingerprint detection method of Yanghe Decoction (阳和汤) was established, and its efficacy related substances were predicted and analyzed to provide a reference basis for Yanghe Decoction quality control.The Yanghe Decoction fingerprint was established by HPLC, the common peaks were assigned and identified, and the “component-target-pathway” network diagram of Yanghe Decoction was constructed by network pharmacology to further prove the rationality of the selection of functional components of Yanghe Decoction.A total of 15 common peaks were calibrated by HPLC fingerprint of Yanghe Decoction. Eight common peaks of 5-hydroxymethylfurfural (peak 2), sinapine thiocyanate (peak 5), glycyrrhizin (peak 8), verbascoside (peak 9), cinnamic acid (peak 11), cinnamaldehyde (peak 12), glycyrrhizic acid (peak 13) and ephedrine hydrochloride (peak 15) were identified by the reference substance, and the similarity was more than 0.83. The main groups of pharmacodynamic substances can be transferred from raw materials, decoction pieces to benchmark samples step by step, with a clear affiliation relationship; The “component-target-pathway” network of eight selected active components was constructed and analyzed by network pharmacology, the enriched pathways included cancer signal pathway, lipid and atherosclerosis signal pathway, sphingolipid signal pathway, thyroid hormone signal pathway and so on. According to the connectivity between compounds, targets and pathways, it was preliminarily predicted that glycyrrhizic acid, glycyrrhizin, cinnamaldehyde, cinnamic acid, verbascoside, sinapine thiocyanate and ephedrine hydrochloride may achieve the effects of warmingand tonifying blood, dispelling cold and dredging stagnation by regulating these signal pathways.HPLC fingerprint combined with network pharmacology analysis is used to predict the potential efficacy related substances of Yanghe Decoction in the treatment of diseases. The established method is convenient and stable, and can be used for the quality control of Yanghe Decoction. It also provides a reference for the further study of the quality standard and action mechanism of Yanghe Decoction.
classic prescription; Yanghe Decoction; fingerprint; network pharmacology; efficacy related substances;sinapine thiocyanate; 5-hydroxymethylfurfural; glycyrrhizin; verbascoside; cinnamic acid; cinnamaldehyde; glycyrrhizic acid; ephedrine hydrochloride
R283.6
A
0253 - 2670(2023)04 - 1106 - 14
10.7501/j.issn.0253-2670.2023.04.010
2022-08-16
国家自然科学基金项目(82173989)
张泽康(1999—),男,硕士研究生,研究方向为中药新剂型、新技术。Tel: 18189512019 E-mail: 2557158263@qq.com
白 洁,女,副教授,硕士生导师,从事中药新剂型与新技术研究。Tel: (010)84738657 E-mail: baijie22811@163.com
陆 洋,男,教授,博士生导师,从事中药新剂型与新技术研究。Tel: (010)83912123 E-mail: landocean28@163.com
[责任编辑 郑礼胜]
