硫化钠法CCUS化学固碳技术分析和探讨
2023-02-21刘志盛于济深
刘志盛,朱 磊,于济深,张 伟
(1.中国中煤能源集团有限公司,北京市东城区,100120;2.中煤能源研究院有限责任公司,陕西省西安市,710000;3.福建百宏石化有限公司,福建省泉州市,362100)
为完成气候变化框架公约下实现碳达峰和碳中和的目标,研究开发高效低成本的CO2捕获、富集和固化技术,是世界各国共同面临的研究课题。通过去煤、减油、降气进行碳减排的同时,化石能源利用过程中排放的CO2也成为碳中和的聚焦点[1]。因此将工业排放的CO2收集并转化为固相或液相产品加以利用,能大幅减少CO2排入大气所带来的环境时空影响,且不受CCUS地下封存所需的地质环境限制,是构建低碳、高效、规模化的CO2反应转化路径之一,也是CO2化学固碳的关键问题。
1 绿氢化学固碳
我国可再生能源发电装机规模逐年提升,通过清洁能源发电并电解水制氢,可获得零碳能源H2。H2和CO2是碳氢化合物的工业基础原料,根据C1化学工业系统的特点,清洁能源制氢叠加煤化工工业链,可为化学工业固碳提供工业化可能,同时为传统煤化工向绿色低碳方向转型提供发展方向。
化学固碳的共性特点是通过化学反应将CO2插入到其他物质组成新的化学键,生成新的液相或固相含碳物质,从而将气相中的CO2进行脱除和资源化利用,例如利用CO2合成醇、醚、羧酸、低碳烯烃、酯、尿素、碳酸盐等有价值的化学品[2]。上述固碳过程中,打开CO2中的C、O键,CO2中的O与自身C以外的元素成键,归纳为活化CO2法固碳,如生成有机物及尿素;CO2中的O仅与自身的C成键,归纳为非活化法CO2固碳,如工业生产Na2CO3、NaHCO3、(NH4)2CO3和NH4HCO3。
将各种化学固碳路径进行逻辑分析对比,包括对CO2浓度要求、固定CO2载体来源、载体生产过程、载体结合固碳过程、催化剂成本、固碳周期、经济性、固碳风险、规模化的可行性等方面,从而探索出具有可行性和可持续性效果的化学固碳潜在工业路径。固碳技术可行性和效果评价方法如图1所示。

图1 固碳技术可行性和效果评价方法
2 活化CO2法固碳技术
将CO2化工资源化利用的难点源于CO2的热力学低能态,活化惰性CO2的关键是赋能还原和高效催化体系。国内外化学固碳技术的研究重点都集中在活化法路径中,共性特点是打开1个或者2个C=O双键。以H2为还原剂或制备还原物料,再转化CO2为其他化学品,现有的工业途径主要有CO2生产甲醇、尿素和碳酸酯等路径方案,如以H2制备NH3,再与CO2合成尿素,尿素固碳路径如图2所示。

图2 尿素固碳路径
按照图1的固碳评价法,直接以氢气为载体还原CO2生产甲醇,是化学反应过程最少的还原法固碳方法。甲醇技术路径又分为H2直接还原CO2和H2两步还原CO2,但二者均需提供高纯CO2气体,因此原料气还需进行除氧、富集和提纯等处理。
2.1 H2直接还原CO2的固碳路径
H2直接还原CO2见式(1),其中CO2加氢制甲醇催化剂是该化学路径工业化的核心技术。
(1)
ΔH=-49.5 kJ/mol
通过使用高效高活性的CO2合成甲醇催化剂,突破以CO和H2为原料生产甲醇的化石原料限制,减少水煤气变换加工环节,目前大连化物所和华东理工大学已经开始CO2制甲醇催化剂方面的工业试验,并且甲醇下游工业应用场景丰富、产品种类多样、经济价值高,是目前最合适的H2直接还原固碳方法之一,H2直接还原CO2的固碳路径如图3所示。

图3 H2直接还原CO2的固碳路径
2.2 H2两步还原CO2的固碳路径
逆水煤气变换(RWGS)反应是CO2和H2经热催化反应生成CO和H2O的过程,见式(2):
(2)
ΔH=+41.19 kJ/mol
该反应是吸热反应,受热力学条件限制,逆水煤气变换(RWGS)可逆反应的催化反应温度在400 ℃以上进行[3],同时伴随着H2还原CO2生成CH4的副反应,见式(3):
(3)
ΔH= -165 kJ/mol
因温度对RWGS反应热力学平衡的影响,研究重点是调控CO2加氢催化剂性能,提高CO选择性和转化率。RWGS耦合烃类脱氢或二氧化碳加氢制甲烷可以提高CO2转化率,但仍需解决未反应CO2从CO和甲烷产物中的分离循环,以及CO和甲烷产品分离提纯的高能耗问题,RWGS反应同样需要纯净的CO2原料气。
通过RWGS反应将CO2转化为CO后,可衔接目前的甲醇工业流程,见式(4):
(4)
ΔH= -102.5 kJ/mol
H2两步还原CO2的固碳路径如图4所示。

图4 H2两步还原CO2的固碳路径
相较H2直接还原CO2,两步合成CO2劣势更为明显,如过程步骤多、因副反应生成甲烷导致分离过程复杂、CO2转化率低导致整体能耗相对较高、高效稳定的RWGS催化剂尚未工业化试验等。
3 非活化法CO2固碳技术
非活化法固化CO2的技术特点是利用CO2与碱性物质形成含CO32-的酸碱配合物,CO2中的O仍与自身的C成键CO2由sp杂化成键转为CO32-的sp2杂化成键。
3.1 氨法CO2水溶液固碳路径
NH3与CO2合成尿素需打开1个C=O双键,而NH3在水溶液中与CO2发生复分解反应,CO2转化成CO32-,例如工业上生产Na2CO3、NaHCO3、(NH4)2CO3、NH4HCO3等产品,其装置是联碱装置和碳铵装置,均需提供高纯CO2原料气。联碱生产Na2CO3/NaHCO3固碳路径如图5所示,(NH4)2CO3/NH4HCO3固碳路径如图6所示。

图5 联碱生产Na2CO3/NaHCO3固碳路径

图6 (NH4)2CO3/NH4HCO3固碳路径
除载体和CO2结合的装置外,氨法CO2水溶液固碳与H2直接化合CO2的固碳路径相比,还需配套空分和合成氨装置,其投资和能耗大幅增加。另外(NH4)2CO3和NH4HCO3极不稳定,极易分解进入大气,不宜作为CO2固碳路径。
3.2 NaOH吸收CO2固碳路径
NaOH的溶解度大和强碱性的特点,使其成为高效的CO2化学吸收剂,并且生成的Na2CO3可以继续吸收CO2生成NaHCO3[4],NaOH的工业生产来自电解NaCl水溶液,副产的剧毒Cl2需配套盐酸或其他工业装置处理,系统复杂、投资高且能耗高,因此NaOH仅用于混合气中微量CO2的去除,如工业上液化气和烃类的脱碳精制。
3.3 金属氧化物矿化CO2固碳路径
CO2与钙镁的碱土金属氧化物可以形成稳定的矿化碳酸盐,使CO2可以长期不进入大气圈。碳酸盐是CO2在自然界最稳定和最安全的非气相存在形式,受制于浓度、接触条件和金属氧化物的存在形式,大气或气相中CO2的天然矿化时间漫长。国内对工业矿化固碳的研究集中在CO2直接矿化技术的理论和实验研究上,例如利用含有大量的钙、镁元素的天然矿物或粉煤灰、钢渣、电石渣等工业固体废物,进行干法或者湿法吸收CO2的碳酸化化学研究。
蔡佳晖[5]研究了国内外矿化CO2的几种技术,如BU、Fagerlund、Sanna、Kodama等研究人员分别提出的化学方程式组合循环方法,同时得出下面结论:固废吸收CO2的矿化固碳,其固碳规模化应用依赖于固废的多少和固废的活性碱浓度,从碳中和CO2体量的目标维度分析,固废矿化吸收CO2发挥的碳中和作用较小;基于天然钙镁硅酸盐矿石的CO2矿化技术具有大规模矿化的潜力,但对于CO2的提纯、原料预处理和试剂的再生需要较高的能量投入和成本消耗;CO2矿化技术仍然不具有理想的经济效益,工业化存在巨大障碍。
4 Na2S法固碳路径构思
非活化法固碳中CO2溶解于水转化为碳酸,碳酸能与金属氧化物发生酸碱中和反应,并产生矿化CO2效果。将金属氧化物拓展到同一主族的金属硫化物,也能与碳酸形成酸碱配合物。碱金属硫化物相较碱金属氧化物化学活性低。与碱金属氧化物不同的是,金属硫化物与碳酸反应释放产生H2S 实现碱金属硫化物吸收CO2固碳,将固碳问题转化为处理H2S的问题。通过H2还原正价硫的金属盐可制备金属硫化物,Na2SO4来源广,且Na2S溶解度和碱性大,因此Na2S是实现这一路径的良好载体。
通过以下化学反应过程耦合:
以H2还原Na2SO4可生成Na2S,见式(5):
(5)
ΔH=+55 kJ/mol
Na2S溶液化学吸收CO2可生成Na2CO3并析出H2S,见式(6):
Na2S+CO2+H2O = Na2CO3+H2S
(6)
Na2CO3可继续吸收CO2生成NaHCO3,见式(7):
Na2CO3+CO2+H2O = 2NaHCO3
(7)
H2S可转化成生成硫酸,见式(8):
H2S+2O2= H2SO4
(8)
产出的硫酸可与NaCl反应生成盐酸和Na2SO4,见式(9):
2NaCl+H2SO4= Na2SO4+2HCl
(9)
Na2SO4可循环进入H2还原Na2SO4的反应;H2S也可制成硫磺;形成以氢气为原料、以Na2S为载体吸收CO2、以Na2SO4和NaCl为钠盐来源的Na2S法化学固碳路径。Na2S固碳路径如图7所示。

图7 Na2S固碳路径
4.1 H2还原Na2SO4的研究和进展
目前工业上通过煤炭还原Na2SO4经转炉法生产Na2S,煤炭还原Na2SO4属于硫酸盐的碳热还原反应(TSR),在煤炭、石油和天然气成因机理中研究较多。TSR反应是形成金属硫化物、硫化氢及有机硫的途径[6],在地质高温高压条件下,重烃经TSR反应被硫酸盐氧化为短碳链烃[7]。H2气相流态化还原Na2SO4的技术尚未工业化生产,1955年国内学者章济元[8]对CO和H2还原Na2SO4进行了详细实验研究;李司直[9]对H2还原Na2SO4进行了热力学和动力学研究,提出H2还原Na2SO4属于未反应核模型类的反应机理;鲁晓凤[10]计算和验证了反应速率常数、表观活化能;陈银飞、刘华彦等研究人员[11-12]研究分析了H2还原Na2SO4的流态化实验,分析了反应温度、颗粒大小、催化剂、氢气浓度和气速对转化率的影响;周琳、王佳慧、郭艳秋等研究人员[13-15]进行了不同催化剂下H2还原Na2SO4的试验研究,验证了Fe及其氧化物是最佳催化剂;李文秀、张昱等研究人员[16-17]进行了焦炉气还原Na2SO4的流态化小试试验,提出加入脂肪酸可以防止反应物与产物共熔结块。综上文献得出,H2流态化还原Na2SO4已形成完善的实验和理论研究,具备工业化试验和设计基础。
4.2 Na2S吸收CO2的研究和分析
目前国内外尚未报道Na2S专门吸收CO2的固碳研究。吴晓琴[18]在研究Na2S净化吸收克劳斯装置尾气的实验时,尾气中的杂质CO2被Na2S吸收并产生H2S,增加了气相传质阻力;郭文娟[19]介绍了某辛集化工厂运行20多年的装置,该装置使用BaS吸收CO2生产BaCO3,同时产出H2S并经克劳斯装置生产硫磺;谢龙贵等研究人员[20]综述了使用CaS溶液捕集CO2的研究进展和应用前景;王永范[21]提出使用SrS吸收CO2生产H2S,再使用NaOH吸收H2S生产NaHS的专利方法;崔平[22]提出使用NaHS产物吸收CO2,用以净化分离获取高纯H2S的发明专利。第二主族金属Ca、Sr、Ba硫化物的碱性及溶解度均小于Na2S,可推断出Na2S吸收CO2固碳的可行性。
H2S水解的一级电离常数Ka1⊖=8.9×10-8,二级电离常数Ka2⊖=7.1×10-19,都比H2CO3的Ka1⊖=4.2×10-7和Ka2⊖=4.7×10-11小,鉴于酸的电离常数越大酸性越强、pH值越小,可知CO2和H2S溶液中酸性强度排列为H2CO3>H2S>HCO3->HS-,相应钠的强碱弱酸盐碱性由大到小为Na2S>Na2CO3>NaHS>NaHCO3。因此当Na2S水溶液通入CO2后,根据强酸制弱酸原理,该反应能够进行并达到可逆平衡。100 g水中Na2S、Na2CO3和NaHCO3的摩尔溶解度见表1。
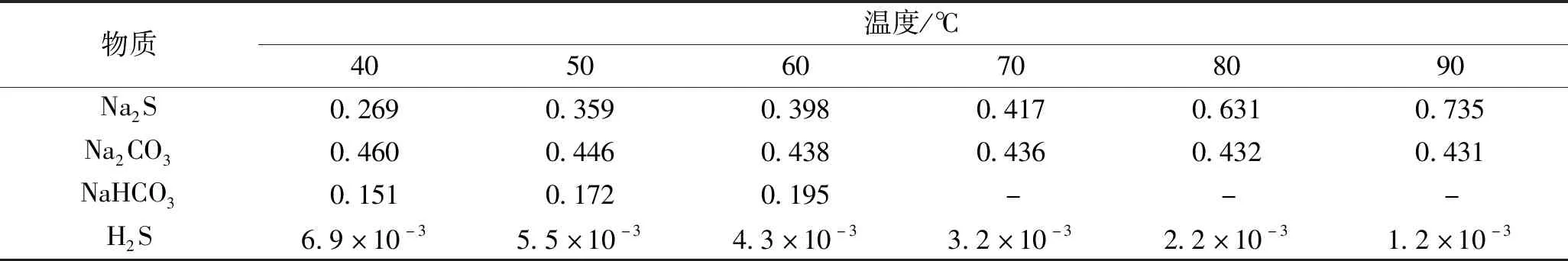
表1 100g水中Na2S、Na2CO3和NaHCO3的摩尔溶解度 mol
根据强酸制弱酸的电离常数原理,Na2S饱和水溶液吸收过量CO2能生成H2S,由于H2S的溶解度远小于Na2S,因此H2S不断解吸离开液相反应体系,并根据反应后产物气体析出效应,推动Na2S吸收CO2反应向正进行。
由表1可以看出,70 ℃时,100 g饱和Na2S水溶液吸收CO2后,消耗7.506 g溶剂水,并生成0.417 mol的Na2CO3,此时体系为Na2CO3过饱和溶液,因NaHCO3在70 ℃以上时不稳定,易分解成Na2CO3、CO2和水,因此Na2CO3溶液难以继续吸收CO2生成NaHCO3;当温度低于70 ℃时,即便Na2S溶解度比Na2CO3小,依据强酸制弱酸的电离常数原理,Na2S吸收CO2反应也能大幅进行,同时生成的Na2CO3可以继续吸收CO2生成NaHCO3。NaHCO3溶解度均比Na2S和Na2CO3小,且1分子Na2CO3产出2分子NaHCO3,因此会析出NaHCO3固体。
为此笔者进行了Na2S吸收CO2的验证性实验,配制出室温下Na2S饱和溶液,并配置CO2吸入管线,排放气处设置H2S检测管,为减少排放气中H2S的实验危害,将排放气通入NaOH溶液中吸收处理。缓慢通入CO2后,H2S检测管立即满量程变色,溶液吸收CO2后变混浊,溶液放热温度升高,通入CO2后期产生白色混浊沉淀现象。经计算分析,原因如下,一是1 mol的Na2S可生成2 mol的NaHCO3,反应产出的NaHCO3过量形成饱和溶液并析出结晶;二是NaHCO3本身溶解度比Na2S小;三是Na2S吸收CO2的反应消耗约10%的溶剂水。例如,在40 ℃下,使用饱和Na2S溶液吸收过量CO2,100 g溶剂水对应的饱和Na2S溶液,理论上能析出0.4 mol的固体NaHCO3,占NaHCO3总产物的75%。
4.3 Na2S吸收含氧CO2的流程设计
组合式(5)~(9),并结合成熟的电解水制氢工业、H2S制硫酸或硫磺工业、NaCl和硫酸制Na2SO4工业,可形成Na2S吸收CO2固碳工艺系统,包括电解水供氢单元、H2还原Na2SO4单元、Na2S溶液吸收CO2单元、Na2CO3处理单元、H2S处理单元以及硫酸制盐酸单元6个环节。原料是Na2SO4、NaCl、H2、水,产品是大苏打、小苏打、硫磺、硫酸和盐酸。简要步骤为电解水制得H2和O2,H2还原Na2SO4得到Na2S;通过Na2S溶液吸收CO2析出H2S实现CO2化学固碳;富H2S气制成硫磺或硫酸;硫酸与NaCl反应制得HCl和Na2SO4,Na2SO4固体可循环至Na2SO4还原单元。电解水制氢产生的O2可用于H2S的处理。
不含氧或含氧很少的含CO2工业气,如油田伴生气、页岩气、天然气田采出气、煤层气和煤炭及生物质能源制造的合成气,除酸性气外,其他物质不与Na2S反应,所以原料气可直接与Na2S混合吸收,省去原料气的CO2富集、捕集和提纯单元。
对于燃煤电厂过氧燃烧的CO2排放气,因组分含有O2,经Na2S直接吸收后产出的H2S也与O2混合,根据勒夏特列(Lechteilier)法则,吸收CO2的含H2S排放气如果是可燃性不爆炸的混合气体,可安全送至H2S处理单元制硫酸,同时后续的硫磺或硫酸单元相应减少氧气的配入。
4.4 Na2S吸收含氧、低浓度CO2的流程设计
如果含CO2原料气中含氧量较高,则Na2S吸收CO2产出的H2S容易形成含氧爆炸混合物;原料气中含CO2浓度很低,影响Na2S的吸收效率,同时经Na2S吸收后产出的H2S浓度过低,导致H2S处理单元不易生产操作。
对于此类含CO2的原料气,可在图7的流程基础上改变原料气的进入位置,先用Na2CO3吸收原料气中的CO2生成NaHCO3,产物NaHCO3热分解冷凝后产出高纯CO2和Na2CO3产品。高纯CO2送至Na2S洗涤吸收单元进行固碳,并产出高浓度H2S气体和Na2CO3溶液,Na2CO3溶液可用作原料气CO2的吸收液。H2S送至硫酸或硫磺单元处理,H2S氧化产生的热量可用于NaHCO3的分解和Na2CO3的干燥。低浓度CO2原料气的Na2S固碳路径如图8所示。

图8 低浓度CO2原料气的Na2S固碳路径
5 Na2S法固碳技术分析
Na2S法固碳反应是酸碱中和反应,反应温度和压力条件温和,吸收和分离过程简单。煤化工、石油化工和燃煤电厂等工业排放的含CO2气体,不需要进行原料气CO2提纯富集,将CO2捕集和固化同步进行。现有的CO2化工利用和CCUS中,均需将CO2除氧和提纯,投资、运行成本和过程能耗很大,导致后续CCS、CCUS等固碳技术不能更广泛和大规模的商业应用。为评价Na2S法化学固碳方法,依据图1从工艺技术、经济性和固碳效果方面,将其与甲醇法固碳法对比分析。
5.1 Na2S法和CH3OH法固碳技术对比
将Na2S法固碳路径中式(5)~(7)叠加得到总反应式(10):
与CH3OH法固碳路径式(1)进行比较可知:
(1)从化学方程式理论消耗上分析,分别采用Na2S法和CH3OH法均固定1分子CO2,需分别消耗2分子H2和3分子H2,即固定同样当量的CO2,CH3OH法消耗的H2是Na2S法的1.5倍,比较相应的光伏发电和制氢的投资成本,CH3OH法比Na2S法高50%。
(2)CH3OH法固碳需高纯CO2,原料气需经富集提纯和除氧,该过程一般采用低温甲醇洗、变压吸附或者乙醇胺吸收工艺,Na2S法无需此过程。
(3)H2直接还原CO2生产CH3OH需特殊的多组分催化剂,而H2还原Na2S的催化剂是铁或其氧化物,Na2S的催化剂较CH3OH制备简单。
(4)NaHCO3是不燃固体,不属于危险化学品,CH3OH有毒且是易燃液体,NaHCO3作为固碳产品,储存和运输相对容易。
5.2 Na2S法固碳经济分析
假设式(10)和式(1)完全反应,对Na2S法和甲醇法处理1 t的CO2分别进行反应当量计算,各物质价格估算如下:H2为1.5万元/t,Na2SO4为150元/t,NaHCO3为2 400元/t,H2SO4为300元/t,甲醇为2 700元/t,CO2为-50元/t。Na2S法反应后价格差为+3 335元,甲醇法为-27元。其他价格不变,当H2价格达到52 000元/t时,Na2S法固碳的价差才接近0元,这表明Na2S法对高价氢能的承受能力强。计算中CO2碳税价格一样,但Na2S法固碳不需对原料CO2提纯,可进一步降低CO2成本。从理想化学反应计量角度分析,Na2S法固碳的经济性优于CH3OH法固碳。
上述估算仅对原料消耗和产品产出进行估算,不考虑固定投资成本、物消、能耗以及人工、管理等其他费用,只做粗略的量化定性比较。因为其他费用与工艺的工业化水平关系很大,且二者目前均未实现工业化,难以准确估量。
5.3 Na2S法固碳效果分析
与CO2自然矿化类比,Na2S法固碳技术包含O、Na、H、C、S地球高丰度元素的迁移,包括了光合作用效果的太阳能制氢气和氧气、地质能源效果的Na2S生产、地质矿化效果的Na2S吸收CO2、地质火山效果的H2S制酸以及水汽循环效果的硫酸制盐酸等环节。Na2S法固碳在原料来源、热力学和能源消耗上具有较大优势。
(1)Na2S固碳法区别于CH3OH法的本质在于,Na2S固碳法将CO2置换成H2S,H2还原的对象是Na2SO4,H2与CO2不发生直接反应。而CH3OH法的本质是H2与CO2的直接反应,其属于CH3OH部分氧化的逆反应。
(2)CH3OH法固碳是用H2还原+4价C,需打开C=O键,由C原子经sp杂化与O原子形成的σ键和共轭离域π键组成;Na2S固碳法是用H2还原+6价SO42-,需打开S=O键,由S原子经sp3杂化与O原子形成的σ键和反馈π键组成。由于CO2的C=O键长(116 pm)小于SO42-的S=O平均键长(149 pm),C、O间电负性差值大于S、O间电负性差值,CO2中C=O键键级为2且键能大于一般C=O键,SO42-中S=O键键级为1.47且键能介于单键双键之间,综上各项因素对比可得,H2还原CO2需克服的键能壁垒大于H2还原NaSO42-。
(3)通过Na2S固碳工艺系统,CO2以Na2CO3和NaHCO3的物质形态从气相中分离固化,并副产硫磺或者硫酸产品,该类化学品是酸碱类工业基础原料,属于非易燃易爆物品,易于储存和运输,且Na2CO3和NaHCO3固碳周期长。
(4)在 Na2S固碳方法中,原料中各分子全部参与反应并输出产品。例如氧元素:电解水产出的O2用作H2S富氧燃烧生产硫酸;氢元素:还原Na2SO4产出的水用作电解制氢原料或配置Na2S吸收液进入H2S或者NaHCO3;硫元素:以-2、+6价不同形态的气相、固相、盐及酸的形态循环;氯元素:进入盐酸产品,最终形成环境友好的闭环循环绿色化工产业链。
(5)随着国内废水零排放政策的严格实施,工业水系统分盐结晶装置大量产出Na2SO4和NaCl工业废盐。通过Na2S固碳技术耦合清洁能源制氢,能同时达到工业废盐消纳、二氧化碳废气固碳和清洁能源利用的目的,实现以废治废、变废为宝的整体工业效果。
(6)CO2以NaHCO3形态固化,相较气相CO2直接注入地下封存,NaHCO3更容易在各类岩石地质体下永久封存,不会产生地下压力升高和气体沿裂隙泄漏的风险,NaHCO3在受热和酸性环境下才能缓慢向大气圈释放。相较CCUS注入地下封存,NaHCO3呈碱性且易与固相硫化类矿物质再次反应,与CO2溶蚀岩石相比造成的地质结构风险小。Na2S固碳法在固碳的同时,H2S还作为气相高能物质,其热值仅次于甲烷,不会造成清洁能源的浪费,并且H2还原Na2SO4是吸热反应,H2还原CO2合成甲醇是放热反应,从反应产物储能角度分析,Na2S法比CH3OH法具有更高的能量利用和储存效率。
(7)综合C元素全生命周期的CO2净固碳效果分析,CH3OH作为能源使用后便失去固碳效果。Na2S法产出的硫酸或硫磺产品的使用不影响NaHCO3的固碳效果。如果NaHCO3不再进入大气流通,可作为永久产品封存CO2。
(8)Na2S法固碳产品NaHCO3可以与微藻和菌类混合培养耦合叠加,能大幅提高光合作用吸收CO2固碳效率和脂类的产出,可提高生产生物柴油的效率[23]。另外,NaHCO3可与人工生物固碳技术耦合,可加快CO2向碳水化合的二次转移,提高生物光合作用固碳的效率。
(9)Na2S法固碳产品NaHCO3可以与绿硫细菌、厌氧菌、古菌等生物固碳路径相结合,利用还原性三羧酸循环固碳原理,这类细菌能利用HCO3-形态的碳源,以2-酮戊二酸合酶、异柠檬酸脱氢酶、乙酰辅酶A羧化酶、丙酰辅酶A羧化酶碳、丙酮酸合酶和磷酸烯醇丙酮酸羧化酶进行催化羧化固碳,通过人工适当基因改造和优化表达,可提高酶的活性和固碳效率,是发展潜力很大的固碳路径[24]。
6 结论
(1)笔者提出的Na2S法化学固碳路径,将电解水制氢、H2还原Na2SO4、Na2S溶液吸收CO2、NaHCO3/Na2CO3分离、H2S制硫酸或硫磺以及硫酸制盐酸这6个化工单元进行创新式工艺组合和流程叠加,形成以清洁能源制氢耦合气相流态化还原硫酸钠为核心的绿色Na2S法固碳路径。在一系列无机化学反应的关联过程中,通过S元素的参与,形成固化CO2的闭环化学反应链,将化学固碳研究重点由H2还原CO2的碳基问题,转化成H2还原Na2SO4的硫基问题,为大气中CO2脱除提供了新思路。
(2)本文又从CO2的固化和能量储存这2个维度进行了分析,得出甲醇法固碳将CO2还原进行能源化利用,但CO2仅起到能源载体介质的作用,对外输出的能量并非来自CO2本身,其本质上仍然是H2的能量利用,而CH3OH同时又是碳载体,其被完全使用后便失去固碳效果;Na2S法固碳可将CO2转变为碳酸盐实现固碳,同时释放出富含高能态的H2S,该过程本质上完成了固碳载体和能量载体的分离,能量的利用不影响固碳效果。
(3)运用图1对Na2S法固碳进行可行性和效果评价,以Na2S为载体的固碳技术是一种理论上可行、原料来源广、地域适用性强、可规模化生产、可实现低碳过程生产、固碳效果好的工艺技术方案。Na2S法固碳载体原料是Na2SO4和NaCl,我国Na2SO4储量约378亿t[25],占全球储量的90%以上,大海中的NaCl资源极其丰富,具备原料来源广泛的基础。Na2S载体生产仅受H2供给和Na2S生产环节限制,随着我国太阳能和风能比例逐年上升,通过光伏+风能发电和电解水制氢获得绿氢,能实现高效、低成本、规模化、低碳生产Na2S,固碳产品NaHCO3能与人工生物固碳技术相结合,形成系统的化工+生物固碳产业链。
(4)Na2S化学固碳路径将CO2捕集、固定和利用一步法完成,并同时够解决工业Na2SO4和NaCl的消纳问题,具有减污降碳的多重作用,是实现碳中和有效可行的方法,有助于提升我国碳中和话语权和国际战略地位。
