清胰颗粒对重症急性胰腺炎大鼠肾脏AQP4 蛋白表达及肾功能的影响
2023-02-20杨元生叶东雯彭卫斌陈垦谢文瑞容海鹰
杨元生,叶东雯,彭卫斌,陈垦,谢文瑞,容海鹰
(1.广州新海医院,广东广州 510300;2.广东药科大学临床药学院,广东广州 510310;3.广东药科大学附属第一医院,广东广州 510800)
急性胰腺炎(acute pancreatitis,AP)是以炎症反应和胰腺自身消化为主要特征的临床常见急腹症,临床诊治不及时可进展为重症急性胰腺炎(severe acute pancreatitis,SAP)合并远处脏器损害,SAP 约占AP 的10%~20%,起病凶险,早期脏器功能损害以肝(76.4%)、肺(72.7%)和肾(45.5%)最多,尽管目前医疗水平提高后SAP 病死率有所下降,但仍高达10%[1-2]。因此,探讨有效治疗药物是降低SAP 病死率的迫切需要。本课题组于2007 年由陈垦教授主持广东省课题研制中药复方清胰颗粒,清胰颗粒含大黄、丹参、芒硝、赤芍等多味药材按一定比例组成,由广东康诚堂医药科技有限公司提供,每克含生药6.15 g。药材购自广州采芝林药业连锁店,均经广东药科大学中药学院李书渊教授鉴定。本方依据大承气汤组方[3]优化成清胰汤,后经过多年药物制剂实验调制研究开发成固体颗粒剂型,随后多年进行了动物毒理学和药理学实验研究,包括清胰颗粒对NF-κB 炎症通路及氧化应激等的作用,结果证实清胰颗粒可有效治疗SAP,且无明显毒副作用[4-5]。水通道蛋白4(aquaporin protein 4,AQP4)为分布广泛并参与水及甘油等小分子转运的膜通道蛋白,具有多种生物学效应。研究显示AQP4 表达改变可影响重要器官水代谢平衡,严重影响器官功能[6]。本课题所用清胰颗粒由陈垦教授赠予,本研究拟通过探讨AQP4在SAP大鼠肾脏组织中表达变化对肾功能的影响,从而明确QYG 治疗SAP 肾损伤大鼠的作用机制。
1 材料与方法
1.1 实验动物
SD 大鼠,雌雄不限,体质量250~300 g,由广东省医学实验动物中心提供,生产许可证号:SCXK(粤)2018-0002。
1.2 主要试剂和仪器
AQP4多克隆抗体(美国Santa Cruz公司,批号:sc-32739);辣根过氧化物酶标记二抗(山羊抗兔,批号:bs-80295G-HRP)、β-actin(批号:bsm-33036M)、ECL 发光试剂盒(批号:C05-07004)和肾损伤因子试剂盒(Kim-1,批号:bsk11070)均购自博奥森公司;通用型SP-9000 试剂盒(北京中山金桥,批号:SP-9000);白介素-6(IL-6,批号:bsm-10807M)和肿瘤坏死因子(TNF-α,批号:CME0004)ELISA 试剂盒均购自美国eBioscience 公司;牛黄胆酸钠(美国Sigma 公司,批号:T7515);戊巴比妥钠(美国Sigma公司,批号:11715);地塞米松(dexamethasone,DXMS,山东新华制药有限公司,批号:H37020291);清胰颗粒(广东药科大学自备,规格:10 mg/包,每克含生药6.15 g);HITACHI 全自动生化分析仪(日本日立公司);Anthos2010 型酶标仪(Anthos tabtec instranents 公司);Image-pro PLUS6.0 显微图像系统(Media Cybernetics公司);切片机(徕卡RM2135)。
1.3 大鼠SAP肾损伤模型的建立
实验前SD 大鼠禁食不禁水12 h,以3%(φ)戊巴比妥钠(0.1 mL/100 g)腹腔内注射麻醉SD大鼠后固定于手术台,2%络合碘消毒。沿腹正中线开腹提取十二指肠,辨认出胰胆管及肝门部胆总管。找到十二指肠乳头开口,在其开口略偏下对侧系膜缘肠壁上选一无血管区,用5号注射器针头戳一小孔,置入预先备好拉细的硬膜外导管,向乳头开口方向逆行探入胰胆管内,逆行推进4~5 mm 后在胰胆管下段及其内导管一并缝扎关闭肝门部胆总管,以防止导管脱出及牛磺胆酸钠进入十二指肠和肝脏。导管末端接输液转换器,用微量泵逆行泵入5%STC(0.1 mL/100 g,0.2 mL/min),2~3 min后即可见胰腺充血、水肿、胰胆管及主胰管扩张。维持8~10 min后解除结扎,退出导管。按压肠壁穿刺孔1~2 min,将肠管复位,逐层关腹。假手术组(SO组)仅翻动十二指肠、胰腺后关腹。所有大鼠术后均于大腿外侧皮下补液(生理盐水2 mL/100 g),苏醒后禁食不禁水。SAP 并发肾损伤模型的鉴定:建模24 h 后取大鼠耳静脉血采用Kim-1 试剂盒检测血清Kim-1 水平,Kim-1水平≥正常大鼠3倍视为建模成功[4]。
1.4 分组与给药
SD大鼠64只,随机分SO组、SAP组、QYG组和DXMS 组,每组16 只,SAP 组和QYG 组于造模前12 h 每只大鼠分别给予生理盐水(1 mL/100 mg)和QYG(1 mL/100 mg)灌胃,建模后禁食不禁饮,QYG组大鼠给予QYG 兑水1∶1(w∶w)灌胃(1 mL/100 g)每12 h 1次,DXMS组大鼠给予DXMS肌注(5 mg/kg),每天1次,SO组大鼠不予药物干预,分别于48 h和72 h 两个时间点心脏采血。
1.5 大鼠肾干湿质量比及其肾脏系数
称大鼠体质量后,心脏采血处死取左肾去除被膜,称其湿质量,后放入干燥箱中105 ℃烘干至恒重(2 次干质量之差<0.2 mg),称其干质量,再测干质量/湿质量;大鼠肾脏系数=肾脏湿质量/大鼠体质量×100%。
1.6 血清AMS、Scr和BUN水平的检测
大鼠心脏采血2 mL,室温凝固2 h、低温低速(4 ℃,3 500 r/min)离心后取其上清液,-20 ℃保存。应用HITACHI全自动生化分析仪检测各组大鼠血清中淀粉酶(AMS)、Scr和BUN不同时间点的变化水平。
1.7 血清IL-6和TNF-α水平的检测
大鼠全血处理方法同上,按IL-6 和TNF-αElisa试剂盒操作步骤测大鼠血清IL-6 和TNF-α的表达水平,各指标重复1 次,取均值统计分析,观察各组大鼠不同时间点炎症因子的变化趋势及其相关性。
1.8 大鼠肾脏组织病理观察
取大鼠右肾组织,用10%(φ)甲醛过夜固定、脱水、石蜡包埋,病理切片(厚度为4 μm),HE 染色后,晾干封片,光镜下按肾脏组织中炎性细胞浸润、充血水肿和组织出血及细胞坏死3个维度各自面积百分比打分(正常:0分,0<10%:1分,10%~25%:2分,25%~50%:3 分,50%~75%:4 分,>75%:5 分)对肾脏组织病理进行双盲评分[7]。
1.9 肾脏AQP4蛋白的检测
1.9.1 免疫组化法定性检测 取肾脏组织切片,常规融蜡、脱蜡、脱水,按中山金桥SP-9000 免疫组化试剂盒步骤操作,一抗AQP4(1∶50),DAB试剂盒显色,晾干、封片,着色细胞为AQP4 表达阳性。阴性对照用磷酸盐缓冲液(PBS)替代一抗。光镜下按阳性细胞百分率:<10%为(-),10%~25%为(+),25%~50%为(++),>50%为(+++);染色强度:基本不着色为(-),淡黄色为(+),黄色为(++),棕黄色为(+++),对肾脏组织免疫组化结果进行双盲评分。
1.9.2 Western blot法定量检测 取大鼠肾组织150 g,眼科剪剪碎移入匀浆器中,加入655 μL 组织裂解液和38 μL PMFS 混合匀浆,冰上反应30 min,4 ℃12 000 r/min 离心10 min 后取上清液,按BCA 蛋白定量试剂盒方法制定标准曲线并计算出样品蛋白浓度,取50 μg 蛋白为上样量,6%浓缩胶和10%分离胶电泳分离蛋白质,半干胶电转移凝胶蛋白至PVDF 膜上,5%脱脂奶粉室温封闭PVDF 膜2 h,一抗AQP4(1∶300),室温孵育2 h,TBST 洗膜3 次,二抗(1∶8 000)室温孵育1.5 h,TBST 洗膜3 次,按ECL 试剂盒方法发光,暗盒曝光、显影、定影,用Image-pro PLUS6.0 显微图像系统拍片分析图像灰度。内参β-actin(1∶700)Western blot 步骤同上。以上操作均重复2次。
1.10 统计学方法
采用SPSS19.0 统计软件进行分析,实验数据以表示。组间比较运用重复测量两因素多水平方差分析,配对资料t检验和多因素间相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组肾脏干湿质量比和肾脏系数
SAP 组大鼠的肾脏干湿质量比较SO 组下降,差异有统计学意义(P<0.05),QYG 组、DXMS 组肾脏干湿质量比与SAP组比较差异有统计学意义(P<0.05),SAP组大鼠肾脏系数较SO组增大(P<0.05),QYG 组、DXMS 组大鼠肾脏系数与SAP 组比较减小,差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠肾脏干湿质量比和肾脏系数比较Table 1 Comparison of kidney dry wet weight ratio and kidney coefficient of rats in each group (,n=16)

表1 各组大鼠肾脏干湿质量比和肾脏系数比较Table 1 Comparison of kidney dry wet weight ratio and kidney coefficient of rats in each group (,n=16)
与SO组比较:*P<0.05;与SAP组比较:△P<0.05。
2.2 各组血清AMS、BUN和Scr结果比较
SAP大鼠血清AMS水平较SO组明显升高,72 h有所下降,但仍高于SO 组,SAP 组的各指标与SO组比较均具有统计学差异(表2,P<0.05)。QYG、DXMS 治疗组各时间点峰值下降,72 h 下降显著(P<0.05)。SAP 大鼠血清BUN 和Scr 含量均高于SO大鼠,经QYG和DXMS治疗后均有下降,72 h降低明显,DXMS 组效果优于QYG 组,组间比较差异有统计学意义(P<0.05),见表2。
表2 各组大鼠血清AMS、BUN和Scr水平比较Table 2 Comparison of serum AMS,BUN and Scr levels in rats of each group(,n=16)
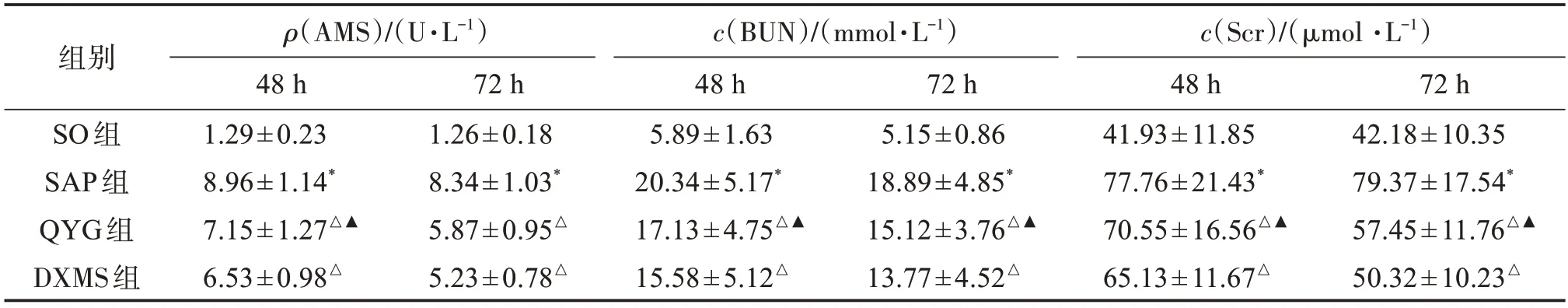
表2 各组大鼠血清AMS、BUN和Scr水平比较Table 2 Comparison of serum AMS,BUN and Scr levels in rats of each group(,n=16)
与SO组比较:*P<0.05;与DXMS组比较:▲P<0.05;与SAP组比较:△P<0.05。
2.3 各组血清IL-6和TNF-α含量比较.
血清IL-6 和TNF-α含量在SO 组大鼠各时间点均变化不大,但在SAP 大鼠中显著升高,IL-6 水平48 h 达到峰值,72 h 有所回落,而TNF-α则持续升高,与SO 组比较差异有统计学意义(P<0.05)。经QYG 和DXMS干预后两指标均有下降,72 h效果明显,效果呈现时间依赖性,DXMS 组疗效优于QYG组,与SAP 组比较差异有统计学意义(P<0.05)。见表3。血清IL-6 与TNF-α水平相关分析显示r=-0.032,P=0.952,结果提示IL-6与TNF-α表达无明显相关性。
表3 各组大鼠血清IL-6和TNF-α变化Table 3 Changes of serum IL-6 and TNF-α in rats of each group(,n=16) ρ(ng·L-1)

表3 各组大鼠血清IL-6和TNF-α变化Table 3 Changes of serum IL-6 and TNF-α in rats of each group(,n=16) ρ(ng·L-1)
与SO组比较:*P<0.05;与DXMS组比较:▲P<0.05;与SAP组比较:△P<0.05。
2.4 肾脏病理结果
SO组大鼠肾脏无明显病理损伤,SAP组可见肾脏细胞充血水肿,炎性细胞浸润,甚至出血、坏死,部分肾脏结构模糊,并出现肾小球固缩现象,48 h病理改变明显;予QYG 和DXMS 治疗后SAP 大鼠肾脏的病理损伤减轻,病理评分下降,治疗72 h 改善明显,QYG 组效果略逊于DXMS 组,与SAP 组比较有统计学意义(图1)。SAP 组大鼠肾脏病理评分与其血清IL-6 与TNF-α水平相关分析呈正相关性(r=0.675,r=0.583)。

图1 大鼠72 h肾脏病理HE染色结果(200×)Figure 1 Pathological HE staining results of rat kidney at 72 h(200×)
2.5 肾脏AQP4蛋白免疫组化结果
免疫组化显示AQP4蛋白主要表达于近端肾小管和肾髓质部位,在SO 组2个时间点表达较少且变化不大,在SAP 大鼠则随时间推移AQP4 表达明显上调,48 h表达显著增多;经QYG和MXDS治疗后,AQP4 蛋白表达较同期SAP 组大鼠减少,72 h 下调明显(图2)。

图2 大鼠72 h肾脏AQP4免疫组化结果(IHC,40×)Figure 2 Immunohistochemical results of AQP4 in rat kidney at 72 h(IHC,40×)
2.6 肾脏AQP4免疫印迹结果
免疫印迹显示AQP4 蛋白在SO 组两个时间点表达量较少且相对稳定,在SAP组两个时间点表达量均明显增多,与SO 组比较有统计学差异(P<0.05);经QYG 和DXMS 干预后AQP4 表达下调,有时效性,72 h下降显著,DXMS组疗效优于QYG 组,但仍高于同期SO 组表达量(图3)。相关分析提示SAP组大鼠肾脏AQP4 蛋白表达量与血清TNF-α和IL-6水平呈正相关(r=0.764,r=0.784)。
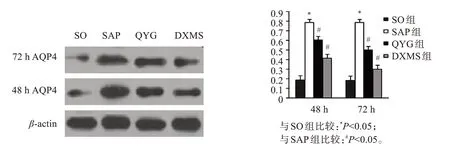
图3 各组大鼠肾脏组织AQP4蛋白免疫印迹结果及免疫印迹评分统计图Figure 3 Immunoblotting result of AQP4 protein in kidney tissues of rats in each group
3 讨论
AP 为临床常见多发急腹症,约有10%~20%可进展为SAP,并发多器官损害,如肝、肺和肾等,SAP并发肾损伤的发生率为45.5%[1],导致肾损害的机制目前尚未明确,可能与多因素有关。肾脏是机体排泄代谢毒物最重要的器官,SAP 时有效血容量减少、过度炎症反应和氧化应激可直接致肾损伤,重者肾衰竭危及生命。研究显示TNF-α和氧自由基(0FR)对肾脏有直接毒性作用[8]。前期研究显示5%STC 诱导大鼠SAP 易并发肝肾损伤[4],本研究发现SAP 大鼠血清AMS、Scr 和BUN 显著升高,肾脏干湿质量比下降,肾脏系数减小,肾脏病理损伤明显,提示本实验构建的SAP 肾损伤模型成功。深入分析发现SAP 大鼠早期血清TNF-α和IL-6 即升高,但相关分析显示血清TNF-α和IL-6与肾脏病理损伤评分呈正相关,提示SAP 大鼠爆发严重的炎症反应参与触发SIRS和多器官功能障碍综合征(MODS)。
TNF-α诱导IL-l、IL-6、内皮素-1(ET-1)表达增多,增加肾血管通透性,使IL-1 和IL-6 渗入组织间隙,ET-1 强烈收缩肾血管,不利于炎症因子的清除。研究显示SAP 大鼠肾组织中TNF-αmRNA 表达明显升高,提示TNF-α可能在SAP 并发肾损伤中具有重要作用[7,9]。中药可改善脏器微循环,减少ET 分泌入血、增加血流,有利于清除炎症介质,从而改善SAP 引起的肾损伤[3-4,10]。尽早用中药干预SAP 可保护肠道屏障和抑制炎症反应从而减轻SAP 的严重程度[11-12]。清胰汤可明显降低SAP 患者血中TNF-α、IL-6、IL-8 浓度和提高免疫功能从而显著改善患者的预后[12]。DXMS 能有效抑制机体炎症反应,减少炎症因子释放和改善肾脏血流[13]。本研究发现SAP大鼠经QYG和DXMS治疗后,血清AMS、TNF-α、IL-6、Scr和BUN水平有所下降,干预48 h所有指标下降明显,72 h 更显著,结果表明QYG 可有效减轻SAP大鼠的炎症反应和肾损伤,QYG护肾效果呈时效依赖性,但QYG 组疗效稍逊于DXMS 组。综上,清胰颗粒通过抑制SAP 大鼠的炎症反应可有效保护其肾功能并改善SAP病情。
AQPs 在全身许多器官均有表达,肾脏表达AQPs蛋白可能参与体液成分的急性或慢性调节[14]。AQP4是AQPs蛋白家族成员之一,主要表达于肾脏远曲小管和集合小管上皮基底外侧膜,与AQP3 一起对集合管上皮顶质膜AQP2重吸收的水分起扩散和渗透作用[15]。研究发现TNF-α信号通过肿瘤坏死因子受体-1(TNFR1)路径介导上调AQP4[16];重组IL-1 可使培养的星形胶质细胞AQP4 表达增加,但其诱导效应呈浓度和时间依赖性,抑制NF-κB 通路可阻断IL-1 浓度依赖性AQP4 表达[17]。抑制大脑炎症反应,下调IL-6水平,可降低AQP4表达[18]。AQP4 上调使水分子更易弥散入肾脏组织间隙,加重肾脏水肿和功能损伤。本研究显示SAP 大鼠血清TNF-α和IL-6 浓度升高与肾脏组织中AQP4 蛋白表达量均呈正相关,提示TNF-α和IL-6 可上调AQP4 表达。据报道大黄能抑制胰腺炎大鼠的炎症反应、清除自由基和减少肠道毒素吸收从而减轻器官损伤和改善临床症状[19],研究显示大黄可抑制大鼠肾脏AQP2 和AQP4 蛋白及其mRNA 表达,下调AQPs 表达引起多尿、烦渴[20]。本研究显示SAP大鼠经QYG 和DXMS 干预后血清TNF-α和IL-6 含量下降,肾组织中AQP4 蛋白表达量减少,血清BUN 和Scr 水平降低,肾脏病理损伤减轻,肾干湿质量比升高,证实QYG 和DXMS 均可有效保护SAP 肾脏。
综上所述,本实验发现,SAP 大鼠血清TNF-α和IL-6 水平和肾脏AQP4 表达量在早期即升高,TNF-α和IL-6 明确参与肾损伤。可见,AQP4 参与SAP 并发肾损伤病理生理过程。SAP 大鼠经QYG和DXMS 干预后大鼠血清TNF-α、IL-6、BUN 和Scr含量下降,肾脏AQP4表达量减少,水重吸收和弥散改善,肾脏病理损伤减轻,二者均有保护肾脏作用。推测QYG 可能通过抑制炎症因子TNF-α、IL-6 表达使肾脏AQP4 表达下调从而起到保护肾脏作用,其分子机制还需进一步深入探讨。
