盐酸帕唑帕尼片的制备及体外溶出度评价
2023-02-20刘元芬王纠
刘元芬,王纠
(1.江苏卫生健康职业学院,江苏南京 211800;2.广东省药物新剂型重点实验室,广东广州 510006;3.广东药科大学新药研发中心,广东广州 510006;4.广东省高校药物缓控释制剂工程技术研究中心,广东广州 510006;5.广东省局部精准药物递药制剂工程技术研究中心,广东广州510006)
肾癌是泌尿系统常见的恶性肿瘤之一,根据相关统计数据,肾细胞癌是最常见的肾癌类型,约占肾癌的90%~95%,是世界上最常见的7 种癌症之一[1]。全球每年诊断出约270 000 例肾细胞癌新病例,其中有116 000 例死亡,在晚期肾细胞癌患者中,5年生存率仅为13%[2]。
帕唑帕尼是一种可干扰顽固肿瘤存活和生长所需的新生血管生成的新型口服血管生成抑制剂,靶向作用于血管内皮生长因子受体(VEGFR)而起作用[3-4]。盐酸帕唑帕尼(pazopanib hydrochloride table,PZH)片为葛兰素史克公司开发的酪氨酸激酶抑制剂,商品名为Votrient®,规格为0.2 g(以帕唑帕尼计)。2011 年欧洲药品管理局(EMA)[5]、2012 年美国食品和药物管理局(FDA)[6]批准上市销售,适用于治疗晚期肾细胞癌和晚期软组织肉瘤,推荐剂量为800 mg,每天1次。目前,PZH片尚未在我国上市销售,按《药品注册管理办法》分类,属新药3类。
PZH 化学名为5-[[4-[(2,3-二甲基-2H-吲唑-6-基)甲氨基]-2-嘧啶基]氨基]-2-甲基-苯磺酰胺盐酸盐(化学结构式见图1),分子式为C21H23N7O2S,为类白色至淡黄色结晶性粉末,微溶于甲醇,极微溶于乙醇,在pH=1的水中微溶,几乎不溶于pH值高于4的水中[7]。

图1 盐酸帕唑帕尼的化学结构Figure 1 Formation of pazopanib hydrochloride
溶出度是体外评价口服固体制剂性能的重要指标。因此,本研究建立了PZH 片的体外溶出度测定方法,最后采用相似因子法评价自制PZH 片与市售PZH 原研片的溶出度相似性,为PZH 的进一步开发提供依据。
1 仪器与试药
1.1 仪器
20AD 高效液相色谱仪、SPD-20A 检测器及Labsolution色谱工作站(日本岛津公司);菲罗门C18色谱柱(5 μm,4.6 mm×250 mm,美国安捷伦公司);电子分析天平(十万分之一,瑞士梅特勒);ZRS-8智能溶出仪(天津大学无线电厂);UV-1780 紫外分光光度计(日本岛津公司);YK-160 摇摆式颗粒机(上海天祥健台制药机械有限公司);GSH-10C 高效湿法混合制粒机(重庆智龙制药设备有限公司);ZP-8压片机(上海天祥健台制药机械有限公司);BGB-5F高效包衣机(浙江小伦制药机械有限公司)。
1.2 试药与试剂
PZH 原料药(自制,质量分数不低于99.0%,经检测晶型与原研药一致);PZH 对照品(自制,质量分数99.8%);PZH 原研片(Votrient,葛兰素史克公司,批号2010);微晶纤维素、羧甲基淀粉钠、硬脂酸镁(上海昌为医药辅料技术有限公司);聚维酮(巴斯夫中国有限公司);薄膜包衣预混剂“欧巴代”(上海卡乐康包衣技术有限公司);乙腈为色谱纯;其他试剂均为分析纯,水为娃哈哈纯净水。
2 方法与结果
2.1 PZH片的制备
参照原研药品说明书[7]和文献[8],称取PZH 216.7 g,微晶纤维素63 g,聚维酮K30 16 g,羧甲基淀粉钠22 g 和硬脂酸镁3.2 g。包衣材料为羟丙基甲基纤维素、聚乙二醇400(PEG400)、聚山梨酯80、FeO、TiO2,包衣增重2%~3%。将微晶纤维素、聚维酮K30、羧甲基淀粉钠过80目筛备用,PZH用气流粉碎机粉碎,粉碎后测定粒度,控制原料药物的粒度d0.9≤50 μm。按处方量称取粉碎的PZH、微晶纤维素、聚维酮K30、羧甲基淀粉钠(内加)置湿法混合颗粒机中混合,搅拌速度为100 r/min,切碎速度设为低速,混合时间为5~10 min;加入适量水溶液,混合搅拌5~10 min,前2 min 搅拌速度为100 r/min,切碎速度设为低速,后3~10 min 搅拌速度为200 r/min,切碎速度设为高速,出料。将所制软材经多功能整粒机(20目)制湿颗粒,60 ℃进行干燥,约1 h后翻转颗粒1次,干燥2 h后,每隔30 min取样检测干燥失重,控制干燥失重≤2.0%,切断电源,冷却至室温,出料。干颗粒经整粒机(24目)进行整粒。将颗粒与处方量的羧甲基淀粉钠(外加)和硬脂酸镁加入总混机中,设定总混转速20 r/min,总混时间15~20 min,出料,称定质量,取样检测。取总混后经检验合格的颗粒,调整好片重及压力后进行压片,控制片硬度9~12 kg,每30 min检查1次外观及片重差异。
薄膜包衣预混剂(欧巴代13B575000)水溶液的配制:将欧巴代13B575000加入纯化水中,搅拌使之分散,再用机械搅拌器搅拌60 min,使之完全溶胀,100 目筛滤过,除去粗颗粒(以防堵塞喷枪),即制备成固含量10%的欧巴代13B575000水溶液,备用。
包衣:将素片称量后置于包衣锅中,设置进风温度、包衣锅转速、蠕动泵转速、进风转速和出风转速,以及雾化压力0.25 MPa,待片床温度预热至40 ℃左右,启动空气压缩机,打开空气阀及膜液阀,调节二者流量以适宜的喷雾速度进行喷雾包衣,包衣增重控制在2%~3%,停止包衣,干燥、封存。最后装瓶。
2.2 PZH自制片中PZH质量分数的测定
2.2.1 色谱条件[9]检测波长:270 nm;流速:1.0 mL/min;柱温:35 ℃;流动相:0.1%三乙胺溶液(用磷酸调节pH值至6.0)-乙腈(体积比60∶40);溶剂:50%乙腈。
2.2.2 测定方法 取本品20 片,精密称定,研细,细粉适量(约含PZH 25 mg)置50 mL 量瓶中,用50%乙腈溶解并稀释至刻度,摇匀,滤过,精密量取续滤液2 mL置10 mL量瓶中,用50%乙腈溶液稀释至刻度,摇匀,即得样品溶液。另取PZH 对照品适量,精密称定,加溶剂溶解并稀释制成每1 mL 中约含PZH 0.1 mg 的溶液,作为对照品溶液。精密吸取对照品溶液与供试品溶液各10 μL,注入液相色谱仪,记录色谱图,按外标法以峰面积计算供试品中PZH的质量分数。自制3 批样品,每份测定3 次,质量分数测定结果为(99.76±1.03)%。
2.3 PZH原料药的溶解度测定
PZH 的水溶性较低(美国食品和药物管理局,2009 年[7]),但其肠道通透性被认为很高(澳大利亚治疗用品管理局,2010 年[10]),因此,该药物在生物药剂学分类系统(BCS)中被归类为Ⅱ类化合物,表明其吸收和生物利用度主要受到溶解度的限制,对PZH的溶解性进行研究非常有必要。
2.3.1 PZH原料药在不同pH溶液中的溶解度 取过量的PZH 原料药,分别加入以下不同pH 值的溶液中,超声溶解30 min后,37 ℃水浴保温24 h,滤过,制成不同pH 值条件下的饱和溶液。加PZH 对照品适量,精密称定,加50%乙腈溶解,稀释到相应浓度作为对照品溶液。按“2.2.2”项方法进行测定,结果见表1。可见,PZH 原料药的溶解度受pH 值影响很大,在pH 2.0以上,最高剂量溶解体积>胃肠液(250 mL)。

表1 PZH原料药的溶解度与酸碱度的关系Table 1 Relationship between PZH solubility and pH of solution
2.3.2 PZH原料药在不同SDS 浓度的乙酸盐缓冲液(pH 4.5)中的溶解度试验 采用“2.3.1”项下方法同样考察PZH原料药在不同SDS浓度的乙酸盐缓冲液(pH 4.5)中的溶解度,结果见表2。可见,0.75% SDS和1.0% SDS 浓度pH 4.5 乙酸盐缓冲液最小漏槽体积<溶出介质体积(900 mL),能达到漏槽条件,其他浓度均不能达到漏槽条件。
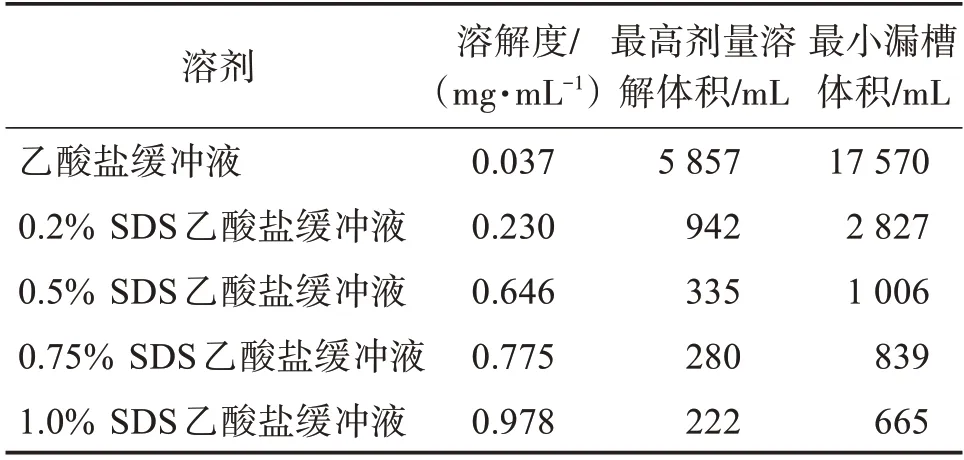
表2 PZH 原料药在不同SDS 浓度的乙酸盐缓冲液(pH 4.5)中的溶解度试验结果Table 2 Solubility of PZH in pH 4.5 dissolution media with different SDS content
2.4 PZH片溶出度测定方法的建立
2.4.1 检测波长的选择 取PZH 对照品适量,用适量的甲醇溶解后,分别用pH 4.5 乙酸盐缓冲液(含0.75% SDS)、pH 1.2 的盐酸溶液、pH 4.5 的乙酸盐缓冲液以及pH 6.8 的磷酸盐缓冲液稀释成约含PZH 7 µg/mL 的溶液,照紫外-可见分光光度法(2020 年版《中国药典》)[11]进行扫描,结果显示本品在270.8 nm 波长附近均有最大吸收。因此,选择270 nm作为检测波长。
2.4.2 专属性试验 按20片的处方量称取除PZH外的各辅料,混合均匀,称取混合辅料100 mg(约1片的辅料量)置1 000 mL量瓶中,加pH 4.5乙酸盐缓冲液(含0.75% SDS)900 mL,超声10 min。取上述溶液适量,经0.45 μm 滤膜滤过,取续滤液3 mL 至100 mL量瓶,加pH 4.5 乙酸盐缓冲液(含0.75% SDS)稀释至刻度,摇匀,即得辅料溶液。取辅料溶液在200~400 nm 波长范围进行扫描,结果显示辅料在测定波长270 nm 处无吸收,吸光度测定结果为0.000,表明辅料对测定结果无干扰。
2.4.3 滤膜吸附试验 取“2.4.5”项下溶出液适量,采用高速离心方法,取上清液3 mL置100 mL量瓶中,用溶出介质稀释至刻度,摇匀,作为供试品溶液1;另取“2.4.5”项下溶出液适量,分别经0.45 μm的微孔滤膜(水系和有机系)过滤,取续滤液3 mL至100 mL量瓶,用水稀释至刻度,混匀,作为供试品溶液2和3。
分别取供试品溶液1、2、3,在270 nm 波长处分别测定吸光度,结果为(0.539±0.273)%,表明与离心处理的样品相比,水系和有机系滤膜过滤的样品的吸光度基本无差异,滤膜过滤对样品溶液没有吸附作用,采用滤膜过滤不会影响溶出度的测定。
2.4.4 标准曲线 精密称取PZH 对照品约20 mg,置100 mL 量瓶中,加20 mL 甲醇溶解,用pH 4.5 乙酸盐缓冲液(含0.75% SDS)稀释至刻度,摇匀,作为标准溶液母液。分别精密量取母液1.0、2.0、3.0、4.0、5.0 mL 至100 mL 量瓶中,用p H4.5 乙酸盐缓冲液(含0.75% SDS)稀释至刻度,摇匀,分别制成约含PZH 为2、4、6、8、10 µg/mL 的标准溶液。取上述标准溶液,以pH 4.5 乙酸盐缓冲液(含0.75% SDS)为空白,在270 nm 波长处分别测定其吸光度,以吸光度为纵坐标、质量浓度为横坐标绘制标准曲线,得回归方程y=0.075x+0.005 7,r2=0.999 5,表明PZH在2.01~10.05 µg/mL 浓度范围内与吸光度线性关系良好。
2.4.5 精密度试验 取本品3片(批号:20180122),照“2.5”项下的测定方法操作,于45 min 时取溶出液,经0.45 μm 滤膜滤过,分别量取续滤液3 mL 至6 个100 mL量瓶,用溶出介质稀释至刻度,摇匀,即得供试品溶液。分别在270 nm的波长处连续测定吸光度值6次,经计算RSD为0.220%,表明本法精密度良好。
2.4.6 稳定性试验 取“2.4.5”项下的供试品溶液,分别在室温下于0、1、2、4、6、8、10 h 时,在270 nm波长处测定其吸光度值,经计算溶液吸光度的RSD 值为0.192%,表明在室温下放置10 h 溶液稳定性良好。
2.4.7 回收率试验 分别精密称取PZH 对照品约0.54 g(50%)、0.87 g(80%)、1.19 g(110%)置①、②、③号研钵中,再取“2.4.2”项下的混合空白辅料,分别精密称取空白辅料约0.5 g(约相当于5 片的辅料量)置3个研钵中,研匀。从①号研钵中精密称取细粉3份(约含PZH 10.8 mg),从②号研钵中精密称取细粉3份(约含PZH 17.3 mg),从③号研钵中精密称取细粉3 份(约含PZH 23.8 mg),将上述9 份细粉分别置100 mL量瓶中,加溶出介质适量,超声15 min,用溶出介质稀释至刻度,摇匀;取上述样品溶液,经0.45 μm 的微孔滤膜滤过,取续滤液,分别加溶出介质定量稀释至含PZH约7µg/mL的样品溶液。照紫外-可见分光光度法,在270 nm 波长处分别测定吸光度。
取PZH 对照品适量,精密称定,加甲醇适量溶解,用溶出介质定量稀释制成每1 mL 约含PZH 7 µg/mL 的对照品溶液,同法测定。计算回收率与相对标准偏差,结果见表3。可见,PZH 的平均回收率为99.56%,RSD 为1.10%,表明测定方法准确度好,所用辅料对PZH片的溶出度检测无影响。

表3 PZH回收率试验结果Table 3 Recovery results of PZH(n=3)
2.5 PZH片溶出度的测定
按照《中国药典》2020 年版第四部通则的溶出度与释放度测定法中的桨法进行测定。
2.5.1 溶出介质的考察 分别对原研PZH 片和自制PZH 片(批号:20180210)在水、0.1 mol/L 盐酸溶液、pH 6.8 磷酸盐缓冲液、pH 4.5 乙酸盐缓冲液(含0.75%SDS)4 种介质中溶出曲线进行了考察,结果见图2。可见,原研片和自研片在0.1 mol/L 盐酸溶液中溶出较快,15 min 内均基本完全溶出。原研片与自研片溶出曲线相似度过高,该介质对不同产品的区分性不强。原研片和自研片在pH 4.5 乙酸盐缓冲液(含0.75% SDS)中45 min 基本释放完全,释放速度适中。

图2 不同溶出介质中自制PZH片与原研片的溶出度曲线Figure 2 Dissolution curves of generic PZH tablets and Votrient®in different dissolution media(n=6)
2.5.2 溶出介质SDS 浓度的考察 在“2.3.2”项溶解度试验中已证明在溶出介质中加入一定量的SDS,有助于PZH 的溶出。FDA 相关资料中公开的溶出介质为含有0.75% SDS 的pH 4.5 乙酸缓冲液。为了进一步验证不同SDS 浓度对自制PZH 片溶出曲线的影响,考察原研片和自制PZH 片在不同SDS 浓度的pH 4.5 乙酸盐缓冲液的溶出曲线,结果见图3。可见,原研片与自制PZH 片在不加SDS、0.2%和0.5% SDS 浓度的pH 4.5 乙酸盐缓冲液中45 min 溶出量均在80%以下,不能保证主药的完全溶出,分析原因是主药在上述介质中的溶解度未达到漏槽条件。因此,0.75% SDS 浓度的pH 4.5 乙酸盐缓冲液中作为本品溶出介质较为适合。
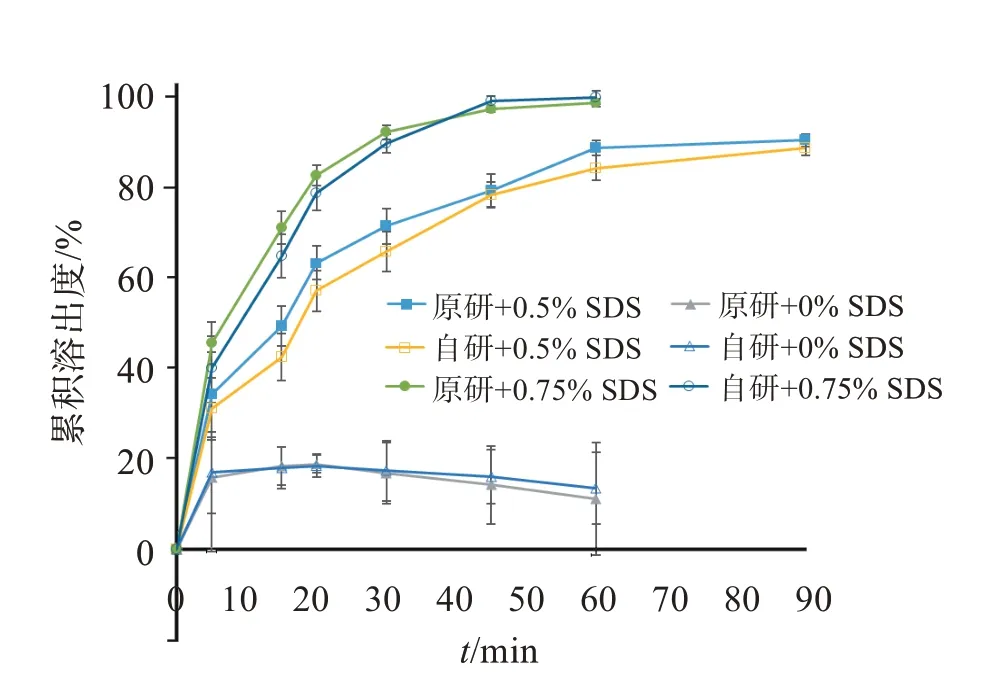
图3 自制PZH 片与原研片在不同SDS 浓度的乙酸盐缓冲液下的溶出度Figure 3 Dissolution curves of generic PZH tablets and Votrient®in acetate buffer with different SDS content(n=3)
2.5.3 转速的考察 根据《仿制药质量一致性评价普通口服固体制剂溶出曲线测定与比较指导原则(草案)》中桨法推荐的转速为50~75 r/min。因此选择50 r/min 和75 r/min 2 个转速进行比较,结果见图4。可见,原研片和自研PZH 片在50 r/min 的条件下,45 min时溶出量均低于80%,主药不能完全溶出,该转速不适宜本品溶出度的测定,因此,确定75 r/min作为溶出度测定的转速。

图4 自制PZH片与原研片在不同转速下的溶出度Figure 4 Dissolution curves of generic PZH tablets and Votrient®at different rpm(n=3)
2.5.4 3 批自制PZH 片的溶出度测定 为了考察产品溶出释放的均一性,对3 批样品的批间溶出均一性进行测定,以pH 4.5 乙酸盐缓冲液(含0.75% SDS)900 mL 为溶出介质,转速为75 r/min,依法操作,分别于5、10、15、30、45、60 min,取溶液经0.45 μm 滤膜滤过,取续滤液3 mL 置100 mL 量瓶中,用溶出介质稀释并定容,摇匀,即得供试品溶液;照紫外-可见分光光度法,在270 nm 的波长处分别测定吸光度。
另取PZH 对照品适量,精密称定,加甲醇适量溶解,用溶出介质定量稀释制成每1 mL 约含PZH 7 µg/mL 的对照品溶液,同法测定,计算每片的溶出量。限度为标示量的80%,应符合规定。结果见图5。结果显示3批样品重现性好。

图5 3批自制PZH片与原研片的溶出度测定Figure 5 Dissolution curves of generic PZH tablets and Votrient®(n=6)
2.6 自制PZH片与原研片溶出曲线相似性比较
根据图5自制PZH片和原研片的溶出度数据进行分析,自制PZH片与原研片(Votrient)的体外溶出行为基本一致。按照计算相似因子(f2)方法,溶出达到85%以上的时间点只能选取1个,且时间点不少于3 个,所以,选择5、10、15、45 min 这4 个时间点进行f2值的计算:

式中:T和R分别为仿制药和原研药的各取样点的平均溶出度,n为取样点个数。当f2因子数值介于50~100 时,认为两条曲线相似[12]。结果显示:自制PZH 片与原研片(Votrient)在溶出介质中溶出曲线的f2值为68,相似因子大于50,表明自制PZH 片与原研片溶出曲线具有相似性。
3 讨论
在体外溶出度考察中,原研片和自研PZH 片在水中的溶出度,在15~30 min 取样检测点达到最高值(60%左右),后续取样点的溶出度开始降低。分析原因为PZH 在水中溶解度较小(几乎不溶),未达到漏槽条件,导致PZH 不能完全溶出;后续取样点样品检测的溶出度降低,可能是样品达到过饱和浓度后,PZH 开始析出,导致溶出液中药物浓度降低。原研片和自研片在pH 6.8 磷酸盐缓冲液溶出量在3%以下,后续取样点的溶出度开始降低,与在水介质的原因基本一致。因为PZH 在pH 6.8 磷酸盐缓冲液的溶解度小于水中的溶解度,所以溶出量更少。
原研制剂和自研PZH 片在0.1 mol/L 盐酸溶液中溶出较快,15 min内均基本完全溶出,所以导致原研片与自研片溶出曲线相似度过高,该介质对不同产品的区分性不强。原研片和自研片在pH 4.5乙酸盐缓冲液(含0.75% SDS)中45 min 基本释放完全,释放速度适中。因此,作为本品溶出介质,PZH 能完全溶出,且释放速度适中,区分性较强。
综上所述,本研究根据原研片处方制备了PZH片,并建立了制剂中PZH 的体外溶出度的紫外分光光度法,所建立的方法简便、准确,适合PZH 片的体外溶出度测定。同时,比较了原研片和自制PZH 片在不同溶出介质中的溶出行为,得出最适合的溶出介质为pH 4.5 乙酸盐缓冲液(含0.75% SDS)。最后,比较了自制PZH 片与原研片的溶出度,显示二者溶出具有相似性。本研究对自制PZH 片体外溶出度行为的考察,为PZH 的进一步开发提供了基础性数据。
