超微血流成像与CDFI在慢性肾脏病肾血流灌注中的应用*
2023-02-20胡晓莉明志强顾鹏屈茜萍郭亮吕秋月
胡晓莉 明志强 顾鹏 屈茜萍 郭亮 吕秋月
(1.自贡市第一人民医院超声科,四川 自贡 643000;2.自贡市第一人民医院放射科,四川 自页 643000;3.川北医学院附属医院超声科,四川 南充 637000;4.自贡市第一人民医院肾病内科,四川 自贡 643000)
慢性肾脏病(Chronic kidney disease,CKD)是临床常见病,且该疾病的发病比例逐年升高,目前已成为全球公共卫生健康问题[1]。据统计,2017年全球CKD患者超过6亿,而我国CKD患病率高达18.96%,患病人数已超过1亿[2]。由于CKD起病隐匿,在早期往往无明显症状,随着病情进展,肾脏各级肾血管逐级受累而导致肾血流灌注逐渐降低,最终发展为不可逆的慢性肾功能衰竭甚至终末期肾病,导致人们的生活质量严重下降,甚至威胁到人们的生命安全。为有效延缓CKD肾功能损害进程,降低终末期肾病的发生率及疾病死亡率,临床需尽早对CKD各期进行诊断并及时治疗。研究[3]表明,肾脏的血流灌注改变与肾功能的损害具有一定的相关性,因此,准确评价肾脏血流灌注改变可以作为评估CKD患者肾功能损害程度的参考依据。超微血流成像(Super microvascular imaging,SMI)是近年来兴起的可较灵敏地检测出微细血流的新技术。其采用独特的自适应算法以及新的杂波抑制技术,可高帧频、高分辨率地探测出常规超声无法探测到的微细血管及低速血流[4-5]。近年来,SMI以其独特的优势在临床上得到广泛应用,且在乳腺、甲状腺、颈动脉粥样斑块及肿瘤等方面的应用研究较多[6-9],但应用于肾脏疾病的研究相对较少。本研究以临床不同阶段的CKD患者作为研究对象,运用彩色多普勒超声(CDFI)和SMI检测各期CKD患者肾血流灌注情况,探讨SMI诊断慢性肾脏病的临床价值。
1 资料与方法
1.1 一般资料 收集2020年3月~2021年1月于自贡市第一人民医院临床确诊为慢性肾脏病患者73例为病例组,并收集同期于我院体检肾脏正常者34例为对照组。病例组共选取73例146个肾脏,年龄17~84岁,平均(52.63 ±14.37)岁。其中男41例82个肾脏,平均年龄(52.90±15.01)岁,女32例64个肾脏,平均年龄(52.28±13.73)岁。以美国肾脏病基金会制定的K/DOQI指南为CKD分期标准[10],将CKD患者分成CKD1期组(12例)、CKD2期组(14例)、CKD3期组(17例)、CKD4期组(14例)、CKD5期组(16例)共5组。对照组:共选取34例68个肾脏,年龄17~84岁,平均(52.82±16.87)岁。其中男17例34个肾脏,平均年龄(54.59±18.16)岁,女17例34个肾脏,平均年龄(53.31±13.23)岁。对照组中所有受检者肾脏影像学检查无异常,肾功能各项指标均正常,且无各种肾脏疾病病史及可能影响肾功能的其他疾病史。病例组中所有受检者均应排除以下情况:①肾良恶性肿瘤、多囊肾疾病史。②急性肾损伤患者。③配合度差、气体干扰明显的患者。本研究经我院医学伦理委员会批准,受检者均知情同意。
1.2 CKD分期标准 参照美国肾脏病基金会制定的K/DOQI指南[10],以肾小球滤过率估算值(eGFR)作为CKD分期标准将其分成1~5期:CKD1期:≥90 mL·min-1·1.73 m-2;CKD2期:60~89 mL·min-1·1.73 m-2;CKD3期:30~59 mL·min-1·1.73 m-2;CKD4期:15~29mL·min-1·1.73 m-2;CKD5期:<15 mL·min-1·1.73 m-2或透析。
1.3 仪器与方法
1.3.1 检查仪器 使用佳能 Aplio i800彩色多普勒超声诊断仪,选用凸阵探头,探头频率为1~8 MHz,配备SMI和CDFI技术软件。
1.3.2 检查方法 取仰卧位或侧卧位,嘱受检者屏气,在二维灰阶模式下,先于一侧获取最清晰的肾脏长轴图像后,先后启动CDFI及SMI模式,分别观察CDFI及SMI模式下肾脏从肾主动脉至小叶间动脉的血流分布及各血管充盈情况,获得满意图像后进行CDFI及SMI肾血流分级并记录。再检查对侧肾脏。血流参数设置:CDFI速度标尺为12~20 cm/s,彩色增益范围为35~45 dB;SMI速度标尺为 1.2~2.0 cm/s,彩色增益范围为30~40 dB。依照受检对象体型差异对其滤波和深度进行适当的调节,图像清晰满意以显示各级血管且无血流外溢为准。
1.4 图像分析 SMI以及CDFI肾血流灌注分级指标:结合肾脏血流分布相关特征[11],将肾脏SMI和CDFI血流灌注情况分为六个级别,0 级:整个肾脏无血流显示;1级:仅肾主动脉内血流稀疏显示;2 级:肾主动脉血流清晰显示,肾段动脉血流不连续呈星点状显示,实质内无血流显示;3级:肾主动脉、肾段动脉血流连续显示,叶间动脉血流不连续呈星点状显示,弓形动脉及包膜下小叶间动脉无血流显示;4级:肾主动脉、肾段动脉、叶间动脉血流清晰显示,弓形动脉不连续呈短线状显示,包膜下小叶间动脉不显示或稀疏显示;5级:整个肾脏从肾主动脉至小叶间动脉血流连续显示呈树枝状分布,且血流信号充盈、饱满。根据该评级标准,由两位具有丰富经验的超声医师对所有图像进行分析,并对CDFI及SMI图像进行分级、记录,如意见不统一,则由第3位具有10年以上工作经验的高年资医师参与分析、讨论,3人共同商讨得出最终结果。
1.5 统计学分析 采用SPSS 25.0软件数据包分析,计数资料以频数或构成比表示,行卡方检验。多组间的等级资料两两比较行Kruskal-Wallis秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组CDFI和SMI检测肾脏血流灌注的组内比较 在214个肾脏中,SMI显示为4~5级157个(73.4%),显示为0~3级57个(26.6%);CDFI显示为4~5级118个(55.1%),显示为0~3级96个(44.9%)。同一组别CDFI与SMI肾血流灌注分级构成比进行比较,各组差异均有统计学意义(P<0.05),且对照组、CKD1期组~CKD3期组SMI显示4~5级的构成比均高于CDFI(P<0.05);CKD4期组、CKD5期组SMI显示3~4级的构成比均高于CDFI(P<0.05)。结果显示各组CDFI与SMI肾血流灌注分级随CKD分期的增高呈下降趋势,且SMI检测出细微血管及低速血流的能力高于CDFI,SMI尤其对弓形动脉和小叶间动脉的显示更清晰。见表1。
2.2 对照组与病例组各组CDFI检测肾脏血流灌注分级的组间两两比较 对照组与CKD1期组、CKD2期组,CKD1期组与CKD2期组、CKD3期组,CKD2期组和CKD3期组,CKD3期组和CKD4期组,CKD4期组和CKD5期组比较,差异均无统计学意义(P>0.05),余组间两两进行对比,差异均有统计学意义(P<0.05)。结果提示,CDFI肾血流灌注显像中,CDFI能在CKD4期检测出肾血流灌注的改变,CKD分期越高,CDFI检测出肾血流灌注越低。见表1。
2.3 对照组与病例组各组SMI检测肾脏血流灌注分级的组间两两比较 对照组与CKD1期组、CKD2期组,CKD1期组与CKD2期组,CKD3期组与CKD4期组比较,差异均无统计学意义(P>0.05)。余组两两对比,差异均有统计学意义(P<0.05)。结果提示,SMI肾血流灌注显像中,SMI能在CKD3期检测出肾血流灌注的改变,且能够区分CKD4期与CKD5期血流灌注的变化,CKD分期越高,SMI检测出肾血流灌注越低。见表1、图1。
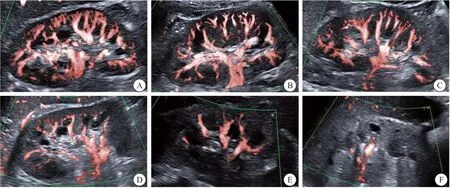
图1 正常肾脏与CKD1~5期患者 SMI肾血流灌注图Figure 1 SMI renal blood perfusion map of normal kidney and CKD 1~5 patients注:A.正常肾脏 :整个肾脏血流分布呈树枝状,可连续充盈至小叶间动脉,包膜下可见毛细血管网,血流分级5级;B.CKD 1 期患者:血流从肾主动脉连续充盈至小叶间动脉,血流分级5级;C.CKD2 期患者:血流连续充盈,且大部分延续至小叶间动脉,血流分级5级;D.CKD3 期患者:肾主动脉、肾段动脉血流连续,且与大部分叶间动脉连续,弓形动脉部分显示,血流分级4级;E.CKD4 期患者:肾主动脉、肾段动脉及叶间动脉连续性欠佳,叶间动脉稀疏显示,血流分级3级;F.CKD5 期患者:肾主动脉与肾段动脉断续显示,实质内无血流信号,血流分级2级
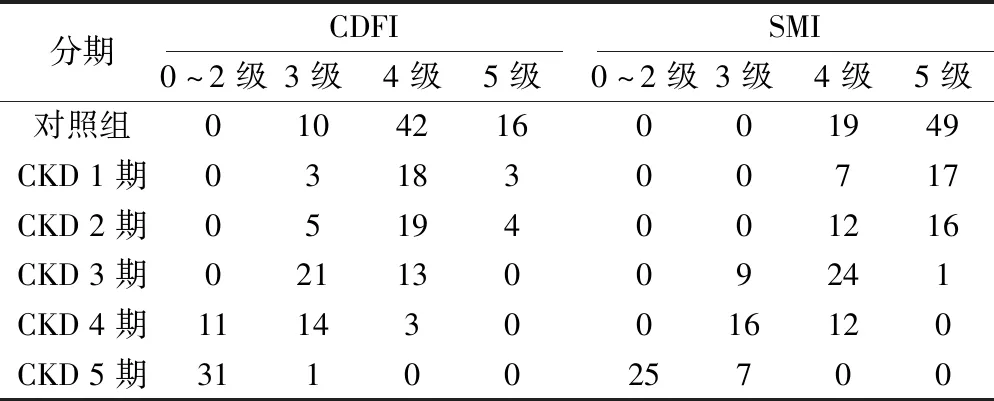
表1 对照组及CKD各分期患者CDFI和SMI肾血流灌注分级情况(个)Table 1 Grading of CDFI and SMI renal blood perfusion in control group and CKD patients
3 讨论
肾脏作为人体的富血供器官,其血流灌注维持着肾功能状态。研究[12-13]表明,CKD慢性进展的主要病理改变是肾小球硬化、肾小管萎缩以及肾间质纤维化,可引起肾内各级动脉血管由小到大逐级受损,导致血管狭窄、闭塞,血流缓慢而形成微血栓、微血瘤,血流阻力增加,致使肾脏的血流灌注逐级降低,最终肾功能完全丧失。因此临床对于CKD患者需要早期诊断、早期治疗,尽早干预,延缓疾病进展,以降低终末期肾病的发生率,减少血液透析,提高患者生活质量。临床上目前以肾穿刺活检作为评估CKD肾功能受损的金标准,但因其有创、操作复杂,重复性差,不适合病情的动态监测[14]。而超声造影对于无症状患者的使用也因其为有创操作而受限。因此临床需要寻求一种无创、操作简便、随访性强的方法对CKD患者进行动态监测。
根据K/DOQI指南对 CKD各期的治疗计划中提示[15],CKD早期患者肾脏轻度受损,经有效治疗后有逆转的可能,而病情发展到中晚期时,大部分患者肾脏受损已不可逆转,其中,CKD3期是慢性肾脏病损伤是否可逆发展的转折点[16],此时患者可出现明显的并发症,CKD病情进展加速,同时心血管疾病的发生和死亡的风险增加,影响患者的生存质量,因此有效区分并尽早诊断CKD各期对于指导临床治疗及改善其预后具有重要意义。
超声血流检查技术因其能够无创、直观、可视化地检测肾血流灌注,且操作便捷、重复性好,一直以来受临床青睐。既往研究[17]证实CDFI可以通过评价肾脏的血流灌注情况来反映肾功能情况,然而由于CDFI对于微小血管和低速血流敏感性低,不能检测出内径<0.2 mm的血管,也无法检测出流速<1cm/s的血流信号[18]。同时CDFI定向分辨率较低,易出现血管外溢,其对于评价慢性肾脏损害血流灌注改变的能力有限[19-20]。而SMI是近年来兴起的具有高灵敏度、高分辨率的新型彩色血流成像技术,其捕捉微细血管和低速血流较常规超声更加敏感,该技术无需造影剂便可检测到内径>0.1 mm及流速低至0.8 cm/s的血管,同时还具备无创、运动伪像少等优点[21-22]。在本研究中发现,214个肾脏中,SMI显示4~5级157个(73.4%),而CDFI显示4~5级118个(55.1%);同一组别CDFI与SMI血流灌注分级构成比进行比较,各组差异均有统计学意义,且对照组、CKD1期~CKD3期组SMI显示4~5的构成比均高于CDFI;CKD4期组、CKD5期组SMI显示3~4级的构成比均高于CDFI。说明相对于传统CDFI,SMI对微细、低速的血流信号检出能力更强,尤其是显示肾实质内的弓形动脉及小叶间动脉更具优势,因此,SMI能为临床提供更丰富的影像信息,有助于临床更精确的评估肾功能受损程度进而更准确的诊断疾病。
在本研究中,对照组与病例各组CDFI及SMI肾血流灌注分级随着分期增加呈下降趋势,提示两种显像技术所显示的肾血流灌注均与CKD患者病情进展有一定的相关性,对于诊断CKD及提示病情严重程度均有一定的临床价值,但经组间两两比较发现,在CDFI显像及SMI显像中,对照组与CKD1期组、CKD2期组比较均无统计学差异,表示二者均未能反映出CKD早期血流灌注的改变,尚不能对CKD早期的诊断提供参考意见。进一步研究发现,在CDFI显像中,CKD4期组、CKD 5期组与CKD1期组、CKD2期组比较差异均有统计学意义,但CKD3期组与CKD1期组、CKD2期组比较以及CKD4期组与CKD 5期组比较,均无统计学差异;而在SMI显像中,CKD3期组、CKD4期组、CKD 5期组与CKD1期组、CKD2期组比较以及CKD4期组与CKD 5期组比较,差异均有统计学意义。说明SMI较CDFI能更早反映CKD患者肾血流灌注的改变,同时能够反映晚期肾血流灌注的改变。表明SMI可以更早提示CKD患者肾功能的改变,在区分CKD早中期、晚期的应用价值高于CDFI,可为临床尽早诊断CKD并及时治疗提供重要参考依据。
本研究中,CDFI及SMI肾血流灌注显像中,CKD1期组、CKD2期组与对照组血流分级比较无差异,这与潘志平[23]的研究结果较为一致,原因可能是CKD1期、CKD2期为肾脏受损初期,残余肾单位可利用其储备功能及代偿功能来进行自身调节,使得肾皮质区血流灌注能够维持充盈状态,导致皮质区血流灌注改变不明显。此阶段临床主要为积极预防及评估病情,肾脏功能有恢复的可能性。同时本研究还显示CKD3期组、CKD4期组血流分级比较无差异,可能是CKD4期患者的肾小球纤维化处于CKD3期、CKD4期的病理改变的过渡阶段,其代偿功能尚未完全丧失,萎缩肾单位血供尚未完全减少,使得肾脏代偿功能与失代偿功能存在交叉,后期将加大样本量进一步研究。
本研究样本量少,结果可能存偏移;SMI技术操作依赖性强,且易受医生主观经验影响,可能会影响血流的准确判断;本课题未对不同病理类型的CKD患者肾血流灌注进行分析,需要进一步研究其存在区别与否。不同年龄、性别、体型以及不同患病年限的CKD患者肾脏血流灌注未在本研究中探讨,有待进一步研究。
4 结论
超微血流成像技术在评价慢性肾脏病肾血流灌注中具有较高应用价值,其显示微细血流的能力优于CDFI,能够在疾病更早诊断、病情监测、指导治疗以及评价疗效等方面为临床提供重要的参考信息,可以作为评价CKD肾血流灌注改变的重要影像方法。
