卡瑞利珠单抗联合放化疗对复发或转移性宫颈癌疗效及安全性研究*
2023-02-20刘超霞王子毅冉晓敏张克强
刘超霞,王子毅,周 萍,冉晓敏,张克强
(中南大学湘雅医学院附属湖南省肿瘤医院妇瘤科,长沙 410013)
宫颈癌是世界范围内女性最常见的第四大肿瘤,其中85%的病例发生在发展中国家,是女性肿瘤致死的首要原因[1]。早期宫颈癌主要以手术治疗为主,术后复发率11%~22%[2],其中30%~50%[3]的复发限于盆腔区域即阴道残端或盆腔。宫颈癌治疗后出现远处转移,以腹主动脉旁淋巴结转移最常见[4]。对于宫颈癌术后盆腔复发患者,根据复发病灶位置及前次术后补充放疗情况决定,其治疗方式包括再次手术,如盆腔廓清术、挽救性放化疗或姑息性化疗。挽救性放化疗因疗效良好且副反应可耐受,在临床上广为应用[5]。对于宫颈癌术后或盆腔根治性放疗后出现腹主动脉旁淋巴结转移患者,同步放化疗是有效的挽救治疗措施[6-7]。由于周围危及器官的剂量限制,导致复发或转移病灶放疗剂量难以达到更高的致死剂量。此外,即使复发或转移后病灶达到完全缓解的患者,仍有部分患者出现进展[5]。程序性细胞死亡受体(programmed cell death receptor-1,PD-1/PD-L1)抑制剂是近年应用较多的免疫检查点抑制剂,其可靶向阻断PD-L1/PD-1信号通路从而大大增强肿瘤患者的抗肿瘤应答。基础研究表明,放射治疗对肿瘤及肿瘤微环境的免疫原性作用。放疗可引起树突状细胞的迁移,肿瘤抗原的交叉渗透,从而导致T细胞的活化和增殖。此外,放疗也增加了肿瘤内肿瘤浸润淋巴细胞的密度[8]。许多研究数据表明,放疗与免疫治疗之间有协同作用[9,10]。本研究旨在研究术后盆腔复发性宫颈癌或(和)腹主动脉旁淋巴结转移宫颈癌患者中,国产PD-1抑制剂卡瑞利珠单抗(Camrelizumab,艾瑞卡)联合同步放化疗的疗效及安全性。
1 资料与方法
1.1 一般资料 选取2020年1月至2022年2月湖南省肿瘤医院收治的复发或转移性宫颈癌接受挽救性放化疗患者。纳入标准:(1)组织学确诊的宫颈鳞癌,腺癌或腺鳞癌;(2)无放疗史的宫颈癌术后盆腔复发±腹主动脉旁淋巴结转移;(3)盆腔放疗后腹主动脉旁淋巴结转移;(4)无远处转移病灶;(5)按RECIST 1.1标准,受试者必须有至少一个通过CT或MRI检查的盆壁可测量的靶病灶(最长径≥10mm的病灶,或短径≥15mm的淋巴结。排除标准:(1)宫颈神经内分泌癌;(2)单纯性阴道复发宫颈癌;(3)盆腹腔弥漫性转移病灶。根据患者意向性治疗方式分为两组:卡瑞利珠单抗联合放化疗组(治疗组),放化疗组(观察组)。收集患者的信息,包括临床病理特征、年龄、初始治疗方式、复发或转移与前次间隔时间、转移部位、复发或转移后治疗方案,程序性死亡配体1(programmed death-ligand1,PD-L1)表达。本研究经湖南省肿瘤医院伦理委员会审查并批准,应用卡瑞利珠单抗患者均签署超适应证知情同意书。
1.2 方法
1.2.1 治疗 主要采用体外放疗±后装放疗。体外放疗采用三维调强放疗方法,用热塑膜将患者固定,增强CT连续扫描定位,以5mm层厚扫描,导入TPS计划系统,勾画靶区大体肿瘤体积(gross tumor volume,GTV)、临床靶区体积(clinical target volume,CTV)、计划靶区体积及危及器官。选择7个野调强放疗技术或VMAT技术,6MV-X线常规分割,1.8~2.0Gy/次,1次/d,每周5次,全盆腔放疗的计划临床靶区剂量45~50.4Gy,肿瘤靶区在CTV基础上局部推量10~15Gy。盆腔转移病灶或腹膜后转移淋巴结达58~60Gy。体外放疗结束后,针对阴道内有病灶的患者进行后装放疗,6Gy/次,每周1~2次,共2~4次,总量12~24Gy。
治疗组:放疗期间同步顺铂30~40mg/m2周疗,并在放疗开始时给予卡瑞利珠单抗200mg静滴同步治疗并在后续继续每3周维持。观察组:同步放化疗。两组均有部分患者在同步化疗结束前后,共接受2~4个疗程的巩固化疗,紫杉醇(每疗程的第1d使用,135~175mg/m2)联合顺铂50mg/m2静滴化疗,每3周1个疗程。
1.2.2 疗效和不良反应评估 按实体瘤疗效评价标准(response evaluation criteriain solid tumors,RECIST)1.1版进行疗效评估,放疗结束后3个月进行第一次疗效评估,之后每3个月进行评估。完善血液学及影像学检查。疗效分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stabledisease,SD)和疾病进展(progressive disease,PD)。客观缓解率(objective response rate,ORR):CR+PR所占比例。不良事件根据通用毒性标准(Common Terminology Criteria Adverse Events,CTCAE)5.0版进行判定。无进展生存期(progression-free survival,PFS)定义为复发治疗开始至疾病进展或死亡的时间。未进展者按截尾值处理,截尾时间为确认其未进展的末次随访时间。采用查阅病例、电话和复诊方式进行随访,末次随访时间截至2022年6月30日。
1.2.3 免疫组化法检测 免疫组化法检测肿瘤组织中PD-L1表达水平,使用22C3phar-mDx的PD-L1抗体(购自美国Dako公司)。PD-L1判断方法以综合阳性评分(Combined Positive Score,CPS)≥1判定为阳性,CPS=(PD-L1膜染色阳性肿瘤细胞+PD-L1膜染色阳性肿瘤相关免疫细胞(淋巴细胞、巨噬细胞))/总肿瘤细胞数×100。
1.3 统计学处理 采用SPSS23.0软件。χ2检验或Fisher检验用于分析患者各变量与疗效的关系。采用Kaplan-Meier检验估计中位PFS及OS,Log-rank检验进行组间比较。P<0.05为差异有统计学意义。
2 结 果
2.1 患者临床病理特征 治疗组及观察组各有20例患者,治疗组接受同步放化疗加卡瑞利珠单抗免疫治疗,观察组接受放化疗。两组部分患者在放化疗后接受了紫杉醇+顺铂的3周联合化疗。临床病理情况见表1。

表1 两组复发或转移性宫颈癌临床病理特征
2.2 疗效
2.2.1 近期疗效 治疗组中,卡瑞利珠单抗使用疗程5~34次,中位疗程数15个。1例腹主动脉旁淋巴结转移患者使用5次后因经济原因停用,其余患者继续使用。见图1。治疗组中CR和PR分别为13例(65%)和7例(35%),无SD及PD患者;观察组CR和PR分别为6例(30%)和10例(50%),SD 3例(15%),PD 1例(5%)。两组的CR率比较差异有统计学意义(P<0.05)。两组的ORR比较,差异无统计学差异[100%(20/20) vs 80%(16/20),P>0.05],见表2。治疗组患者根据PD-L1检测结果分为PD-L1(+)及非PD-L1(+)(包括阴性及未检测患者),两组CR及PR情况,见表3。

图1 典型病例

表2 两组复发或转移性宫颈癌患者近期疗效[n(%)]
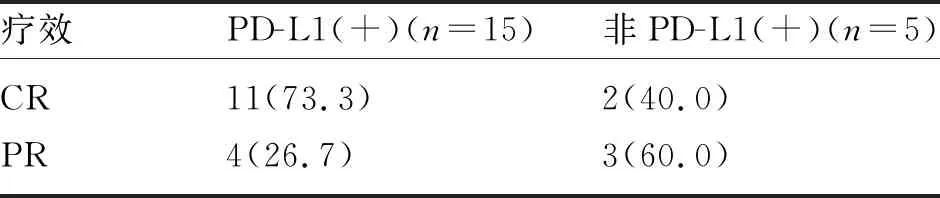
表3 治疗组PD-L1(+)及非PD-L1(+)组患者近期疗效比较[n(%)]
2.2.2 远期疗效 随访截至2022年6月30日。中位随访时间12月(4~28月)。治疗组中1例腹主动脉旁淋巴结转移患者放疗后半年出现肺转移,中位PFS未达到,2年预估无进展生存率为93.8%。观察组中,失访1例,19例随访患者中6例出现进展。4例出现照射野外转移,其中3例肺转移,1例腹主动脉旁淋巴结转移;2例为放疗野内再次复发。中位PFS为15月,2年预估无进展生存率为41.7%。两组PFS有统计学意义(P=0.034),见图2。治疗组内PD-L(+)患者与非PD-L1(+)患者的PFS比较,差异无统计学意义(P=0.138)。
治疗组未出现死亡。观察组中5例患者死亡,其中3例再次复发后未进行进一步治疗,3~4个月后死亡;1例再次复发后接受了白蛋白紫杉醇+顺铂±贝伐单抗化疗4疗程,再复发后13个月死亡,1例患者再次复发后接受了白蛋白紫杉醇+顺铂±卡瑞利珠单抗化疗3疗程后拒绝进一步治疗,15个月后死亡。两组患者的OS比较,治疗组尚未出现死亡事件,观察组预计中位OS为23个月。两组的生存曲线比较,差异无统计意义(P=0.099)。见图2。

图2 KM生存曲线
2.3 治疗副反应 治疗组中,16例出现反应性毛细血管增生症,多为1~2级,未给予停药处理;2例血小板下降≥3级,对症处理后好转;3例出现1级转氨酶升高,口服护肝药物好转;5例甲状腺功能异常,其中4例甲状腺功能减退,给予优甲乐口服,1例无症状甲亢。两组的白细胞下降、血小板下降发生率比较,差异无统计学意义(P>0.05)。两组均未出现治疗相关死亡事件,未发生心肌炎、肠漏、膀胱漏。见表4。

表4 两组患者的不良反应(n)
3 讨 论
宫颈癌复发部位主要位于盆腔,以单纯盆腔复发最常见,占比超过50%;而盆腔并远处转移约30%;单纯远处转移不足20%[5],远处转移最多见的则为孤立性腹主动脉旁淋巴结转移[11]。对于盆腔或腹膜后孤立性转移病灶可通过挽救性放化疗治疗。盆腔复发性病灶分为中央型和非中央型,中央型复发病灶患者预后较好,周围型尤其是盆壁受侵犯患者预后较差。目前盆壁受侵犯的复发性宫颈癌患者经挽救性放化疗的完全缓解率为25%~50%[7,12-14],无进展生存率25%~41%,5年总生存率25%~44%[7,12]。腹膜后孤立性淋巴结转移患者局部淋巴结较大或为多发时,5年生存率约为30%~48%[11,15],极易出现远处转移。
Keynote-826研究显示,紫杉醇加铂类化疗±贝伐珠单抗联合PD-1抑制剂Pembrolizumab明显改善PD-L1表达阳性复发宫颈癌患者的无进展生存率和总生存率[16]。研究表明,放射治疗还可诱导免疫调节作用,改变肿瘤微环境,上调炎性级联反应,并具有增强远隔效应的作用[8]。GY017研究结果显示,Atezolizumab联合同步放化疗无论是在放化疗前还是放化疗同步使用均导致T细胞克隆扩增,且治疗安全有效[17]。卡瑞利珠单抗(Camrelizumab,艾瑞卡)是国内自主研发的一款PD-1抑制剂,Huang等[18]于2019年1月启动了卡瑞利珠单抗联合阿帕替尼治疗晚期/复发宫颈癌多中心Ⅱ期临床研究,结果显示,对于转移性、复发性或持续性宫颈癌患者,客观缓解率为55.6%,中位无进展生存期为8.8个月,较单纯化疗效果较好。本研究就区域复发性宫颈癌在同步放化疗基础上联合使用国产PD-1抑制剂卡瑞利珠单抗治疗,结果显示,治疗组的完全缓解率较对照组明显上升,高于同类型的研究结果,提示PD-1抑制剂可能增加放化疗疗效。Yan等[7]研究认为,对于非单纯阴道复发宫颈癌,中位PFS为16.13~25.5月,中位总生存时间(overall survival,OS)为25.69~30.9月。本研究中治疗组挽救性放疗后辅助全身化疗较对照组少,但其无进展生存率明显好于对照组,治疗组20例中仅1例出现了肺转移,对照组在放化疗后给予了多疗程的联合化疗,仍有6例出现进展,且进展主要表现为照射野外的转移。提示PD-1抑制剂可能减少了远处转移的风险。值得注意的是,观察组6例进展患者中,直接放弃治疗的3例患者在再次进展后3~4个月均死亡,而再次进展后给予姑息性化疗患者则延长至14~15月。治疗组较对照组,OS明显延长,但差异无统计学意义,考虑为样本量较小且随访时间不够。
将治疗组内患者分为PD-L1阳性组和非PD-L1阳性组(阴性或不明者),发现无进展生存率无明显统计学意义。这可能是因放疗本身可促进免疫炎性因子的释放,从而提高免疫治疗的疗效,但也不排除是因未检测患者中有PD-L1阳性者。图1中患者因切片超过2年未进行PD-L1检测,但其治疗疗效非常满意,腹主动脉旁3.5cm淋巴结、盆壁短径达5.5cm淋巴结并侵犯肌肉均达到CR。
本研究中挽救性放化疗联合卡瑞丽珠的治疗安全性方面,多为1~2级治疗副反应,3级不良副反应发生率为30%(6/20),其中5例为白细胞或血小板下降,1例为3级皮肤反应性皮肤毛细血管内皮增生症(reactive cutaneous capillary endothelial proliferation,RCCEP),经对症处理后好转,未影响卡瑞利珠单抗的继续治疗。两组患者均未出现死亡相关不良事件。血液学毒性方面,挽救性放化疗联合卡瑞利珠单抗组出现了2例≥3级以上血小板下降,但与对照组相比无明显差别,提示挽救性放化疗联合免疫治疗安全。这与GY017的研究结果显示Atezolizumab联合同步放化疗结果类似[17]。此外,对于卡瑞利珠单抗的特异性副反应:RCCEP发生率为80%(16/20),且绝大部分为1~2级副反应,1例3级患者经对症处理后好转继续治疗,与文献相关报道类似。在卡瑞利珠单抗单药治疗食管癌和鼻咽癌的一期临床实验中,RCCEP发生率分别为76.7%(23/30)[19]和88%(82/93)[20]。卡瑞利珠单抗治疗晚期肝癌的多中心数据显示,RCCEP发生率为66.8%(145/217),多为1~2级反应。未出现因该副反应的停药事件。经分析发现RCCEP发生与较高的客观反应率,较长的PFS及OS显著相关[21]。
综上所述,挽救性放化疗联合卡瑞利珠单抗治疗区域复发性宫颈癌显示出较好的疗效,特别是对放疗后降低远处转移的发生率显示了较好的作用,不良反应可耐受。挽救性放化疗联合PD-1抑制剂作为区域复发性宫颈癌新的治疗模式有进一步研究探索的价值。本中心已开始针对卡瑞利珠单抗联合挽救性放化疗治疗区域性复发宫颈癌进行二期研究,期待相关数据。本研究样本量较小且观察时间有限,期待有更多的大样本、多中心研究结果进一步证实其疗效及安全性,从而为区域复发性宫颈癌治疗提供新选择。
