NOL8对口腔鳞状细胞癌细胞增殖、迁移及侵袭的影响
2023-02-19王笑笑李敏敏孙冬瑗蒋英英
王笑笑,陈 曦,李敏敏,宋 宁,孙冬瑗,蒋英英,
1.潍坊医学院口腔医学院,山东 潍坊 261053;2.潍坊医学院附属医院口腔科,山东 潍坊 261035
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部常见的鳞状细胞癌,其病因包括吸烟、饮酒及人乳头状瘤病毒(human papilloma virus,HPV)感染等[1-2]。对于早期OSCC患者,手术和放疗是肿瘤根治的两种主要方法[3]。而对于晚期患者,由于OSCC复发率高,5年生存率仅58%[4-5]。因此,了解OSCC的分子特征,寻找有希望的治疗靶点,对早期发现OSCC、改善患者预后具有重要意义。
核仁蛋白8(nucleolar protein 8,NOL8)是一种基因编码蛋白质,与胃癌、结直肠癌、前列腺癌的发生密切相关[6-8]。作为RNA结合蛋白(RNA-binding protein,RBP),可能参与肿瘤细胞转录后水平的基因表达调控和核糖体的生物发生[9-11]。然而NOL8在OSCC中的作用及其机制目前仍不清楚。
本研究主要探究NOL8在OSCC细胞中的表达情况,观察NOL8表达水平变化后对OSCC细胞增殖、迁移、侵袭和上皮-间充质转化(epithelialmesenchymal transition,EMT)的影响,旨在为OSCC机制的研究和诊断治疗提供新的线索。
1 材料和方法
1.1 细胞培养和主要试剂
OSCC细胞系HN6和CAL-27由上海交通大学医学院附属第九人民医院赠予,正常对照细胞由口腔黏膜上皮细胞原代培养。HN6和CAL-27培养于DMEM高糖培养基,含10%胎牛血清、2%青霉素-链霉素,细胞置于37 ℃、CO2体积分数为5%、相对饱和湿度的培养箱中培养。DMEM高糖培养基、胎牛血清、青霉素-链霉素双抗溶液均购自天津市灏洋生物制品科技有限责任公司,0.25%乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)胰蛋白酶溶液购自苏州新赛美生物科技有限公司,TRIzol试剂购自武汉艾瑞科生物科技有限公司;反转录试剂盒、实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)试剂盒购自日本TaKaRa公司,Lipo8000TM转染试剂购自上海碧云天生物技术有限公司,脱脂奶粉购自广州赛国生物科技有限公司,matrigel基质胶购自美国Corning公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自日本株式会社同仁化学研究所,二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、NOL8均购自美国Thermo Fisher Scientific公司,磷酸缓冲盐溶液(phosphate-buffered saline,PBS)、含有吐温-20三乙醇胺缓冲盐溶液(tris-buffered saline with Tween-20,TBST)均购自北京索莱宝科技有限公司,Ki-67、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)及β-actin抗体均购自英国Abcam公司,波形蛋白(vimentin)、HRP Goat Anti-Rabbit IgG二抗均购自美国Cell Signaling Technology公司。
1.2 实验方法
1.2.1 数据库在线分析
应用基因表达谱交互分析2(gene expression profiling interactive analysis 2,GEPIA2)(gepia2.cancer-pku.cn)[12]、肿瘤免疫评估资源(tumor immune estimation resource,TIMER)(https://cistrome.shinyapps.io/timer/)[13]、阿拉巴马大学伯明翰分校癌症数据分析(the University of Alabama at Birmingham cancer data analysis portal,UALCAN)(http://ualcan.path.uab.edu)[14]及RNA相互作用数据库(the encyclopedia of RNA interactomes,ENCORI)(http://starbase.sysu.edu.cn)[15]在线分析NOL8在头颈部鳞癌组织中的表达情况。GEPIA2数据库使用“Expression DIY”下的“Box plot”进行检索,设置条件为:①Gene:NOL8;② Cancer:HNSC。TIMER数据库使用“Diff Exp”进行检索,设置条件为:①Gene Symbol:NOL8;② Cancer:HNSC。UALCAN数据库使用“TCGA”进行检索,设置条件为:①Gene:NOL8;② Cancer:HNSC;③Analysis:Expression。ENCORI数据库使用“Pan-Cancer”下的“Gene Differential Expression”进行检索,设置条件为:①Gene:NOL8;② Cancer:HNSC;③Chart type:Box plot;④ Data scale:log2-scale。
1.2.2 RNA提取、反转录及RTFQ-PCR实验
用TRIzol法提取细胞的总RNA,使用反转录试剂盒进行反转录。使用RTFQ-PCR试剂盒进行目的基因扩增,反应条件为:预变性(循环数1次):95 ℃ 30 s;PCR(循环数40次):95 ℃ 3 s,60 ℃ 30 s。NOL8引物正向序列为5‘-GTCAGCCCTCAGTCATGGATT-3‘,反向序列为5‘-CACACGAAGGCAGTTTTTCATC-3‘;β-actin正向序列为5‘-CATGTACGTTGCTA TCCAGGC-3‘,反向序列为5‘-CTCCTTAATGT CACGCACGAT-3‘。
1.2.3 细胞转染实验
由广州锐博生物科技有限公司设计合成NOL8小干扰RNA,分别为实验组(si-NOL8-1,si-NOL8-2)和阴性对照组,si-NOL8-1靶序列为5‘-GCAACAGGCTGCACAAAAA-3‘,si-NOL8-2靶序列为5‘-GGAGTGGATTTCCATATGA-3‘。将细胞放于6孔板中,细胞密度为60%~ 80%,24 h后应用Lipo8000TM试剂配制转染体系,混合后静置20 min,轻滴入6孔板中,放于37 ℃、CO2体积分数为5%的培养箱中培养24 h后,采用RTFQPCR进行敲低效率检测,并进行后续实验。
由汉尹生物科技(上海)有限公司设计合成NOL8慢病毒过表达载体,分为实验组(NOL8)和阴性对照组。将细胞放于6孔板中,细胞密度为20%~ 30%,24 h后每孔加入10 mg/mL聚凝胺进行NOL8过表达慢病毒转染。于37 ℃、CO2体积分数为5%的培养箱中培养72 h后更换含10 μg/ mL嘌呤霉素的培养基,筛选2~ 3次建立NOL8过表达慢病毒稳定表达的细胞株。
1.2.4 CCK-8实验
将转染的细胞计数后以1×103个细胞/孔的密度接种于96孔板中,每组3个复孔,置于37 ℃、CO2体积分数为5%的培养箱中,每天定时加入CCK-8试剂,再置于培养箱中培养2 h后,使用多功能酶标仪测定450 nm处的吸光度(D)值,连续检测5 d。
1.2.5 划痕愈合实验
将细胞接种于6孔板中,转染后待细胞密度达到100%后,行划痕操作,1×PBS冲洗后,在显微镜下于0、24及48 h观察记录划痕愈合情况。
1.2.6 Transwell实验
将matrigel基质胶均匀铺于transwell上室中,用于细胞侵袭实验。细胞转染后,用无血清DMEM高糖培养基重悬并计数,在transwell上室内接种5×104个细胞/200 μL,下室内加入600 μL含10%胎牛血清的培养基,放入37 ℃、CO2体积分数为5%的培养箱中培养24~ 48 h后,4%多聚甲醛溶液固定,0.5%结晶紫染色,擦去未侵袭的细胞,随机选取5个视野在显微镜下观察拍照。
1.2.7 蛋白质印迹法(Western blot)实验
细胞转染48 h后,PBS冲洗细胞3次,加入全细胞裂解液裂解细胞,收集裂解液后于105℃金属浴中煮10 min,使用BCA试剂盒测定蛋白浓度,根据蛋白浓度加入十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液。然后进行配胶,上样,10%SDS-PAGE转膜。5%脱脂奶粉封闭后,一抗[E-cadherin(1∶1 000)、N-cadherin(1∶1 000)、vimentin(1∶1 000)、β-actin(1∶1 000)]4 ℃温育过夜。第2天二抗室温温育1 h,最后用电化学发光(electrochemical luminescence,ECL)超敏发光液在凝胶成像系统上显影,成像后用Image J软件进行灰度值分析。
1.2.8 裸鼠皮下移植瘤模型
选用BALB/c 4周龄裸鼠构建皮下移植瘤模型。分别收集NOL8过表达及对照组CAL-27细胞2×107个/mL,于裸鼠下肢两侧背部皮下注射100 μL细胞悬液,每3~ 5 d观察移植瘤的生长。3周后结束观察并将裸鼠安乐死,取肿瘤组织拍照并称重。此外,将瘤体于4%多聚甲醛溶液中固定24 h,经脱水、石蜡包埋、切片后进行H-E染色,并使用Ki-67抗体进行免疫组织化学(immunohistochemistry,IHC)染色,在显微镜下观察并拍照。
1.3 统计学处理
使用GraphPad Prism 8.0软件对所有数据进行统计,计量资料均以表示,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 NOL8在OSCC组织及细胞系中的表达情况
TIMER、GEPIA2、ENCORI及UALCAN数据库在线分析显示,在头颈部鳞癌中,与癌旁正常组织相比,NOL8在头颈部鳞癌组织中的表达明显上调(图1A~ 1D)。RTFQ-PCR实验检测NOL8在3种细胞系中的表达情况,与正常口腔黏膜细胞相比,NOL8在OSCC细胞系HN6、CAL-27中的表达水平较高(图1E)。

图1 NOL8在OSCC组织及细胞系的表达情况Fig.1 The relative expression of NOL8 in OSCC tissues and cell lines
2.2 敲低NOL8表达对OSCC细胞增殖能力的影 响
RTFQ-PCR实验结果显示,si-NOL8-1、si-NOL8-2的相对表达量明显低于阴性对照组(图2A)。CCK-8实验检测结果显示,转染NOL8小干扰RNA后CAL-27细胞增殖能力显著降低(图2B)。
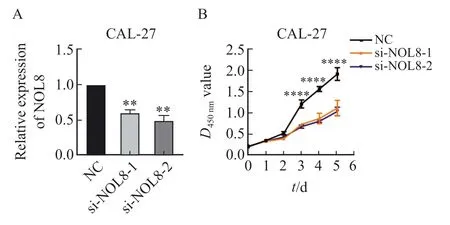
图2 敲低NOL8表达对OSCC细胞增殖能力的影响Fig.2 Effect of knocking down NOL8 expression on the cell proliferation of OSCC
2.3 敲低NOL8表达对OSCC细胞迁移及侵袭能力的影响
划痕愈合实验结果显示,48 h时si-NOL8-1、si-NOL8-2与阴性对照组细胞相比,敲低NOL8的表达可限制CAL-27细胞迁移能力(图3A)。Transwell实验结果显示,敲低NOL8表达后,CAL-27细胞的体外侵袭能力同样被抑制(图3B)。

图3 敲低NOL8表达对OSCC细胞的迁移及侵袭能力的影响Fig.3 Effect of knocking down NOL8 expression on cell migration and invasion of OSCC
2.4 过表达NOL8对OSCC细胞增殖能力的影响
RTFQ-PCR实验结果显示,在CAL-27和HN6细胞中,NOL8过表达组(NOL8)的相对表达量明显高于阴性对照组(图4A);CCK-8实验检测结果显示,过表达NOL8组的CAL-27和HN6细胞增殖能力显著高于阴性对照组(图4B)。

图4 过表达NOL8对OSCC细胞增殖能力的影响Fig.4 Effect of overexpression of NOL8 on cell proliferation of OSCC
2.5 过表达NOL8对OSCC细胞迁移及侵袭能力的影响
划痕愈合实验结果显示,24 h时CAL-27及HN6细胞中NOL8过表达组的愈合率均高于阴性对照组(图5A)。Transwell实验结果显示,在过表达NOL8后,CAL-27及HN6细胞的体外侵袭能力增强(图5B)。
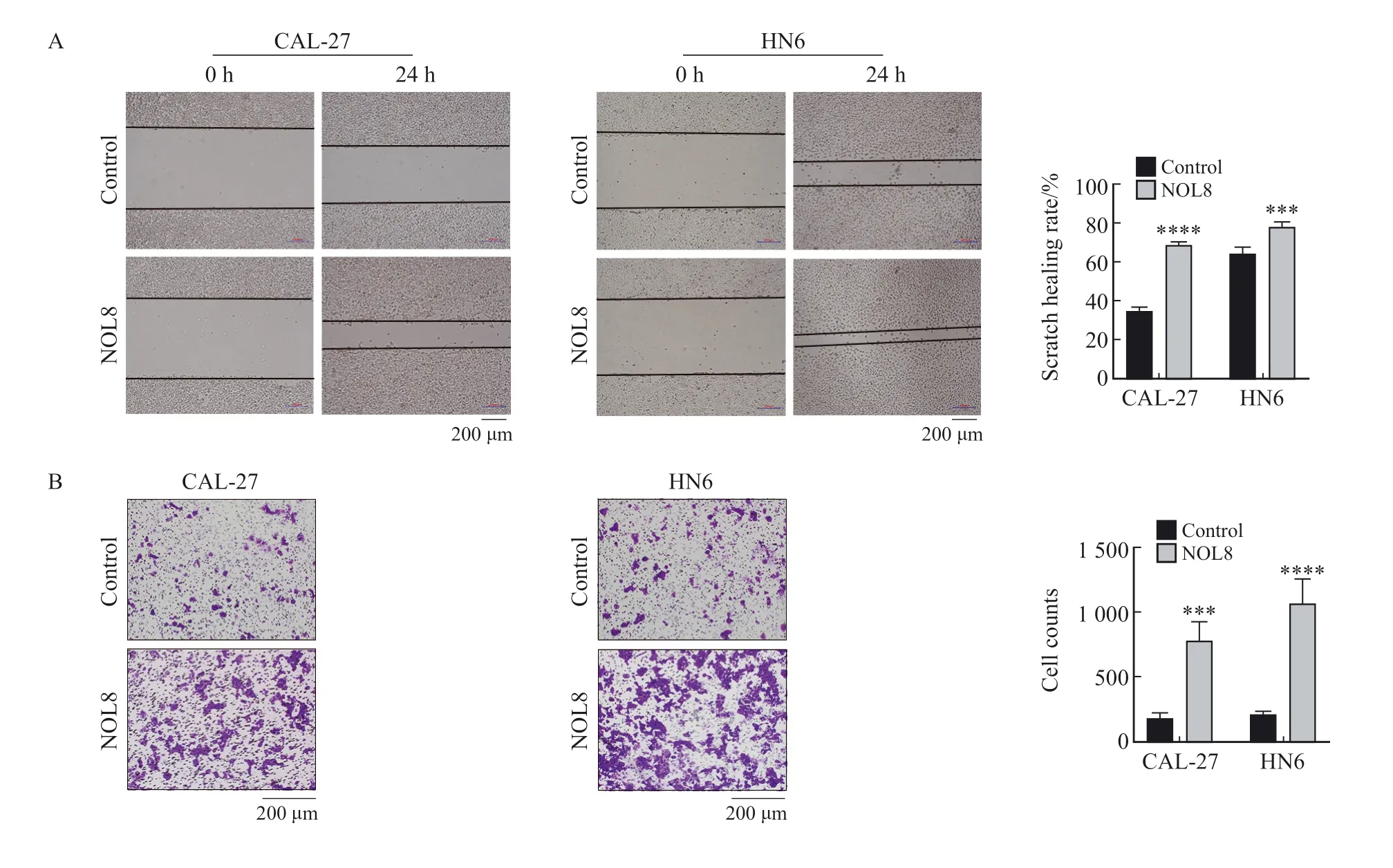
图5 过表达NOL8对OSCC细胞迁移及侵袭能力的影响Fig.5 Effect of overexpression of NOL8 on cell migration and invasion of OSCC
2.6 NOL8表达改变对OSCC细胞EMT的影响
Western blot实验结果显示,在CAL-27细胞中敲低NOL8表达后,E-cadherin蛋白的表达水平升高,而N-cadherin和vimentin蛋白的表达水平降低;在CAL-27及HN6细胞中过表达NOL8后,E-cadherin蛋白的表达水平降低,而N-cadherin和vimentin蛋白的表达水平升高(图6)。

图6 NOL8表达改变对CAL-27和HN6细胞EMT相关蛋白的影响Fig.6 Effect of the change of NOL8 expression on EMT-related proteins in CAL-27 and HN6 cells
2.7 NOL8表达改变对裸鼠皮下移植瘤生长的影 响
裸鼠皮下移植瘤模型实验结果显示,NOL8过表达的CAL-27细胞形成的皮下移植瘤瘤体体积(图7A)及瘤重(图7B)均显著大于阴性对照组。通过瘤体组织H-E和Ki-67免疫染色进一步观察瘤体组织学形态,发现NOL8过表达CAL-27细胞的移植瘤生长较阴性对照组更迅速(图7C)。

图7 NOL8表达改变对裸鼠皮下移植瘤生长的影响Fig.7 Effect of NOL8 expression on the growth of subcutaneously xenograft tumor in nude mice
3 讨论
OSCC是世界范围内常见的人类恶性肿瘤,目前采用的手术、放疗、生物免疫等联合治疗取得了显著进展,但由于肿瘤复发率高,患者5年生存率低,寻找新的OSCC预后预测标志物和治疗靶点对改善患者的诊断、治疗和预后至关重要[3,16]。
NOL8含有RNA识别基序,是一种RBP,能够在转录后水平调控基因表达,包括对mRNA前体的剪接和加工、mRNA的稳定性及其降解等过程[9,17]。既往研究表明,NOL8与多种类型癌症的生物学行为密切相关,如前列腺癌、胃癌和结直肠癌[6-8]。在前列腺癌中,NOL8高表达与前列腺癌低生存率相关,并且可以通过激活β-catenin/TCF信号通路促进EMT,进而促进前列腺癌细胞迁移和侵袭[6]。此外,NOL8与结直肠癌的临床预后也有关[7,18]。NOL8不仅通过促进细胞迁移和侵袭发挥促癌作用,还可以通过促进细胞凋亡从而发挥在弥漫性胃癌中的抑癌作用[8]。本研究通过数据库分析发现,NOL8在OSCC组织及细胞系中表达显著上调,表明其可能与肿瘤的发生、发展进程具有密切联系。通过体内外功能实验发现,NOL8高表达可以显著提高OSCC细胞增殖、迁移及侵袭能力。
OSCC转移率高,其转移往往与肿瘤迁移和侵袭有关,进一步探究OSCC转移的相关机制至关重要[16]。研究[19-20]发现,EMT在OSCC侵袭和转移中发挥关键作用,能够诱导恶性肿瘤细胞侵袭,EMT过程的癌细胞的外形及内部分子都发生了变化,其中上皮性标志物(E-cadherin)表达减少和间质标志物(N-cadherin、vimentin)表达增加能够促进肿瘤的侵袭及转移。有研究[19]发现,Wnt/β-catenin和Notch通路等可以通过诱导EMT来促进癌症转移。此外,NOL8可以调控转录后水平的基因表达,如对mRNA前体hnRNA的剪接加工和mRNA的稳定性及其降解等过程[17]。进一步研究显示,敲低NOL8可以上调E-cadherin的表达水平和下调N-cadherin、vimentin的表达水平,而过表达NOL8则结果相反,表明NOL8可促进OSCC细胞EMT的发生。初步判断NOL8可以通过诱导EMT发生进而影响OSCC细胞迁移及侵袭能力,但其参与和调控这一过程的具体机制有待进一步研究。
综上所述,NOL8在OSCC组织及细胞中表达上调,并可以促进OSCC细胞增殖、迁移和侵袭,NOL8还能够诱导OSCC细胞EMT的发生。本研究证实,NOL8作为OSCC的致癌因子,可能为OSCC的发生、发展机制研究提供新的思路,为OSCC的防治提供新的线索。
利益冲突声明:所有作者均声明不存在利益冲突。
