姜黄素固体脂质纳米粒在大鼠体内的组织分布研究 Δ
2023-02-18李旭郝迪王梓李楠天津市医药科学研究所天津300020
李旭,郝迪,王梓,李楠 (天津市医药科学研究所,天津 300020)
心肾综合征(cardiorenal syndrome,CRS)指心脏和肾脏中一个器官对另一个器官的功能损害不能进行代偿时,形成恶性循环,最终导致心脏和肾脏功能的共同损害;其发病机制复杂,心肾纤维化是其终末期的主要病理改变,目前尚无特效药物进行治疗[1―3]。姜黄素(curcumin,Cur)可减轻血管紧张素Ⅱ诱导的心肌纤维化和肾间质纤维化[4―5]。本课题组前期研究发现,Cur还可改善CRS模型大鼠的心肌肥大、肾功能以及肺组织损伤[6]。Cur的生物利用度极低(<1%)且难溶于水(溶解度为0.6 μg/mL),在生理pH下的吸收和稳定性较差,且代谢快、易消除[7―8],从而限制了其体内研究和临床应用。
固体脂质纳米粒(solid lipid nanoparticles,SLN)以脂质作为载体材料将药物包裹在其中,可避免药物与外界环境接触,增加药物的稳定性,延长药物的半衰期,从而提高药物的生物利用度[9―11]。本课题组前期采用微乳法制备了Cur-SLN[12],现采用尾静脉注射Cur-SLN的方法,观察Cur在大鼠心、肾、肺和肝组织的分布情况,以期为Cur-SLN治疗CRS的临床应用提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有LC-2010型高效液相色谱(HPLC)仪(日本Shimadzu公司),XW-80A型涡旋混合仪(上海医科大学仪器厂),HWS-24型电热恒温水浴锅(上海一恒科学仪器有限公司),XW-80A型定时恒温磁力搅拌器(上海泸西分析仪器厂),PHS-3C型精密pH计(上海精密科学仪器有限公司),SZ-100型纳米粒度仪(日本Horiba公司),AB135型十万分之一电子天平、AL204型万分之一电子分析天平、PL203型精密电子天平[梅特勒-托利多仪器(上海)有限公司]等。
1.2 主要药品与试剂
Cur对照品、大黄素对照品(内标)均购自中国食品药品检定研究院(批号分别为110823-201004、110756-200110,纯度均大于98%);Cur原料药(批号TZSW200317-1,纯度99.0%)购自西安通泽生物科技有限公司;其余试剂均为实验室常用规格,水为娃哈哈纯净水。
1.3 动物
本研究所用实验动物为SPF级SD大鼠,共90只,雄性,体质量220~240 g,由北京维通利华实验动物技术有限公司提供,动物生产许可证号为SCXK(京)2019-0006。所用动物均活动正常且毛发柔顺,摄食、饮水均正常。本研究获得天津市医药科学研究所伦理委员会批准,伦理审批号为IMPS-EAEP-Z-18JCQNJC13500-01。
2 方法与结果
2.1 Cur-SLN混悬液的制备
参考本课题组前期方法制备Cur-SLN混悬液[12]:称取处方量的Cur和硬脂酸,于65 ℃熔化,加入2 mL相同温度的聚山梨酯80-乙醇溶液(质量比1∶4)和8 mL水,涡旋1 min,即得水包油型微乳。在电磁搅拌(1 020 r/min)下,将上述热微乳以每5 s 1滴的速度滴入2 ℃的分散介质水中,当微乳全部加入后继续以2 ℃保温搅拌15 min,即得Cur-SLN混悬液(每毫升Cur-SLN中含Cur原料药约0.77 mg,载药量为7.72%,包封率为87.73%)。本研究所制Cur-SLN的理化性质良好,平均粒径为(168.9±1.0) nm,Zeta电位为-(19.60±0.35) mV,多分散系数为0.212±0.020。
2.2 生物样品中Cur含量测定方法的建立
采用HPLC法检测大鼠各组织样品中Cur的含量。
2.2.1 色谱条件 以DIKMA Diamonsil C18(250 mm×4.6 μm,5 mm)为色谱柱,以乙腈-0.50%磷酸溶液(58∶42,V/V)为流动相;检测器为紫外检测器,检测波长为426 nm,流速为1.0 mL/min,柱温为35 ℃,进样量为20 μL。
2.2.2 溶液的制备 (1)Cur对照品贮备液:精密称取Cur对照品13.21 mg于10 mL棕色容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得质量浓度为1.321 mg/mL的Cur对照品贮备液,于4 ℃冰箱中保存。临用前用甲醇稀释制成相应质量浓度的标准溶液。(2)大黄素对照品溶液:精密称取内标大黄素对照品20 mg于100 mL棕色容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得质量浓度为200 μg/mL的内标溶液,于4 ℃避光保存。
2.2.3 组织样品的处理 将大鼠的心、肺、肾和肝剪碎后,按照称定质量的2倍加入生理盐水匀浆,转移至离心管中,以4 000 r/min离心10 min,吸取上清液180 μL,精密加入大黄素对照品溶液20 μL、乙酸乙酯-甲醇混合溶剂(体积比为9∶1)1 mL,涡旋3 min后,以12 000 r/min离心10 min;小心吸取上层有机溶剂900 μL转移至另一离心管中,以氮气吹干,残渣加甲醇100 μL复溶,涡旋2 min,以12 000 r/min离心10 min,取上清液进样测定。
2.2.4 专属性考察 取空白心、肺、肾和肝组织样品,各空白组织+Cur(0.647 5 μg/mL)样品以及大鼠给药后0.5 h的组织样品各适量,按“2.2.3”项下方法处理(空白组织样品不需要添加内标)后,再按“2.2.1”项下色谱条件进样测定,记录色谱图。结果显示,Cur和大黄素的保留时间分别约为10.1、15.0 min,2个色谱峰互不干扰且峰形良好,理论板数以Cur和大黄素计均不低于2 000,且各样品中的内源性物质不干扰Cur的测定,表明该色谱条件下专属性良好。结果见图1~图3。
图1 空白组织样品的HPLC图
图2 空白组织+Cur+内标的HPLC图
图3 给药后0.5 h各组织样品+内标的HPLC图
2.2.5 线性关系、定量下限、检测限的考察 取质量浓度为1.321 mg/mL的Cur对照品贮备液,用甲醇逐级稀释成质量浓度分别为1 295.00、647.50、323.75、129.50、64.75、12.95、6.475、1.295、0.647 5 μg/mL的系列标准溶液。分别精密吸取心、肾和肝组织的空白匀浆液180 μL,加入上述系列标准溶液20 μL,然后按“2.2.3”项下方法处理,即得Cur质量浓度分别为129.5、64.75、32.375、12.95、6.475、1.295、0.647 5、0.129 5、0.064 75 μg/mL的系列标准心、肾、肝组织样品溶液。同法精密吸取肺组织空白匀浆液,加入647.50、323.75、129.50、64.75、12.95、6.475、1.295、0.647 5 μg/mL的系列标准溶液,同前处理,得Cur质量浓度分别为64.75、32.375、12.95、6.475、1.295、0.647 5、0.129 5、0.064 75 μg/mL的系列标准肺组织样品溶液。将上述组织样品溶液按“2.2.1”项下色谱条件进样分析,记录色谱图。以组织样品中Cur的质量浓度(X)为横坐标、Cur与内标的峰面积比值(Y)为纵坐标进行线性回归,以线性范围最低值为定量下限,以信噪比3∶1计算检测限。结果见表1。

表1 不同组织中Cur的线性关系、定量下限、检测限的考察结果
2.2.6 精密度与准确度试验 取Cur对照品适量,加入空白组织样品溶液,按“2.2.3”项下方法制备含Cur定量下限质量浓度的组织样品溶液以及含Cur低、中、高质量浓度(0.129 5、1.295、32.375 μg/mL)的组织样品溶液,每个质量浓度平行制备6份。按“2.2.1”项下色谱条件进样分析,以实测质量浓度与理论质量浓度进行比较,考察各样品中Cur质量浓度的日内精密度和准确度;连续3 d进样,考察批间精密度和准确度。结果显示,各样品日内、日间RSD均小于15%(n=6),准确度均值在标示值的±15%之内,符合生物样品定量分析的要求[13]。
2.2.7 提取回收率 按“2.2.3”项下方法配制含Cur低、中、高质量浓度(0.129 5、1.295、32.375 μg/mL)的组织样品溶液,各6份,按“2.2.1”项下色谱条件进样测定,记录Cur峰面积(As)和大黄素(内标)峰面积(Ai)。另取空白组织样品,同法预处理至氮气吹干,在残渣中加入低、中、高质量浓度(0.129 5、1.295、32.375 μg/mL)的Cur对照品贮备液20 μL,大黄素对照品溶液20 μL、甲醇60 μL,涡旋2 min;以12 000 r/min离心10 min,各质量浓度平行6份,按“2.2.1”项下色谱条件进样测定,记录未经提取的Cur峰面积(As’)和大黄素峰面积(Ai’)。分别计算Cur和大黄素的提取回收率:Cur提取回收率(%)=As/As’×100%;大黄素提取回收率(%)=Ai/Ai’×100%。结果显示,低、中、高质量浓度的Cur在心脏组织中的提取回 收 率 分 别 为(89.72±2.13)% 、(92.68±0.74)% 、(97.31±1.45)%,在肺组织中分别为(91.77±1.86)%、(96.27±1.07)%、(98.11±0.37)%,在肾组织中分别为(90.56±2.64)%、(95.19±0.93)%、(97.81±0.11)%,在肝组织中分别为(93.80±3.62)%、(97.77±1.07)%、(95.46±3.47)%,RSD均小于5%(n=6);大黄素在心、肺、肾、肝组织中的提取回收率分别为95.21%、94.38%、96.12%、95.72%,RSD均小于4%(n=6),符合生物样品定量分析的要求[13]。
2.2.8 稳定性试验 按“2.2.3”项下方法制备含Cur低、中、高质量浓度(0.129 5、1.295、32.375 μg/mL)的组织样品溶液,各3份,考察其于25 ℃放置24 h、-40 ℃放置24 h、反复冻融(-40 ℃~室温)3次的稳定性。结果显示,各样品测得质量浓度与理论质量浓度的相对误差(RE)均在±15%范围内,提示样品在上述条件下稳定性良好[13]。
2.3 Cur-SLN在大鼠心、肾、肺、肝组织的分布考察
2.3.1 分组、给药与样品采集 将大鼠随机分为Cur原料药组和Cur-SLN组,每组45只。于给药前12 h开始禁食不禁水,参考文献[14―15]给药方法,两组大鼠分别尾静脉注射Cur原料药混悬液(以含0.5%聚山梨酯80的生理盐水溶液溶解,临用现配)和Cur-SLN混悬液,以Cur计注射剂量为25 mg/kg。分别于给药后0.25、0.5、1、2、4、6、8、12、24 h时,各组分别取5只大鼠用乙醚麻醉,然后处死,解剖分离大鼠的心、肺、肾和肝组织,用生理盐水将组织表面的残血洗净,定性滤纸吸干后精确称质量,然后置于离心管内,保存备用。
2.3.2 Cur-SLN给药后的组织分布 取给药后不同时间点各组织样品适量,按“2.2.3”项下方法处理后,再按“2.2.1”项下色谱条件进样测定,记录峰面积并代入标准曲线计算不同时间点各组织样品中Cur的含量。采用SPSS 17.0软件对数据进行统计分析,数据均以±s表示,组间比较采用t检验。检验水准α=0.05。结果显示,与Cur原料药相应组织样品组比较,Cur-SLN组大鼠心、肾、肺(0.25~24 h各时间点)和肝(0.25~1 h、12~24 h各时间点)组织样品中Cur的含量均显著升高(P<0.05或P<0.01);而肝(2~8 h各时间点)组织样品中Cur的含量则显著降低(P<0.01)。结果见表2。
表2 各组大鼠给药不同时间点后各组织样品中Cur含量的测定结果(±s,n=5,μg/mL)
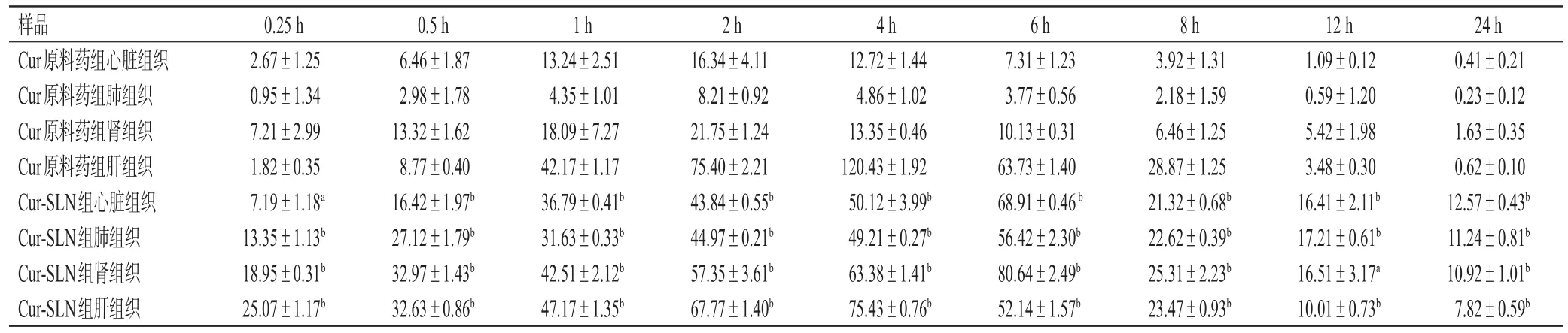
表2 各组大鼠给药不同时间点后各组织样品中Cur含量的测定结果(±s,n=5,μg/mL)
a:与Cur原料药组同时间点同组织样品比较,P<0.05;b:与Cur原料药组同时间点同组织样品比较,P<0.01
样品Cur原料药组心脏组织Cur原料药组肺组织Cur原料药组肾组织Cur原料药组肝组织Cur-SLN组心脏组织Cur-SLN组肺组织Cur-SLN组肾组织Cur-SLN组肝组织24 h 0.41±0.21 0.23±0.12 1.63±0.35 0.62±0.10 12.57±0.43b 11.24±0.81b 10.92±1.01b 7.82±0.59b 0.25 h 2.67±1.25 0.95±1.34 7.21±2.99 1.82±0.35 7.19±1.18a 13.35±1.13b 18.95±0.31b 25.07±1.17b 0.5 h 6.46±1.87 2.98±1.78 13.32±1.62 8.77±0.40 16.42±1.97b 27.12±1.79b 32.97±1.43b 32.63±0.86b 1 h 13.24±2.51 4.35±1.01 18.09±7.27 42.17±1.17 36.79±0.41b 31.63±0.33b 42.51±2.12b 47.17±1.35b 2 h 16.34±4.11 8.21±0.92 21.75±1.24 75.40±2.21 43.84±0.55b 44.97±0.21b 57.35±3.61b 67.77±1.40b 4 h 12.72±1.44 4.86±1.02 13.35±0.46 120.43±1.92 50.12±3.99b 49.21±0.27b 63.38±1.41b 75.43±0.76b 6 h 7.31±1.23 3.77±0.56 10.13±0.31 63.73±1.40 68.91±0.46 b 56.42±2.30b 80.64±2.49b 52.14±1.57b 8 h 3.92±1.31 2.18±1.59 6.46±1.25 28.87±1.25 21.32±0.68b 22.62±0.39b 25.31±2.23b 23.47±0.93b 12 h 1.09±0.12 0.59±1.20 5.42±1.98 3.48±0.30 16.41±2.11b 17.21±0.61b 16.51±3.17a 10.01±0.73b
3 讨论
纳米技术的迅速发展为人类很多重大疾病的治疗提供了新机会。纳米药物能够提高难溶性药物的有效性和安全性,在药物递送系统中起着非常重要的作用[16]。Cur具有多种药理活性,且毒性低、药源充足,但其生物利用度低,限制了其在临床中的应用[17]。SLN是一种针对低生物利用度活性成分的理想递药系统[18],能在一定程度上提高药物的生物利用度。
本课题组前期采用微乳法制备了Cur-SLN,并对其进行了质量评价和体外释药研究,其包封率为87.73%、载药量为7.72%、平均粒径为(168.9±1.0) nm、多分散系数为0.212±0.02[12],表明本课题组所制的Cur-SLN粒度均匀,理化性质良好。本研究以Cur原料药为参照,采用大鼠尾静脉给药后,考察Cur-SLN在大鼠心、肾、肺和肝组织中的分布情况。结果发现,与Cur原料药组比较,Cur-SLN组大鼠心、肾、肺(0.25~24 h各时间点)和肝(0.25~1 h、12~24 h各时间点)组织样品中Cur的含量均显著升高(P<0.05或P<0.01);而肝(2~8 h各时间点)组织样品中Cur的含量则显著降低(P<0.01)。由此可知,采用SLN负载Cur后,增加了Cur在心、肾、肺组织中的分布,延长了其在心、肾、肺组织中的相对滞留时间,有利于提高Cur在体内的生物利用度。静脉给药1 h后,Cur在肝组织中的分布先明显减少,12 h后又显著增加,这可能是由于各个组织中的药物浓度和药量分布是一个变化的过程,带负电荷的SLN易在肝组织中蓄积,从而出现肝组织药物分布的双峰现象。
综上所述,本研究将Cur制成SLN后,增加了其在心、肾、肺组织的分布。
