基于网络药理学和分子对接探究杜仲防治骨质疏松作用机制
2023-02-17曲永嘉孙晓伟周国兴程远志戴鸿哲李洪涛
曲永嘉,孙晓伟,2,周国兴,2,程远志,戴鸿哲,李洪涛,2※
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;3.哈尔滨工业大学计算学部,黑龙江 哈尔滨 150090;4.哈尔滨工业大学土木工程学院,黑龙江 哈尔滨 150090)
骨质疏松症(Osteoporosis,OP)是一种由多原因导致的全身性骨病[1],其临床表现多为疼痛、脊柱变形以及非外伤或轻微外伤引发的脆性骨折[2]。现阶段临床上以绝经期妇女和老年人的原发性骨质疏松最为常见,患者的骨密度和骨质量变差,骨微结构被破坏,生活质量受到极大影响。
近年来,大量研究表明一些中药成分能够通过信号通路的调节,使骨细胞的合成增多,并对一些破坏骨细胞的物质起抑制作用,进而达到改善骨质疏松的目的。杜仲为杜仲科植物杜仲的树皮,性温,味甘微辛,归肝、肾经,有补肝肾、强筋骨的效用。其中富含的黄酮类物质已被证实在防治OP中有着显著的效果[3],同时杜仲还具备价格相对较低、副作用较小的优点。所以,深入研究杜仲在骨质疏松防治中的作用机制,对其临床使用和相关药物研究都有着非常重大的意义。
因中药具有多组分、多靶点的特征,目前关于杜仲有效成分在基因水平上防治OP作用机制的研究相对较少,所以本文采用网络药理学的研究方法,旨在通过生物信息学分析、探究杜仲药物活性成分所对应的疾病靶点基因是如何通过信号通路来发挥作用的,为临床上进一步研究杜仲的作用机制、研发相关新药提供参考。
1 资料与方法
1.1 数据库与软件
本研究中所使用的数据库及软件,见表1。

表1 本研究所使用的数据库与软件Table 1 The database and software used in this research
1.2 方法
1.2.1 杜仲有效活性成分的筛选与作用靶点预测在TCMSP数据库中以“杜仲”为关键词进行搜索,数据库中提供了其组成化学物质的一系列参数。本文将以口服生物利用程度(Oral Bioavailability,OB)、类药性(Drug-Likeness,DL)这两种有重要含义的指数对研究对象加以选择。把OB值不低于30%且DL值不低于0.18的成分作为研究对象,同时在数据库中使用其对应的MOL ID完成对于预测作用靶点的检索。
1.2.2 杜仲有效活性成分作用靶点基因名标准化将预测靶点的名称输入UniProt数据库中,将其转化为数据库中记载的与人类有关的国际通用标准化基因名。其中部分作用靶点的作用对象不是人类,对于这部分靶点进行剔除,不予研究。
1.2.3 杜仲有效活性成分作用靶点网络的构建将所获取的有效活性成分进行编号,与标准化后的基因名导入Cytoscape 3.7.1软件做可视化处理,构建关于有效活性成分作用靶点的网络图。
1.2.4 骨质疏松疾病靶点的筛选在GeneCards、OMIM以及DrugBank这3大数据库中以“Osteoporosis”为关键词检索得到与骨质疏松有关的疾病靶点,将从3个数据库中得到的数据进行汇总与去重。
1.2.5 杜仲骨质疏松共同靶点的筛选将骨质疏松的疾病靶点与去重后的杜仲作用靶点做韦恩图,分析韦恩图得到药物疾病的共同靶点。
1.2.6 共同靶点的PPI网络构建将共同靶点的基因名导入STRING 11.5数据库中,minimum required interaction score选择0.4,其他条件选择默认参数,执行后得到共同靶点的蛋白质蛋白质网络。
1.2.7 杜仲骨质疏松关键靶点的筛选将上一步构建的PPI网络中的相关数据以文本形式导出,再利用Cytoscape 3.7.1自带的Network Analysis工具进行数据分析,以度值(Degree)与节点中心性(Betweenness Centrality)为依据分别选出前20位的靶点,取交集得到关键作用靶点。
1.2.8 GO功能与KEGG通路的富集分析将关键靶点的基因名导出,在R 4.1.2中对这些关键靶点进行GO功能与KEGG富集分析,富集结果中以P<0.05的数据具有统计学意义,再利用R 4.1.2将富集程度较好的条目进行可视化。
1.2.9 主要活性成分与关键靶点的分子对接利用Cytoscape 3.7.1建立起杜仲活性成分、骨质疏松和关键靶点之间的网络关系,对该网络进行网络分析,找出该网络中的主要活性成分和主要作用靶点,分别在PubChem数据库和PDB数据库中下载活性成分与主要作用靶点对应受体蛋白的3D模型,将二者在PyMOL 2.2.0中进行预处理后导入AutoDock 4.2.6中进行分子对接试验。
2 结果
2.1 杜仲有效活性成分的筛选
将TCMSP数据库中得到的数据按照条件筛选,剔除重复值,获得杜仲有效活性成分共计25个(表2),预测作用靶点共计202个,使用Cytoscape构建的杜仲有效活性成分作用靶点网络图见图1。
图1 杜仲有效活性成分 作用靶点网络图Fig.1 Composition target network diagram of Eucommia ulmoides

表2 杜仲有效活性成分Table 2 Effective active components of Eucommia ulmoides
2.2 杜仲 骨质疏松共同作用靶点的筛选
以“Osteoporosis”为关键词检索,在GeneCards、IMOM以及DrugBank 3大数据库中去除重复值后共得到4 603个疾病作用靶点,与杜仲的202个有效活性成分作用靶点做韦恩图(图2)取交集得到共同作用靶点144个。

图2 杜仲骨质疏松的共同作用靶点韦恩图Fig.2 Venn diagram of Eucommia ulmoides and osteoporosis disease targets
2.3 共同靶点的PPI网络构建
将共同靶点导入STRING 11.5数据库中,这144个靶点共产生了2 671条相互作用的连线,PPI网络图见图3。
图3 杜仲骨质疏松共同靶点的PPI网络图Fig.3 PPI network diagram of the common target of Eucommia ulmoides in the treatment of osteoporosis
2.4 杜仲 骨质疏松关键靶点的筛选
将STRING中得到的PPI网络相关数据导入Cytoscape 3.7.1中,经Network Analysis进行分析,见图4。其中的气泡越大,相关连接愈粗且愈多的节点在该PPI网络中也愈重要。这些点都是通过度值、节点中心性分析确定的。分别选取这两个参数中的前20个靶点,二者重合的部分就是该网络的关键靶点。分析后得到14个关键靶点,这些靶点在网络中的信息见表3。

表3 14个关键靶点Table 3 Fourteen hub targets
图4 杜仲骨质疏松关键靶点的网络分析图Fig.4 Hub target network diagram of Eucommia ulmoides in the treatment of osteoporosis
2.5 GO功能富集分析
对GO功能分别进行细胞组成(Cellular Component,CC)、分子功能(Molecular Function,MF)和生物进程(Biological Process,BP)的富集分析,并将富集结果的前20条进行可视化,其中CC只富集到10条,仅对这10条GO功能进行可视化,见图5。由富集结果可知,这些关键靶点在细胞中主要参与组成转录调控复合物、膜筏、膜微区和常染色质等结构,通过行使与转录因子、酶和蛋白受体结合的功能对细胞增殖、基因沉默、化学应激反应及氧化应激反应等生物进程起调控作用。
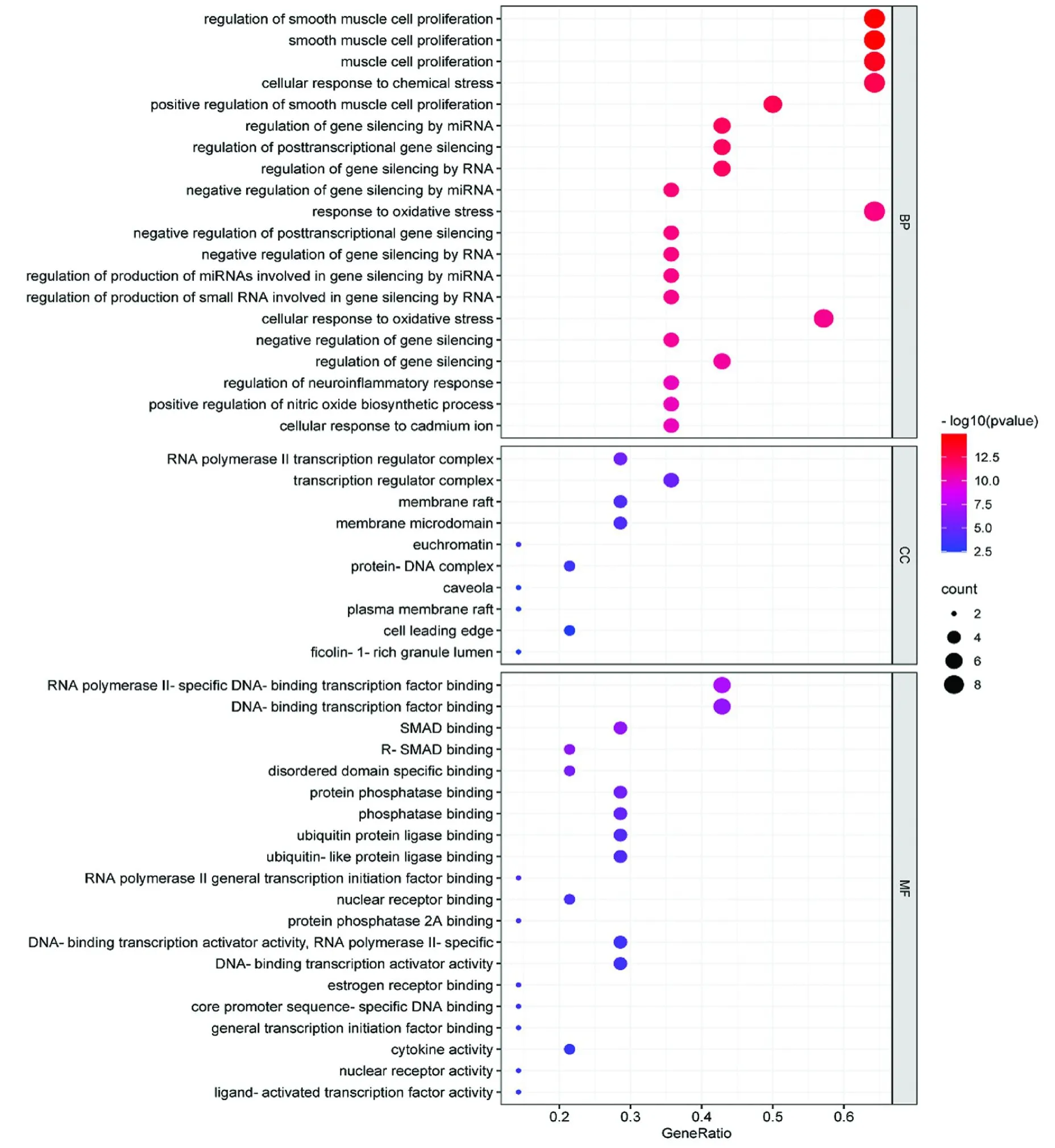
图5 杜仲治疗骨质疏松的GO功能富集结果Fig.5 GO function enrichment analysis Eucommia ulmoides in the treatment of osteoporosis
2.6 KEGG信号通路富集分析
对关键靶点进行KEGG富集分析,将前20条通路进行可视化,见图6。由富集结果可知,杜仲防治骨质疏松的关键靶点主要在与人体代谢、炎症反应和病毒感染等有关的通路中被大量富集。除去其中调节范围较广的信号通路后发现,这些关键靶点主要富集在IL-17信号通路(IL-17 signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway)以及雌激素信号通路(Estrogen signaling pathway)中,即这些通路的调节可能与杜仲防治骨质疏松有着紧密的联系。
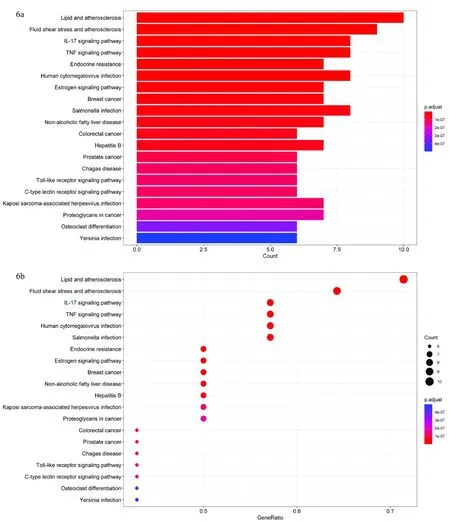
图6 杜仲治疗骨质疏松的KEGG通路富集分析结果Fig.6 KEGG pathway enrichment analysis of Eucommia ulmoides in the treatment of osteoporosis
2.7 主要活性成分与关键靶点的分子对接
由Cytoscape 3.7.1构建杜仲防治骨质疏松的“药物疾病靶点”网络(图7),对该网络进行分析可知,杜仲与关键靶点产生关联最多的主要活性成分为槲皮素(Quercetin)、山柰酚(Kaempferol)和-谷甾醇(Betasitosterol),这些活性成分的具体信息见表4。在该网络中还可以得到前列腺素内过氧化物合酶(prostaglandin-endoperoxide synthase 2,PTGS2)、热休克蛋白90A1(heat shock protein 90 alpha family class A member 1,HSP90AA1)、过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor gamma,PPARG)和JUN原癌基因(jun proto-oncogene,JUN)这4个关键靶点与药物产生的关联较多,将主要活性成分分别与这4个关键靶点中对应的靶点进行分子对接试验并得出对接的最低活化能(表5),并将其中对接活化能最小的几个模型进行可视化,见图8。对接结果显示,分子与受体蛋白的最低对接活化能均低于20.93kJ/mol,说明分子对接效果良好,同时也说明了中药多组分与多靶点的结合效果良好,能够通过与多靶点作用发挥防治疾病的功效。
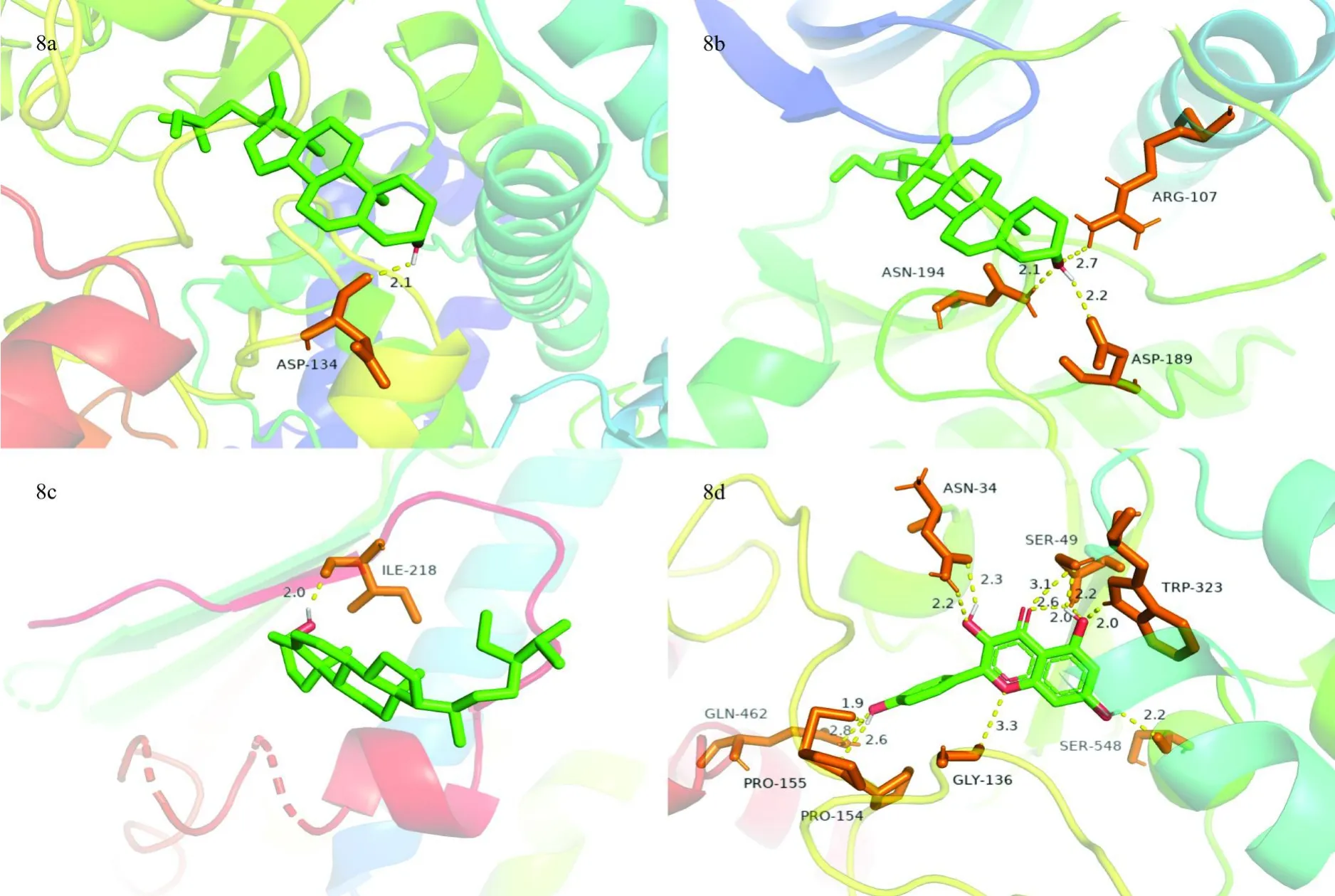
图8 分子对接模型Fig.8 Molecular docking model

表5 杜仲主要活性成分分子对接结果Table 5 Eucommia ulmoides molecular docking of main components
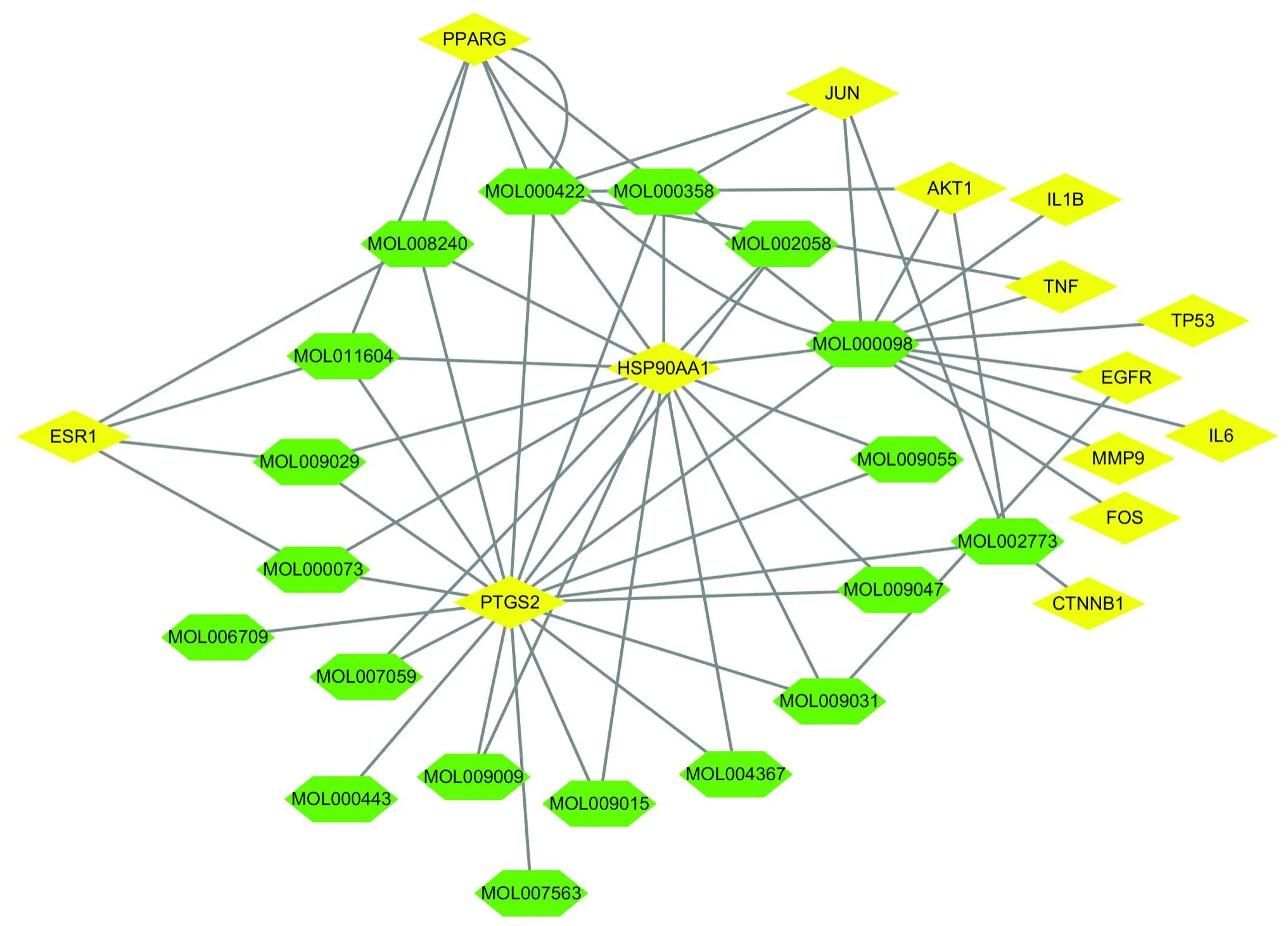
图7 “药物疾病靶点”网络图Fig.7 Network diagram of“Drug Disease Target”

表4 杜仲主要化学成分Table 4 Important chemical components of Eucommia ulmoides
3 讨论
中药作为一种天然药物,其组分十分复杂,具有多组分多作用靶点的特征,若依旧采用传统的细胞或者动物实验很难明确阐述清楚其多组分的作用机制,所以应用网络药理学,以庞大的化学成分、基因、靶点和疾病数据库作为支撑,将单味中药的组成成分拆解开来,将其导入庞大且复杂的网络数据库中,利用构建网络的方式分析节点之间的关系可以从一定程度上阐明其主要的作用机制。
本研究中,通过“药物疾病靶点”网络发现杜仲防治骨质疏松的主要活性成分为槲皮素、山柰酚和-谷甾醇。槲皮素可以有效的抗衰老,它不仅可以清理衰老的骨髓间充质干细胞,还可以不断补充该细胞,减少细胞的流失[4]。该成分作为黄酮类化合物,在动物实验中[5]已经被证实可以通过上调成骨细胞下调破骨细胞来改善实验对象的骨质。有研究表明[6],山柰酚可以通过刺激Wnt/-catenin这一协调控制成骨细胞分化的通路,抑制IL-6的表达,使由破骨细胞引导的骨吸收过程减缓,让骨的形成与吸收过程重新趋于正常状态,使得骨重建处于一个稳态过程,以达到防治骨质疏松的目的。-谷甾醇具有较好的抗炎作用,-谷甾醇可以通过抑制NF-B和细胞外调节激酶的信号传导来降低炎症的发生,并且可以使一些与骨质疏松有关的炎症因子,如IL-6、TNF-等的表达水平显著降低以达到防治骨质疏松的目的[7,8]。
由本研究中构建的PPI网络共筛选出了14个关键靶点,其中PTGS2、HSP90AA1、PPARG、ESR1和JUN这5个靶点与杜仲活性成分的关联最为紧密,在相关网络中占据着重要地位。PTGS2可以促进前列腺素E2(prostaglandin E2,PGE2)的表达,而PGE2可以通过激活蛋白激酶B(Akt)诱导骨形成,同时PGE2还可以与核因子B配体受体激活因子(receptor qctivator for nuclear factor-B ligand,RANKL)联合作用抑制甲状旁腺激素(parathyroid hormone,PTH)的持续表达,促进骨的合成[9,10]。在Chen等[11]的实验中,当成年小鼠成骨细胞中的PTGS2基因被敲除时,其骨流失显著加快,骨密度大幅下降,这也说明了PTGS2与诱导成骨细胞分化促进骨形成的进程有关。HSP90AA1在研究中被证实可以促进细胞的自噬,当HSP90AA1正常表达时可以通过自噬作用参与到骨重建的过程中,可以促进骨质的更新,但当其异常过量表达时则可能对某些癌变细胞的耐药性产生影响,不利于异常细胞的凋亡[12]。在骨骼中,PPARG的活性与调控骨髓基质干细胞向成骨或成脂方向分化有着紧密的联系,通常当PPARG被激活活性增强时会增加破骨细胞的吸收活性,并使骨髓基质干细胞向形成脂肪细胞的方向发展,抑制骨形成,加速骨流失[13,14]。有研究证实[15],B细胞中ESR1的表达水平下降时,与破骨细胞生成有关的因子表达水平会升高,而与成骨细胞生成有关的因子则会减少表达,骨吸收和骨形成稳态被打破导致骨质疏松的恶化。JUN有促进成骨的潜能,它可以诱导骨损伤部位细胞构建钙化组织,加速骨缺损的填充[16]。以上事实说明,这些关键靶点可以通过调控骨吸收与骨形成来影响骨质疏松的疾病进程。
本研究将杜仲主要活性成分槲皮素、山柰酚和-谷甾醇分别与关键靶点PTGS2、HSP90AA1、PPARG和JUN进行了分子对接试验,由分子化学结构式及对接模型可知,-谷甾醇分子中有一个羟基,羟基上的氢原子与电负性大、半径小的氧原子以共价键的形式相结合,当有其他电负性大的原子接近羟基时会形成分子间氢键将二者结合,因氧原子本身的电负性也很大,且羟基氧上有两对孤对电子可以与其他符合条件的氢原子形成两个氢键,所以羟基既可以作为氢键供体也可作为氢键受体,即小分子的羟基处可以形成多重氢键。由-谷甾醇的对接模型可知,-谷甾醇在与PTGS2、HSP90AA1蛋白进行对接时羟基作为氢键供体分别与氨基酸残基Asp134和Ile218形成氢键相互作用,而在与JUN蛋白进行对接时羟基作为氢键供体在氢原子处与氨基酸残基Asp189形成氢键,作为氢键受体在氧原子处与氨基酸残基Asn194、Arg107形成氢键。山柰酚分子中除能形成多重氢键的羟基外,还含有羰基和醚键且其中的氧原子均含有两对孤对电子,所以山柰酚与PTGS2的对接模型显示,山柰酚分子中的羟基分别与氨基酸残基Pro155、Pro154、Gln462、Asn34、Trp323、Ser49和Ser548形成氢键相互作用,羰基及醚键分别与氨基酸残基Ser49、Gly136形成氢键相互作用,其中氨基酸残基Asn34、Ser49还以多重氢键的形式与山柰酚分子进行了对接,使得山柰酚与PTGS2蛋白的结合更为稳固。同时,分子与受体蛋白的最低对接活化能均低于20.93 kJ/mol,说明各分子与靶点蛋白之间的对接效果良好,也证实了中药相关组分可与多靶点相结合来发挥防治疾病的功效。
GO功能富集结果显示,杜仲防治骨质疏松的关键靶点主要对细胞增殖、基因沉默、化学应激反应和氧化应激反应等生物进程起调控作用。而KEGG富集分析结果显示,这些关键基因主要富集在与炎症因子及激素受体有关的信号通路中。
IL-17与TNF信号通路主要与炎症有关。其中IL-17由T细胞亚群释放,IL-17在正常生理条件下可与受体结合诱导成骨细胞的合成,而过量的IL-17则会刺激成骨细胞祖细胞分泌RANKL从而使得破骨细胞的增殖能力提高[17,18]。TNF通路则可以诱导IL-6炎症因子的产生,进而对骨组织产生影响[19],同时该通路的主要调节因子TNF-能够影响成骨细胞的活性,抑制其分化,使丢失的骨无法得到及时补充引发骨质疏松[20]。雌激素可以与雌激素信号通路中的雌激素受体相结合,对破骨细胞和成骨细胞的生长凋亡发挥调控作用[21,22],还有研究证实,当雌激素缺乏或破骨细胞中的雌激素受体表达受限时,破骨细胞被激活,骨流失加快[23]。以上事实说明,IL-17、TNF和雌激素信号通路以及通路中的相关因子主要通过调控细胞增殖与炎症反应来影响骨质疏松的发展进程。
综上所述,本研究应用网络药理学的分析方法,分析了杜仲在防治骨质疏松这一疾病时的具体作用机制,发现PTGS2、HSP90AA1、PPARG、ESR1和JUN等靶点为防治骨质疏松的关键靶点,这些靶点会影响细胞增殖、基因沉默和相关细胞反应等多个生物进程,并通过IL-17信号通路、TNF信号通路以及雌激素受体信号通路等通路实现对于骨质疏松的防治。但由于网络数据库仍在不断更新扩充,具有一定的局限性,以上结论仍需进一步的实验探究去印证。
