不同采收时期和不同性别的梅花鹿尾化学成分对比分析
2023-02-17赵丽娟李志满张燕停张悦孙印石
赵丽娟,李志满,张燕停,张悦,孙印石
(中国农业科学院特产研究所,吉林 长春 130112)
鹿尾(Cauda Cervi)为鹿科动物梅花鹿(Cervus Nippon Temminck)或马鹿(Cervus elaphus Linnaeus)的干燥尾部。性温,味甘咸,归肾经[1]。《四川中药志》记载:“鹿尾暖腰膝,益肾精,治腰脊疼痛不能屈伸,肾虚遗精及头昏耳鸣”。现代研究表明,鹿尾能明显增加雄性大鼠的睾丸、前列腺、贮精囊、提肛肌、海绵球肌的重量和雌性大鼠子宫、卵巢的重量[2],能显著增加雄性大鼠血清中IL-2、IgG、睾酮的含量和睾丸指数以及增加雌性大鼠血清中IL-2、IgG的含量,但对雌雄大鼠血清中的IgM、IgA、孕酮水平和肝、脾指数均无显著性影响[3]。公鹿经历两个典型的生物学时期即生茸期和发情期。鹿受自身生理活动和饮食习惯的影响,不同生物学时期的营养摄入、能量储备和生理指标差异较大[4,5]。已有研究表明,发情期公鹿体内胆固醇、蛋白质、葡萄糖和乳酸脱氢酶水平显著高于生茸期[6]。生茸期梅花鹿血中卵磷脂、尿嘧啶、次黄嘌呤及SOD等抗衰老相关成分含量高于发情期[7]。发情期的鹿尾具有特殊的生物学功能,尾腺分泌物可以诱导雄鹿裂唇嗅和爬跨等性行为[8,9],增加雌鹿妊娠后期和哺乳期的社交和预警作用[10]。到目前为止,不同采收时期和不同性别的鹿尾营养价值有何差别尚不明确,化学成分差异未见报道。因此,本研究通过对化学成分的对比分析,旨在为阐明不同采收时期和性别的鹿尾营养差别提供参考。
1 材料与方法
1.1 样品
鲜梅花鹿尾公、母各5只分别于2020年6月(生茸期)和11月(发情期)采自吉林省吉林市昌邑区左家镇中国农业科学院特产研究所试验站,经试验站崔学哲研究员鉴定,分别为生茸期公梅花鹿尾、生茸期母梅花鹿尾(指公鹿生茸同期)、发情期公梅花鹿尾和发情期母梅花鹿尾。样品经净制、自然风干和冷风吹干、粉碎、过80目筛,备用。
1.2 仪器与设备
Acquity UPLC H-Class超高效液相色谱仪,美国Waters公司;Thermo Scientific ISQ气质联用仪,美国Thermo Fisher Scientific公司;Varian 710-ES全谱直读电感耦合等离子体发射光谱仪,美国Varian公司;752N紫外可见分光光度计,上海仪电分析仪器有限公司;NDA701杜马斯快速定氮仪,意大利VELP公司;Speed Wave MSW-4微波消解仪,德国Berghof公司;TGL-16G高速台式离心机,上海安亭科学仪器厂;DTC-8超声波清洗机,湖北鼎泰生化科技设备制造有限公司;XS205DU电子天平,瑞士Mettler Toledo公司;XW-80 A微型漩涡混合仪,上海沪西分析仪器厂有限公司。
1.3 试剂
核苷对照品,纯度≥98%,上海源叶生物科技有限公司,包括:尿嘧啶(批号TM0313XB13)、胞嘧啶(批号TN1128XA13)、腺嘌呤(批号X18N6M6005)、鸟嘌呤(批号KM0522CA14)、次黄嘌呤(批号TM0313XC13)、黄嘌呤(批号AJ0722MA14)、尿苷(批号TM0313XA13)、胸腺嘧啶(批号140708-200401)、肌苷(批号TJ0623XA13)、鸟苷(批号AJ0609NA14)、腺苷(批号KM0529CA14)、2’-脱氧鸟苷(批号N07A7W12580)、-胸苷(批号DN1122WB13);AccQ Tag氨基酸试剂包(批号5047302751),美国Waters公司,包括氨基酸专用衍生剂AccQ Fluor Buffer、AccQ Tag Eluent A溶液、硼酸盐缓冲液;17种氨基酸混合标准液(组氨酸、丝氨酸、精氨酸、甘氨酸、天冬氨酸、谷氨酸、苏氨酸、丙氨酸、脯氨酸、半胱氨酸、赖氨酸、酪氨酸、蛋氨酸、缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸)(批号KIT0300481);37种脂肪酸甲酯混合标准液,10 g/L,上海安谱实验科技股份有限公司;激素对照品,纯度≥98%,上海源叶生物技术有限公司,包括雄烯二酮(批号Y28D7C27711)、睾酮(批号L27O6T5104)、甲睾酮(批号Y25J7C9452)、孕酮(批号YN1121DA14)、雌二醇(批号TMO328CA13)、雌三醇(批号Y39D6D8370)、可的松(批号BDF8F)和氢化可的松(批号L31J8Y40938);Ag、Al、As、Ba、Be、Ca、Cd、Cr、Cu、Fe、Hg、K、Mg、Mo、Na、Ni、Pb、S、Se、Sn、Sr、Ti、Tl和Zn的多元素混合标准储备液,购于国家有色金属及电子材料分析测试中心;D(+)-无水葡萄糖(批号S08J6G1);盐酸、无水乙醇、甲醇、正己烷、石油醚、硫酸、苯酚、三氯甲烷、丙酮、硝酸、高氯酸及氨水均为分析纯(北京化工厂);乙腈(色谱纯,美国Fisher公司)。
1.4 方法
1.4.1 核苷测定 参照孙印石等[11]的方法采用UPLC法检测鹿尾中13种核苷含量。准确称取鹿尾粉末0.10g,置于含有3 mL蒸馏水的离心管中,涡旋20 s,使样品充分混匀,密封冷藏过夜。超声提取60 min,10 000 r/min离心10 min,上清液过0.22m水系滤膜,上机检测。
1.4.2 粗蛋白测定 依据GB 5009.5-2016采用快速定氮仪检测鹿尾中粗蛋白含量,燃烧管温度(CR)在1 030℃以上,还原管温度(RR)在650℃以上。
1.4.3 水解氨基酸测定 参照陆雨顺等[12]的方法,采用柱前衍生-UPLC检测鹿尾中17种水解氨基酸含量。准确称取鹿尾粉末40mg于具塞水解管中,加入20mL浓度为6 mol/L的盐酸溶液,充分混匀后充氮气封管,110℃水解22 h,冷却后取1 mL水解液于粗径试管,80℃水浴挥干,再加入1 mL超纯水反复挥干2~3次。加入1 mL超纯水复溶,涡旋至样品充分溶解,经0.22m滤膜过滤至进样瓶待衍生化。衍生:准确移取10L系列浓度的氨基酸对照品溶液和供试品溶液于衬管中,加入70L硼酸盐缓冲液和20L AQC衍生试剂,涡旋15 s,室温放置1 min,密封于进样瓶中,于55℃恒温干燥箱内加热10 min,上机检测。
1.4.4 脂肪酸测定 依据GB 5009.168-2016采用GCMS检测鹿尾中37种脂肪酸。色谱柱:DB-23 60 m 0.25mm,0.25m;载气:高纯氦气;载气流量:1.0mL/min;进样口:220℃;EI源:230℃;程序升温条件:初始温度为60℃,保持1 min,10℃/min升温至180℃,然后以3℃/min升温至220℃,保持2 min。
1.4.5 激素测定 标准曲线的绘制:准确称取各激素对照品1.00 mg,置于50 mL容量瓶中,乙腈定容,配制成浓度为20g/mL的对照品溶液。取雄烯二酮、睾酮、甲睾酮、孕酮母液配制成2.5 ng/mL、5 ng/mL、10 ng/mL、20ng/mL、25ng/mL系列浓度的混合对照品溶液。取雌二醇、雌三醇母液配制成2.5ng/mL、5ng/mL、10ng/mL、20ng/mL、40ng/mL系列浓度的混合对照品溶液。取可的松、氢化可的松母液配制浓度为2.5ng/mL、5ng/mL、10ng/mL、20ng/mL、40 ng/mL的混合对照品溶液,上机检测。以峰面积(y)对质量浓度(x)进行线性回归,绘制标准曲线,得到8种激素的线性回归方程。见表1。

表1 8种激素含量测定的标准曲线和相关系数Table 1 Standard curves and correlation coefficients for the determination of 8 hormones
供试品溶液制备:准确称取鹿尾粉末1.00 g置于50 mL离心管中,加入10 mL甲醇,涡旋30 s,振荡10 min,超声提取15 min,8 000 r/min离心10 min,过滤上清液。残渣加入10 mL甲醇重复上述步骤提取2次,合并提取液。将提取液50℃蒸发至尽干,待净化。
净化:加入1 mL乙腈:水(1:1)复溶,充分涡旋后转移至含50 mg PSA和30 mg中性氧化铝的2 mL离心管中,震荡5 min。充分混匀后,15 000 r/min离心15 min,取上清液过0.22m有机滤膜,上机测定。
色谱条件:色谱柱:ACQUITY BEH C18(2.1 mm 100 mm,1.7m);柱温:40℃;流速:0.3 mL/min;进样量:1L;雌激素流动相:0.01%甲酸水 甲醇;雄激素、孕激素及皮质醇流动相:水 乙腈;雌激素梯度洗脱程序:0~4 min,35%~50%甲醇;4~4.5 min,50%~100%甲醇;4.5~5.5 min,100%甲醇;5.5~5.6 min,100%~35%甲醇;5.6~9 min,35%甲醇。雄激素、孕激素及皮质醇梯度洗脱程序:0~8 min,50%~64%甲醇;8~11 min,64%~84%甲醇;11~12.5 min,84%~100%甲醇;12.5~14.5 min,100%甲醇;14.5~15 min,100%~50%甲醇;15~17 min,50%甲醇。
质谱条件:雌激素、皮质醇电离方式为负离子模式(ESI-),雄激素、孕激素电离方式为正离子模式(ESI+);扫描方式:多反应监测(MRM);毛细管电压:3 kV;离子源温度:150℃;脱溶剂温度:450℃;碰撞气流量:0.19 mL/min;脱溶剂气流量:1 000 L/h。8种激素MRM色谱图见图1。

图1 8种激素MRM色谱图Fig.1 MRM chromatograms of 8 hormones
1.4.6 无机元素测定参照王泽帅等[13]的方法采用ICP-OES检测鹿尾中24种无机元素含量。准确称取鹿尾粉末0.10 g,置于100 mL三角烧瓶中,加硝酸高氯酸(4:1)混合溶液5 mL,混匀,瓶口加一小漏斗,浸泡过夜。升温消解:初始温度80℃,保持25 min;80~120℃,保持25 min;120~180℃,保持25 min;180~240℃,保持30min。消解完毕将消解液转入50mL容量瓶中,用2%硝酸溶液少量多次洗涤容器,合并洗液,并定容至刻线。
仪器参数:RF功率:1 200 W;稳定时间:3 s;等离子体流速:15.0 L/min;气流:1.50 L/min;光路温度:35℃;泵速:7 r/min。
1.4.7 水溶性多糖测定标准曲线的绘制:取0.50 g无水葡萄糖,于100℃下烘至恒重,准确称取10 mg,置于100 mL容量瓶中,加超纯水溶解并定容至刻线,配置成浓度为0.1 mg/mL的对照品溶液。依次吸取0.05 mL、0.10 mL、0.20 mL、0.40 mL、0.60 mL和0.80 mL置于试管中,用超纯水定容至1mL。加入2.5 mL浓硫酸和0.5 mL质量分数为6%的苯酚水溶液,涡旋混匀,室温静置30 min,测定490 nm处吸光度。以吸光度(y)对质量浓度(x)进行线性回归,测得标准曲线y=0.010 2x+0.035 4,R2=0.999 4。
供试品溶液制备:准确称取鹿尾粉末1.0 g,加入5 mL石油醚,涡旋10 min,以8 000 r/min离心5 min,弃去上清液,残渣重复脱脂2次,氮气吹干溶剂。加入10 mL超纯水,涡旋混匀,预浸12 h,于50℃超声提取1 h,以8 000 r/min离心5 min,残渣加入10 mL超纯水重复提取1次,合并提取液。采用Sevag法除蛋白,加入5mL氯仿正丁醇(1:1,v/v)溶液,涡旋10min,以8000r/min离心5min,沉淀蛋白质,重复上述操作。加入30 mL无水乙醇,于4℃冷藏过夜,以8000r/min离心10 min,弃去上清液,沉淀80℃烘干即得鹿尾水溶性多糖供试品。称取多糖供试品2 mg,加入20 mL超纯水溶解,准确量取1 mL溶液,测定方法同标准曲线的绘制。
1.4.8 数据处理所有样品重复测定3次,实验结果以“平均值±标准差”表示。采用SPSS statistics 26.0进行单因素ANOVA检验分析,用Excel绘制表格。
2 结果与分析
2.1 核苷含量对比分析
不同采收时期和性别的鹿尾13种核苷含量见表2。4组鹿尾样品鸟嘌呤、黄嘌呤和肌苷含量有显著差异,发情期母鹿尾鸟嘌呤含量显著低于其他3组鹿尾(P<0.05),生茸期母鹿尾黄嘌呤含量显著低于其他3组鹿尾(P<0.05),肌苷含量以发情期公鹿尾最高,为0.52 g/kg,显著高于生茸期公鹿尾(P<0.01)和2组母鹿尾(P<0.05),母鹿尾不同时期间无显著差异。尿嘧啶、胸腺嘧啶含量为发情期>生茸期(P<0.05),尿苷、-胸苷含量为生茸期>发情期(P<0.05),不同性别间无显著差异;鸟苷含量为发情期公鹿尾>发情期母鹿尾>生茸期母鹿尾>生茸期公鹿尾,组间差异具有统计学意义。核苷总量及其他组分不同时期和性别间均无显著差异(P>0.05)。
表2 不同采收时期和性别的鹿尾中核苷含量(±,n=5)Table 2 Nucleoside content of deer tail in different periods and genders(±s,n=5) g/kg

表2 不同采收时期和性别的鹿尾中核苷含量(±,n=5)Table 2 Nucleoside content of deer tail in different periods and genders(±s,n=5) g/kg
注:同一行上标字母相同表示没有显著性差异(P>0.05),反之有显著差异(P<0.05)。“—”表示未检出或不在检出限范围内,下同。Note:The same superscript on the same line indicates no significant difference(P>0.05),otherwise there is a significant difference(P<0.05).” -” means not detected or not within the detection limit,the same as below.
名称Designation生茸期公鹿尾Males in antler-producing stage生茸期母鹿尾Females in antler-producing stage发情期公鹿尾Males in estrus stage发情期母鹿尾Females in estrus stage胞嘧啶 0.02±0.00a 0.02±0.00a 0.02±0.00a 0.02±0.00a尿嘧啶 0.54±0.15b 0.59±0.01b 0.76±0.01a 0.84±0.01a腺嘌呤 0.22±0.08a 0.30±0.05a 0.27±0.00a 0.29±0.07a鸟嘌呤 0.25±0.01a 0.26±0.01a 0.25±0.00a 0.18±0.00b次黄嘌呤 0.66±0.14a 0.70±0.04a 0.68±0.01a 0.78±0.09a黄嘌呤 0.10±0.02a 0.04±0.00b 0.12±0.02a 0.12±0.01a尿苷 0.58±0.17a 0.60±0.27a 0.11±0.05b 0.14±0.06b胸腺嘧啶 0.18±0.06b 0.26±0.07ab 0.31±0.03a 0.31±0.03a肌苷 0.27±0.03c 0.33±0.02b 0.52±0.01a 0.35±0.00b鸟苷 0.29±0.03d 0.35±0.02c 0.54±0.01a 0.44±0.00b腺苷 0.16±0.06a 0.10±0.08a 0.14±0.00a 0.08±0.01a 2” -脱氧鸟苷 0.17±0.05a 0.16±0.09a 0.14±0.06a 0.09±0.01a-胸苷 0.29±0.01a 0.25±0.05a 0.16±0.00b 0.13±0.00b总量 3.69±0.84a 4.00±0.69a 4.02±0.21a 3.77±0.31a
2.2 粗蛋白和水解氨基酸含量对比分析
由表3可知,4组鹿尾粗蛋白含量为发情期母鹿尾(77.00%)>生茸期母鹿尾(75.10%)>发情期公鹿尾(74.40%)>生茸期公鹿尾(73.40%)(P<0.05),表现出发情期>生茸期、母>公的趋势。鹿尾不同时期和性别间水解氨基酸总量(AA)无显著差异。必需氨基酸总量(EAA)以生茸期母鹿尾最高,为26.14%,显著高于发情期公鹿尾(20.49%)(P<0.05)。EAA/AA为生茸期母鹿尾(43.31%)>发情期母鹿尾(42.49%)>生茸期公鹿尾(42.19%)>发情期公鹿尾(41.68%),表现出生茸期>发情期,母鹿>公鹿的趋势。分析各组分得出,发情期公鹿尾中His含量显著低于其他3组鹿尾(P<0.05);生茸期母鹿尾中Ser、Asp和Cys含量显著高于发情期公鹿尾,Met、Ile和Phe含量显著高于其他3组鹿尾(P<0.05);Gly含量以发情期母鹿尾最高,为5.58%,显著高于其他3组鹿尾(P<0.05)。生茸期Lys含量显著高于发情期,不同性别间无显著差异。不同采收时期和性别的鹿尾中其他核苷组分均无显著差异。
表3 不同采收时期和性别的鹿尾中粗蛋白和水解氨基酸含量(±,n=5)Table 3 Contents of crude protein and hydrolyzed amino acid of deer tail in different periods and genders(±s,n=5) g/100g

表3 不同采收时期和性别的鹿尾中粗蛋白和水解氨基酸含量(±,n=5)Table 3 Contents of crude protein and hydrolyzed amino acid of deer tail in different periods and genders(±s,n=5) g/100g
注:*表示必需氨基酸,“EAA”表示必需氨基酸总量,“AA”表示氨基酸总量,“CP”表示粗蛋白。Note:*represents the essential amino acid,” EAA” represents the total essential amino acid,” AA” represents the total amino acid,” CP” represents the crude protein.
名称Designation生茸期公鹿尾Males in antler-producing stage生茸期母鹿尾Females in antler-producing stage发情期公鹿尾Males in estrus stage发情期母鹿尾Females in estrus stage His 2.12±0.11a 2.39±0.23a 1.25±0.45b 1.92±0.23a Ser 2.15±0.10ab 2.49±0.33a 1.97±0.17b 2.27±0.32ab Arg* 2.80±0.22a 3.27±0.42a 2.78±0.21a 3.22±0.28a Gly 4.25±0.38b 4.79±0.61b 4.57±0.32b 5.58±0.26a Asp 5.91±0.34ab 6.83±0.95a 5.14±0.45b 5.82±0.35ab Glu 7.98±0.67a 8.63±1.17a 7.21±0.66a 7.90±0.30a Thr* 2.76±0.36a 3.12±0.55a 2.39±0.17a 2.61±0.48a Ala 2.87±0.26a 3.03±0.47a 2.90±0.24a 3.22±0.16a Pro* 2.85±0.15a 3.09±0.47a 2.92±0.35a 3.54±0.39a Cys 0.14±0.01ab 0.15±0.03a 0.11±0.02b 0.12±0.01ab Lys* 0.13±0.01a 0.14±0.06a 0.04±0.01b 0.06±0.01b Tyr 5.63±0.48a 5.91±1.05a 4.85±0.38a 4.90±0.46a Met* 3.07±0.21b 3.93±0.42a 2.55±0.46b 2.90±0.30b Val* 3.14±0.25a 3.45±0.44a 2.83±0.25a 3.07±0.29a Ile* 2.80±0.20ab 3.25±0.45a 2.42±0.18b 2.57±0.25b Leu* 3.10±0.35a 3.47±0.50a 2.86±0.22a 3.12±0.46a Phe* 2.01±0.22b 2.42±0.18a 1.70±0.15b 1.90±0.11b AA 53.71±4.32a 60.36±8.33a 49.16±4.47a 54.11±4.88a EAA 22.66±1.97ab 26.14±3.49a 20.49±2.00b 22.99±2.57ab CP 73.40±0.06d 75.10±0.06b 74.40±0.25c 77.00±0.04a
2.3 脂肪酸含量对比分析
由表4可知,生茸期鹿尾检出12种脂肪酸,发情期公鹿尾检出除C20:1,cis-11以外的11种脂肪酸,发情期母鹿尾检出9种,未检出C14:1,cis-9、C20:1,cis-11和C20:4,cis-5,8,11,14。脂肪酸总量(FA)以生茸期公鹿尾最高,为19.10 g/kg,高于生茸期母鹿尾和发情期公鹿尾约1.6倍,高于发情期母鹿尾5倍左右。饱和脂肪酸总量(SFA)为生茸期公鹿尾(7.07 g/kg)>生茸期母鹿尾(3.21g/kg)>发情期公鹿尾(2.41 g/kg)>发情期母鹿尾(1.40 g/kg)(P<0.05)。单不饱和脂肪酸总量(MUFA)以生茸期公鹿尾最高,为10.75g/kg,高于生茸期母鹿尾和发情期公鹿尾约2倍,高于发情期母鹿尾9倍左右,均表现出生茸期>发情期,公鹿>母鹿的趋势。多不饱和脂肪酸总量(PUFA)以发情期母鹿尾最低,为0.51 g/kg,显著低于生茸期和发情期公鹿尾(P<0.05)。不饱和脂肪酸占比为发情期公鹿尾(69.01%)>生茸期公鹿尾(63.02%)>生茸期母鹿尾(57.28%)>发情期母鹿尾(55.07%)。
表4 不同采收时期和性别的鹿尾中脂肪酸含量(±,n=5)Table 4 Fatty acid content of deer tail in different periods and genders(±s,n=5) g/kg
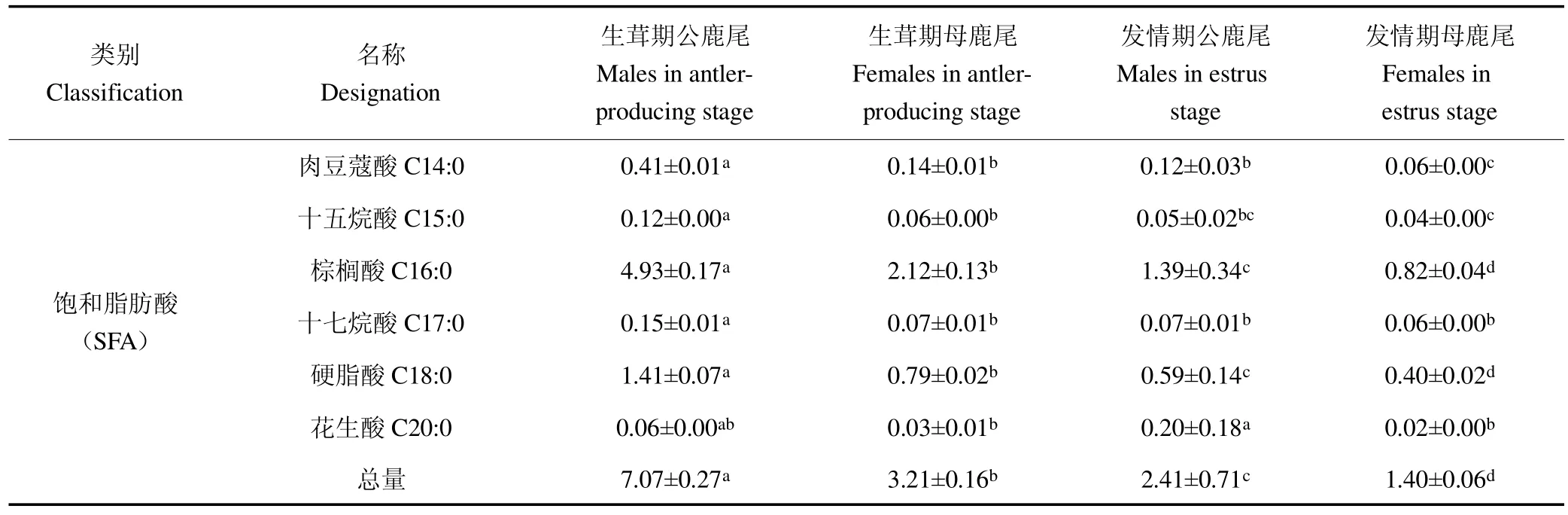
表4 不同采收时期和性别的鹿尾中脂肪酸含量(±,n=5)Table 4 Fatty acid content of deer tail in different periods and genders(±s,n=5) g/kg
类别Classification名称Designation生茸期公鹿尾Males in antlerproducing stage生茸期母鹿尾Females in antlerproducing stage发情期公鹿尾Males in estrus stage发情期母鹿尾Females in estrus stage饱和脂肪酸(SFA)肉豆蔻酸C14:0 0.41±0.01a 0.14±0.01b 0.12±0.03b 0.06±0.00c十五烷酸C15:0 0.12±0.00a 0.06±0.00b 0.05±0.02bc 0.04±0.00c棕榈酸C16:0 4.93±0.17a 2.12±0.13b 1.39±0.34c 0.82±0.04d十七烷酸C17:0 0.15±0.01a 0.07±0.01b 0.07±0.01b 0.06±0.00b硬脂酸C18:0 1.41±0.07a 0.79±0.02b 0.59±0.14c 0.40±0.02d花生酸C20:0 0.06±0.00ab 0.03±0.01b 0.20±0.18a 0.02±0.00b总量 7.07±0.27a 3.21±0.16b 2.41±0.71c 1.40±0.06d

续表 g/kg
2.4 激素含量对比分析
不同采收时期和性别的鹿尾中8种天然激素含量见表5。雄烯二酮在公鹿尾和母鹿尾中均有检出,同一时期公鹿尾是母鹿尾含量的2.5倍左右,发情期含量显著高于生茸期(P<0.05)。睾酮和甲睾酮只在公鹿尾中检出,发情期含量极显著升高,分别约为生茸期的8.6、27倍。雌二醇含量为发情期母鹿尾(30.18 ng/g)>生茸期母鹿尾(5.16 ng/g)>发情期公鹿尾(3.85 ng/g)>生茸期公鹿尾(2.38 ng/g)(P<0.001)。雌三醇含量以发情期母鹿尾最高,为16.75 ng/g,高于生茸期母鹿尾4.4倍。公鹿尾检出微量雌三醇,不同时期间无显著差异。孕酮、氢化可的松和激素总量均表现为发情期母鹿尾>发情期公鹿尾>生茸期母鹿尾>生茸期公鹿尾(P<0.001)。4组鹿尾可的松含量无显著差异(P>0.05)。结果表明,鹿尾中激素含量受生物学时期和性别影响较大。不同性别间比较,公鹿尾雄激素含量较高,此外还含有孕激素、皮质醇和少量雌激素,母鹿尾检出微量雄激素,其他激素含量均显著高于公鹿尾。不同时期间比较,发情期激素含量均显著升高,激素总量达到生茸期3倍左右。
表5 不同采收时期和性别的鹿尾中激素含量(±,n=5)Table 5 Hormone content of deer tail in different periods and genders(±s,n=5) ng/g
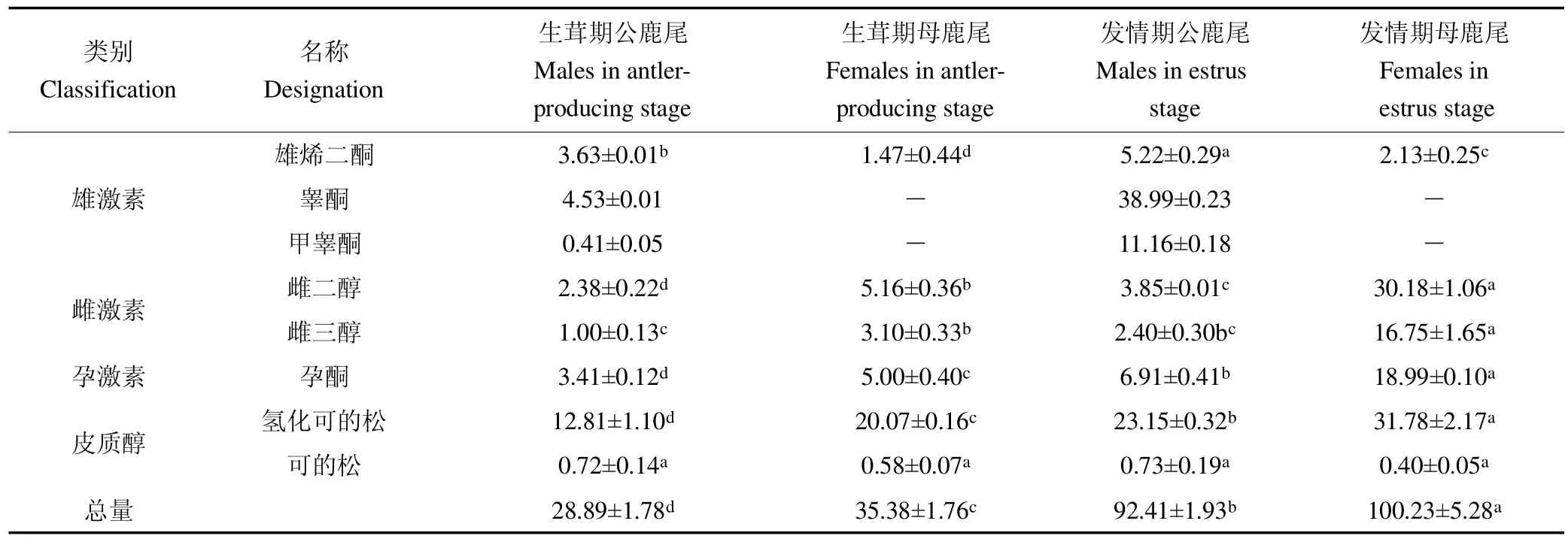
表5 不同采收时期和性别的鹿尾中激素含量(±,n=5)Table 5 Hormone content of deer tail in different periods and genders(±s,n=5) ng/g
类别Classification名称Designation生茸期公鹿尾Males in antlerproducing stage生茸期母鹿尾Females in antlerproducing stage发情期公鹿尾Males in estrus stage发情期母鹿尾Females in estrus stage雄激素雄烯二酮 3.63±0.01b 1.47±0.44d 5.22±0.29a 2.13±0.25c睾酮 4.53±0.01 — 38.99±0.23 —甲睾酮 0.41±0.05 — 11.16±0.18 —雌激素 雌二醇 2.38±0.22d 5.16±0.36b 3.85±0.01c 30.18±1.06a雌三醇 1.00±0.13c 3.10±0.33b 2.40±0.30bc 16.75±1.65a孕激素 孕酮 3.41±0.12d 5.00±0.40c 6.91±0.41b 18.99±0.10a皮质醇 氢化可的松 12.81±1.10d 20.07±0.16c 23.15±0.32b 31.78±2.17a可的松 0.72±0.14a 0.58±0.07a 0.73±0.19a 0.40±0.05a总量 28.89±1.78d 35.38±1.76c 92.41±1.93b 100.23±5.28a
2.5 无机元素含量对比分析
不同采收时期和性别的鹿尾中24种无机元素含量见表6。元素总量为发情期母鹿尾(36.11 g/kg)>发情期公鹿尾(34.19 g/kg)>生茸期母鹿尾(31.15 g/kg)和生茸期公鹿尾(29.65 g/kg),组间差异具有统计学意义。比较4组鹿尾中各元素含量,生茸期公鹿尾中K含量、发情期公鹿尾中Cu、Mo含量显著低于其他3组鹿尾,其他3组间无显著差异。发情期母鹿尾中Mg及Ba含量、生茸期母鹿尾中Cr及Ni含量和发情期公鹿尾中Fe含量显著较高,其他3组间无显著差异。Ca、Sr、V 3种元素均以发情期母鹿尾含量最高,分别为16.60 g/kg、19.62 mg/kg和9.60 mg/kg,显著高于同期公鹿尾(P<0.05),极显著高于生茸期鹿尾(P<0.01),生茸期不同性别间无显著差异。4组鹿尾中Na含量为发情期母鹿尾(3.71 g/kg)>发情期公鹿尾(3.04 g/kg)>生茸期母鹿尾(2.75 g/kg)>生茸期公鹿尾(2.13 g/kg),S含量则呈相反的趋势。4组鹿尾均检出极微量Pb,生茸期含量高于发情期(P<0.05),不同性别间无显著差异。不同采收时期和性别间Al、Zn、Mn、Ti和Cd含量均无显著差异。4组样品均未检出Se、Ag、Hg和As,生茸期公鹿尾未检出Cd,各组Pb、Cd含量分别在0.5 mg/kg和0.2 mg/kg左右,低于药典限量值(Pb:5 mg/kg,Cd:1 mg/kg)。
表6 不同采收时期和性别的鹿尾中无机元素含量(±,n=5)Table 6 Contents of inorganic elements of deer tail in different periods and genders(±s,n=5)
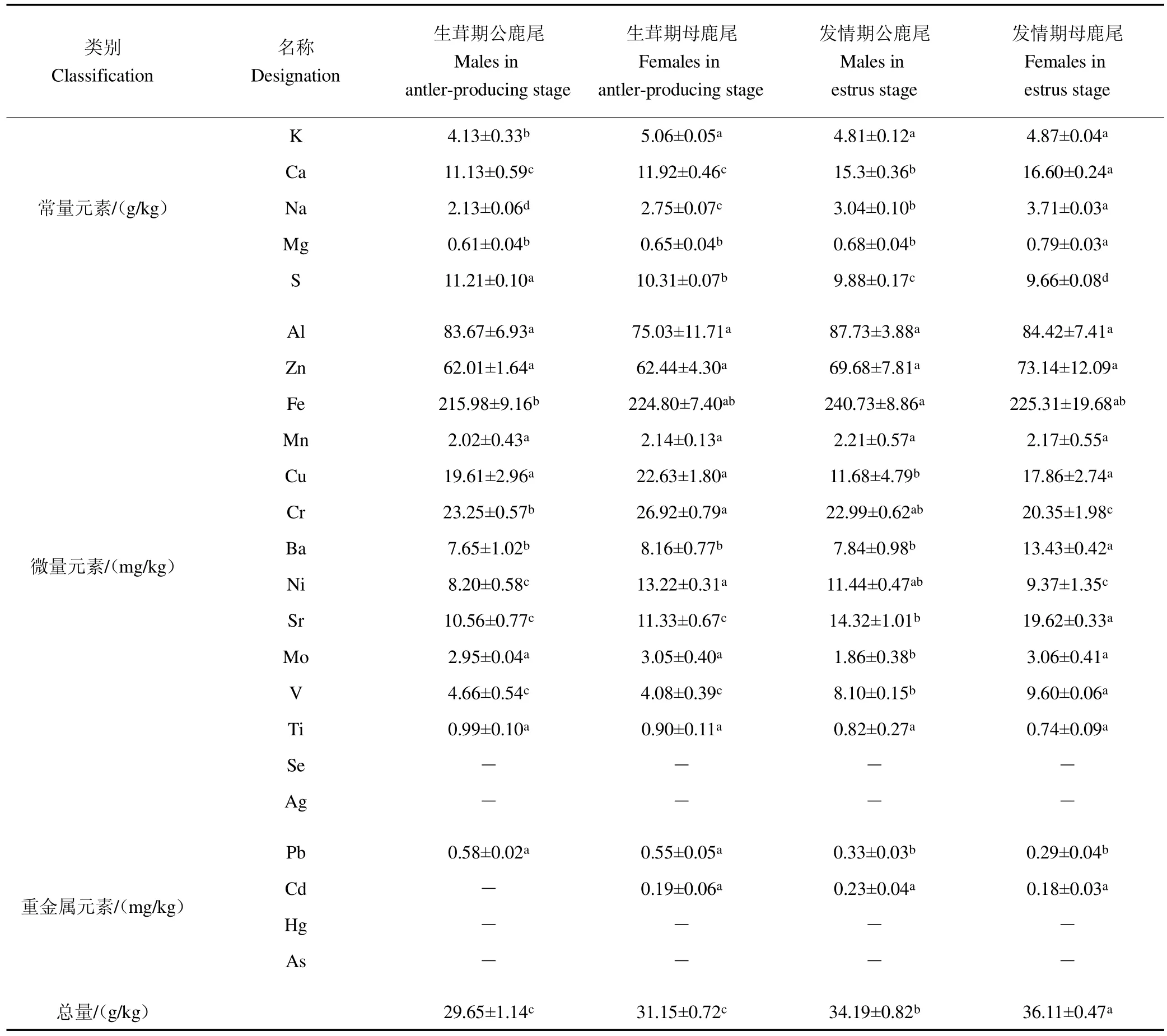
表6 不同采收时期和性别的鹿尾中无机元素含量(±,n=5)Table 6 Contents of inorganic elements of deer tail in different periods and genders(±s,n=5)
类别Classification名称Designation生茸期公鹿尾Males in antler-producing stage生茸期母鹿尾Females in antler-producing stage发情期公鹿尾Males in estrus stage发情期母鹿尾Females in estrus stage常量元素/(g/kg)K 4.13±0.33b 5.06±0.05a 4.81±0.12a 4.87±0.04a Ca 11.13±0.59c 11.92±0.46c 15.3±0.36b 16.60±0.24a Na 2.13±0.06d 2.75±0.07c 3.04±0.10b 3.71±0.03a Mg 0.61±0.04b 0.65±0.04b 0.68±0.04b 0.79±0.03a S 11.21±0.10a 10.31±0.07b 9.88±0.17c 9.66±0.08d微量元素/(mg/kg)Al 83.67±6.93a 75.03±11.71a 87.73±3.88a 84.42±7.41a Zn 62.01±1.64a 62.44±4.30a 69.68±7.81a 73.14±12.09a Fe 215.98±9.16b 224.80±7.40ab 240.73±8.86a 225.31±19.68ab Mn 2.02±0.43a 2.14±0.13a 2.21±0.57a 2.17±0.55a Cu 19.61±2.96a 22.63±1.80a 11.68±4.79b 17.86±2.74a Cr 23.25±0.57b 26.92±0.79a 22.99±0.62ab 20.35±1.98c Ba 7.65±1.02b 8.16±0.77b 7.84±0.98b 13.43±0.42a Ni 8.20±0.58c 13.22±0.31a 11.44±0.47ab 9.37±1.35c Sr 10.56±0.77c 11.33±0.67c 14.32±1.01b 19.62±0.33a Mo 2.95±0.04a 3.05±0.40a 1.86±0.38b 3.06±0.41a V 4.66±0.54c 4.08±0.39c 8.10±0.15b 9.60±0.06a Ti 0.99±0.10a 0.90±0.11a 0.82±0.27a 0.74±0.09a Se——Ag——重金属元素/(mg/kg)Pb 0.58±0.02a 0.55±0.05a 0.33±0.03b 0.29±0.04b Cd — 0.19±0.06a 0.23±0.04a 0.18±0.03a Hg——As——总量/(g/kg) 29.65±1.14c 31.15±0.72c 34.19±0.82b 36.11±0.47a
2.6 多糖含量对比分析
由表7可知,发情期母鹿尾中多糖含量最低,为2.93 g/kg,显著低于生茸期公鹿尾(4.93 g/kg)、生茸期母鹿尾(4.83 g/kg)和发情期公鹿尾(5.61 g/kg)。推测发情期母鹿尾多糖含量显著下降可能是母鹿在发情时食欲减弱、性欲增强且在此期间气温较低,体内能量消耗过度导致。
表7 不同采收时期和性别的鹿尾中多糖含量(±,n=5)Table 7 Polysaccharide content of deer tail in different periods and genders(±s,n=5) g/kg

表7 不同采收时期和性别的鹿尾中多糖含量(±,n=5)Table 7 Polysaccharide content of deer tail in different periods and genders(±s,n=5) g/kg
样品Sample多糖含量Polysaccharide content生茸期公鹿尾 4.93±0.60a生茸期母鹿尾 4.83±0.74a发情期公鹿尾 5.61±0.15a发情期母鹿尾 2.93±0.49b
3 讨论
本研究首次系统地测定了不同采收时期、不同性别的梅花鹿尾7类化学成分的组分及含量。结果表明,发情期鹿尾中粗蛋白、激素和无机元素含量以及不饱和脂肪酸比重较高;生茸期鹿尾中脂肪酸含量和必需氨基酸比重较高;核苷、水解氨基酸和多糖含量不同时期间无显著差异。母鹿尾中粗蛋白和激素含量较高;公鹿尾中多糖、脂肪酸含量及不饱和脂肪酸比重较高;核苷、水解氨基酸和无机元素含量以及必需氨基酸比重不同性别间无显著差异。
公鹿在不同生物学时期处于不同的生理状态,每年的4~9月主要经历鹿角盘脱落、伤口愈合、鹿茸形成和生长、锯茸后大面积创口恢复、形成再生茸、再愈合和骨化等剧烈生理过程,每年10月至次年3月进入发情、求偶、配种的繁殖阶段[14],因此,目前较多的饲养者为提高鹿经济效益,满足不同生理活动对营养的需求,进行鹿的科学饲养管理。李淑杰等[15]提出,每年的8月和3月,应按鹿的性别、种别、生产性能、年龄、体况和种用性能进行严格分群管理。越冬期应确保蛋白质类饲料占日粮的15%~20%,幼鹿和头、二锯鹿或后备母鹿、8锯以上的花公鹿和13锯以上的公鹿应达到40%左右。在保证越冬期有良好膘情的情况下,应在常年同龄脱盘期前40 d就明显增加日粮量及其营养水平,以达到鹿茸增产的目的。鹿茸生长后期和母鹿妊娠后期,饲料中矿物质磷酸钙的含量或骨粉、蛎粉、石粉及蛋壳粉的量应明显增加,妊娠母鹿为减少难产不宜过肥,故应控制能量摄入过多。研究表明,不同时期鹿体内的生化指标具有显著差异。史鸿鹏等[14]的研究表明,发情期公鹿体内胆固醇、蛋白质、葡萄糖和乳酸脱氢酶水平显著高于生茸期;曹荣峰等[16]的研究表明,生茸期梅花鹿血中卵磷脂、尿嘧啶和次黄嘌呤等抗衰老相关成分含量高于配种期;马泽芳等[7]的研究表明,生茸期梅花鹿血中SOD水平显著高于配种期;邹晨等[17]的研究表明,不同生长阶段公鹿血液中蛋白、酶及无机盐差异极显著;哺乳期公、母鹿红细胞系统指标、血糖及肌酸激酶具有显著性差异;红细胞压积、红细胞平均体积、平均血红蛋白含量、平均血红蛋白浓度、碱性磷酸酶和乳酸脱氢酶在不同性别的育成鹿与成年鹿中差异极显著。综上所述,不同的营养供给、鹿自身进行不同的生理活动均影响鹿体内营养物质和能量的变化。生茸期公鹿消耗大量蛋白质、无机盐等营养物质,能量向茸生长调配,此阶段尾部瘦弱,营养较低,而发情期无产茸消耗,能量蓄积使营养成分回升,此阶段尾部发出求偶、性交等重要的生物学信号,尾部较为发达肥厚,尾腺分泌大量皮质醇类激素。因此,发情期鹿尾中粗蛋白、激素和无机元素含量显著高于生茸期。母鹿无产茸消耗蛋白和无机盐,为保证妊娠会增加二者供应量、减少脂肪摄入,且被证实母鹿妊娠后期和哺乳期尾腺分泌物含量最高[10]。因此,母鹿尾中粗蛋白、激素和无机元素含量较高,脂肪酸和多糖含量较低。
