山羊EGR4、KDM4C和KDM6A多态性及其与繁殖性能关联分析
2023-02-17李昆谕刘玉芳陶林江炎庭欧阳依娜储明星
李昆谕,刘玉芳,陶林,江炎庭,欧阳依娜,储明星※,※
(1.云南省畜牧兽医科学院,云南 昆明 650224;2.河北工程大学生命科学与食品工程学院,河北 邯郸 056001;3.中国农业科学院北京畜牧兽医研究所,农业农村部动物遗传育种与繁殖重点实验室,北京 100193)
对于山羊(Capra hircus)的生产来说,产羔数是一个极为重要的经济性状,但现如今世界上大部分山羊品种产羔数量不均一,仅有少数拥有一胎多羔的优良繁殖特性[1,2]。因此,提高山羊的产羔数能够有效提高山羊养殖的效益并促进山羊产业的发展。目前关于山羊育种改良的研究主要集中于繁殖性状的重要候选基因上,选择这些基因的有利等位基因可能有助于高产育种群体的建立,对山羊的选育工作有持续深远的影响。
早期生长反应4(early growth response 4,EGR4)属于早期生长反应家族(EGR),该蛋白家族由EGR1、EGR2、EGR3和EGR4 4种密切相关的蛋白组成。这4种EGR蛋白都具有一个高度保守的DNA结合域,与基因启动子区域内的一个9 bp的反应元件结合,以促进转录激活[3]。EGR4基因定位于山羊11号染色体,拥有2个外显子。赖氨酸脱甲基酶4C(lysine demethylase 4C,KDM4C)和赖氨酸脱甲基酶6A(lysine demethylase 6A,KDM6A)分别定位于山羊的8号和X号染色体,分别拥有24个和31个外显子。KDM4C和KDM6A均属于组蛋白赖氨酸去甲基化酶(KDM)家族。目前研究表明,部分KDM家族成员参与体细胞、生殖细胞和胚胎细胞H3K4甲基化水平的调节,包括KDM1(例如KDM1A和KDM1B)和KDM5(例如KDM5A、KDM5B和KDM5C)家族成员[4-7]。有研究人员发现KDM1A可以调节精子发生并影响跨代遗传[8],而KDM5B能调节早期胚胎发育和存活[4,6]。综上所述,EGR4、KDM4C和KDM6A可能与山羊的繁殖有一定关系。
本研究利用实验室前期对云上黑山羊(云上黑山羊是以云岭山羊为母本、努比山羊为父本培育而成的我国第一个肉用黑山羊品种[9,10])的重测序结果,通过GWAS分析筛选出全基因组中的正选择基因(positively selected genes,PSG)EGR4、KDM4C和KDM6A,结合文献资料,推测EGR4、KDM4C和KDM6A可能对山羊繁殖性能有一定的影响。在前期数据结果中筛选出与产羔数相关的8个SNPs位点,分别为EGR4 g.11028295G>A、g.11029053G>T和g.11029600T>A位点;KDM4C g.37764228T>A、g.37767773T>A和g.37768026C>G位点;KDM6A g.27102554T>A和g.27177505C>A位点。采用MassARRAY®SNP分型技术,在云上黑山羊、济宁青山羊和辽宁绒山羊3个山羊群体中对候选基因的基因型进行检测,分析其多态性与山羊繁殖性能之间的关联性,以期为山羊的高繁殖力分子标记辅助选择育种提供更多参考。
1 材料与方法
1.1 实验样品
实验采用3个山羊品种共计768只(2~5岁),其中云上黑山羊544只、济宁青山羊133只、辽宁绒山羊91只。本实验中济宁青山羊和辽宁绒山羊为对照群体,其中将济宁青山羊视为高繁殖力群体(均为经产母羊,产羔数3.00±0.38),辽宁绒山羊视为低繁殖力群体(均为经产母羊,产羔数1.02±0.19),见表1。所有试验用山羊饲养条件一致,云上黑山羊拥有至少1胎产羔数记录,部分拥有初生窝重和断奶窝重(3月龄)记录,所有羊均采用颈静脉采血(10 mL/只),使用EDTA-K2抗凝,20℃保存。

表1 被测山羊品种及个体数量信息Table 1 The information on the breeds of goats tested and the number of individuals
1.2 血液DNA的提取
试验样本使用酚氯仿法提取基因组DNA,采用Nano Drop2000检测DNA样本浓度,1.5%琼脂糖凝胶电泳检测DNA质量。
1.3 基因分型
采用Sequenom MassARRAY®SNP分型技术对EGR4、KDM4C和KDM6A基因共计8个突变位点进行检测,相关引物信息见表2,分型样品为DNA,每个样品需要量为20L,DNA浓度为40~80 ng/L。

表2 引物序列Table 2 Primer sequences
1.4 统计分析
应用Microsoft Excel 2020软件统计山羊EGR4、KDM4C和KDM6A突变位点的基因型频率、等位基因频率、多态信息含量(PIC)、杂合度(He)和有效等位基因数(Ne),并进行Hardy-Weinberg平衡检验。采用IBM SPSS Statistics 25软件中的一般线性模型,多重比较采用LSD法,对山羊基因型与产羔表型数据进行关联分析,所有数据以平均值±标准误表示(**P<0.01;*P<0.05)。
2 结果与分析
2.1 EGR4多态性分析
利用Sequenom MassARRAY®SNP对768只山羊血液DNA进行基因分型。结果显示,EGR4 3个SNPs位点在云上黑山羊、济宁青山羊和辽宁绒山羊中存在多态性,其中g.11028295G>A位点基因型为GG、GA、AA,g.11029053G>T位点基因型为GG、GT、TT,g.11029600T>A位点基因型为AA、TA和TT(图1)。

图1 EGR4位点分型结果Fig.1 The results of EGR4 gene locus typing
统计济宁青山羊(高繁)和辽宁绒山羊(低繁)山羊品种中EGR4 3个SNPs位点的基因型频率和等位基因频率(表3),EGR4g.11028295G>A和g.11029600T>A位点的基因型频率和等位基因频率在高繁和低繁山羊群体间差异均达到显著水平(P<0.05),g.11028295G>A和g.11029053G>T位点在高繁群体和低繁群体的优势基因型均为GG,优势等位基因为G;g.11029600T>A位点在高繁群体和低繁群体的优势基因型为TT,优势等位基因为T。
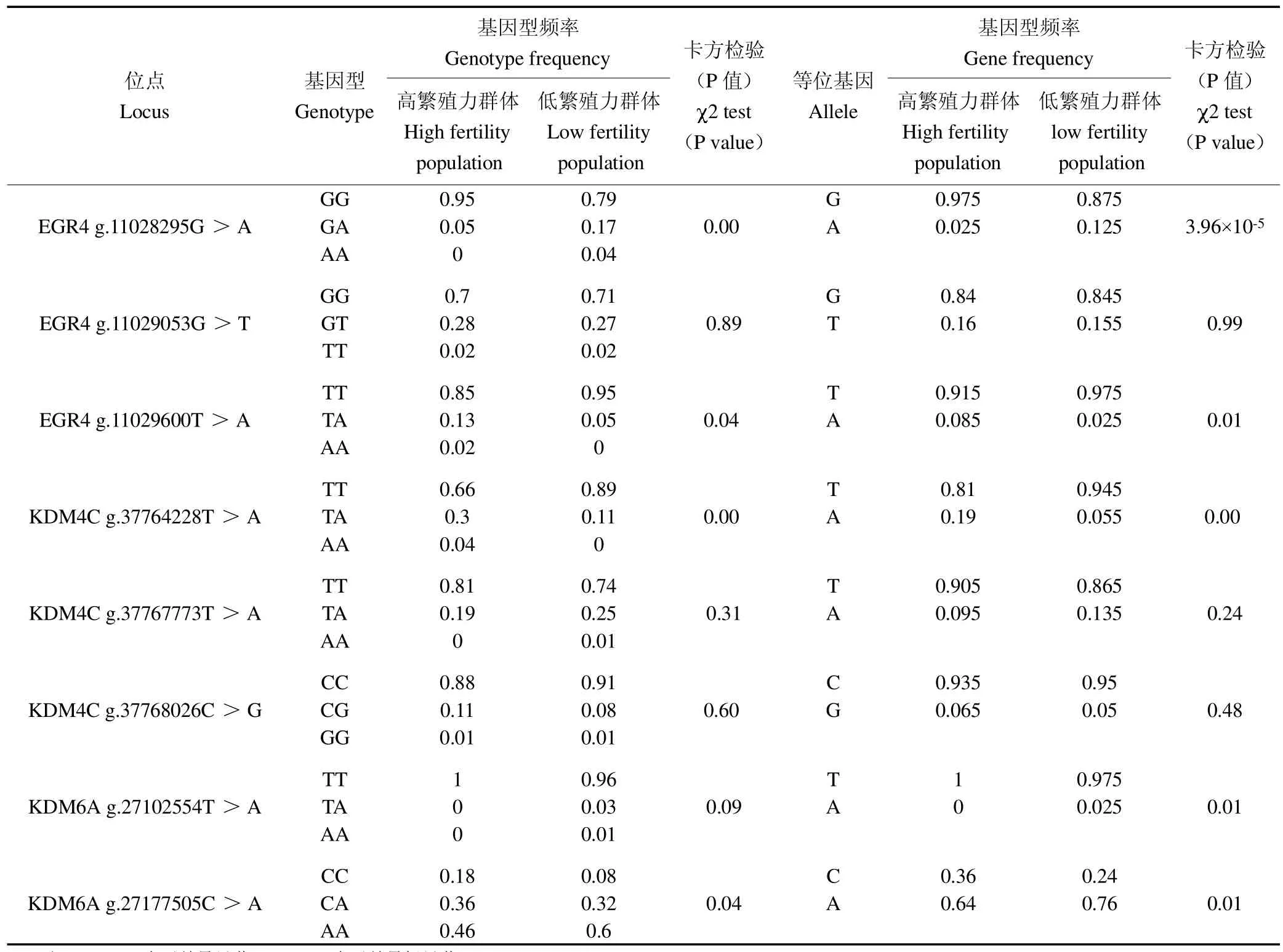
表3 EGR4、KDM4C和KDM6A 8个多态位点在高繁、低繁山羊品种中的基因型和等位基因频率Table 3 Genotype and allele frequencies of 8 polymorphic loci of EGR4,KDM4C and KDM6A in high-and low-reproduction goat breeds
群体遗传学统计表明,EGR4 g.11029053G>T和g.11029600T>A位点在云上黑山羊中为中度多态(0.25<PIC<0.5),在济宁青山羊和辽宁绒山羊中为低度多态(PIC<0.25),g.11028295G>A位点在3个山羊群体中为低度多态(PIC<0.25)。卡方适应性检验结果表明,EGR4基因3个SNPs位点在云上黑山羊、济宁青山羊和辽宁绒山羊中均处于Hardy-Weinberg平衡状态(P>0.05),见表4。
2.2 KDM4C和KDM6A基因多态性分析
基因分型结果表明(图2,3),KDM4C和KDM6A5个SNPs位点在3个山羊群体中均存在多态性。KDM4C和KDM6A 5个SNPs位点在云上黑山羊、济宁青山羊和辽宁绒山羊中存在3种基因型。
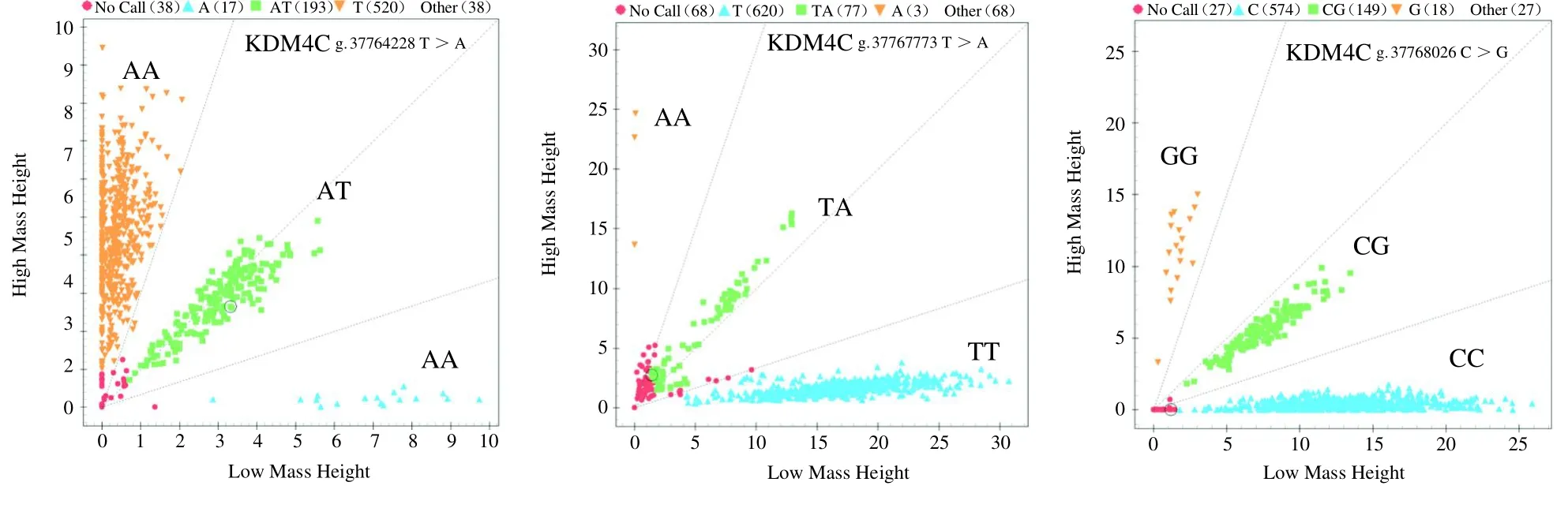
图2 KDM4C位点分型结果Fig.2 The results of KDM4C locus typing
如表3所示,KDM4C g.37764228T>A、KDM6A g.27177505C>A位点的基因型频率和等位基因频率在高繁和低繁山羊群体间差异均达到显著水平(P<0.05),但KDM4C g.37767773T>A和g.37768026C>G位点的基因型频率和等位基因频率在高繁和低繁山羊群体间差异不显著(P>0.05)。其中KDM4C g.37764228T>A、g.37767773T>A和KDM6A g.27102554T>A位点在高繁和低繁山羊群体中的优势基因型为TT,优势等位基因均为T;KDM4C g.37768026C>G位点在高繁和低繁山羊群体中的优势基因型为CC,优势等位基因为C;KDM6A g.27177505C>A位点在高繁和低繁山羊群体中的优势基因型为AA,优势等位基因为A。
群体遗传学统计表明,KDM4C g.37764228T>A位点在济宁青山羊中为中度多态(0.25<PIC<0.5),在辽宁绒山羊和云上黑山羊中为低度多态(PIC<0.25),KDM4C g.37767773T>A和g.37768026C>G位点在3个山羊群体中为低度多态(PIC<0.25);KDM6A g.27177505C>A在济宁青山羊和辽宁绒山羊中为中度多态(0.25<PIC<0.5),在云上黑山羊中为低度多态(PIC<0.25)。卡方适应性检验结果表明,KDM4C g.37764228T>A、g.37767773T>A和g.37768026C>G在3个山羊群体中均处于Hardy-Weinberg平衡状态(P>0.05);KDM6A g.27102554T>A和g.27177505C>A位点分别在辽宁绒山羊中和济宁青山羊中处于Hardy-Weinberg不平衡状态(P<0.05),在云上黑山羊中处于Hardy-Weinberg平衡状态(P>0.05),见表4。
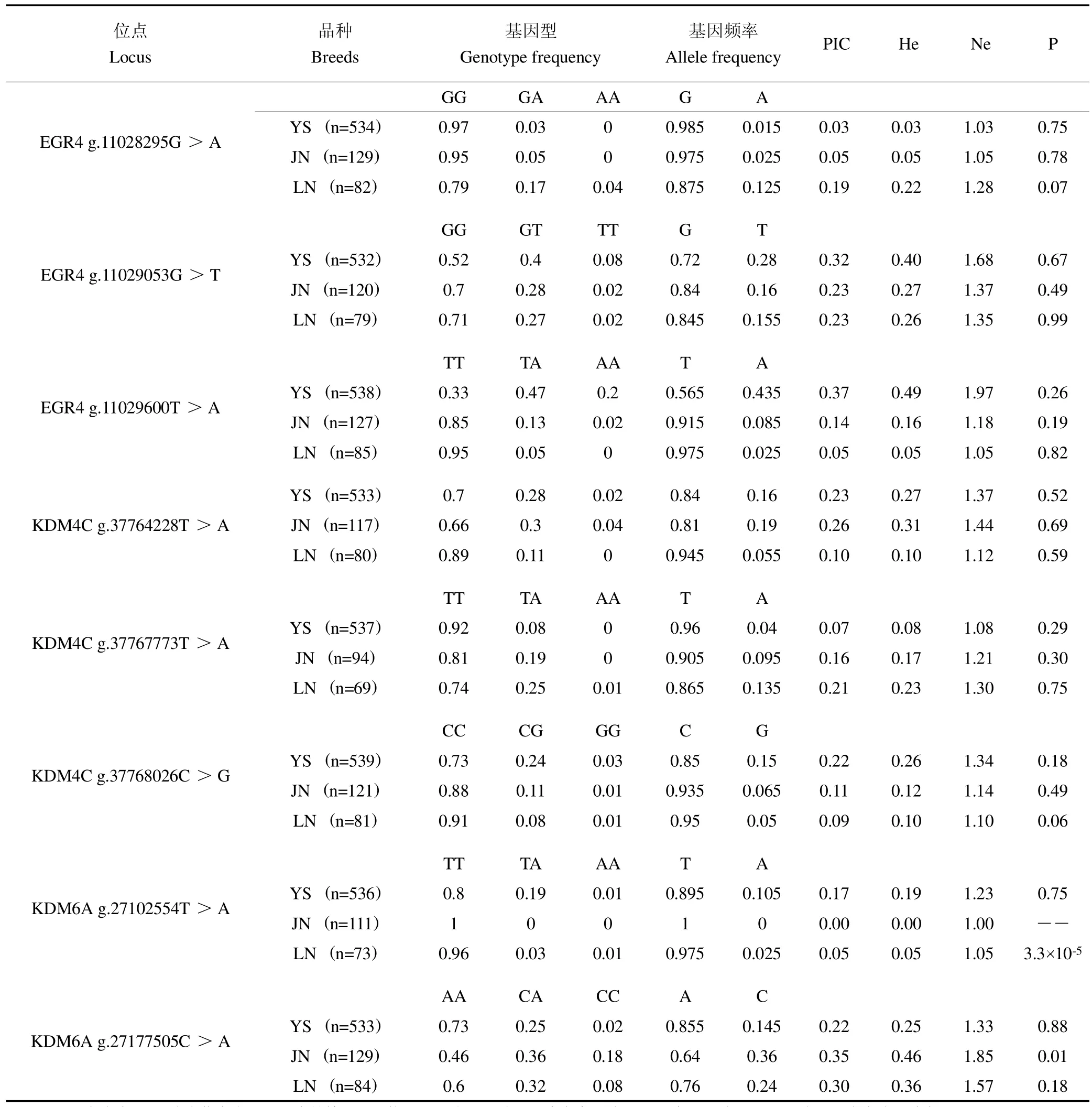
表4 EGR4、KDM4C和KDM6A 8个多态位点在不同山羊品种中的群体遗传学分析Table 4 The population genetic analysis of 8 polymorphic loci of EGR4,KDM4C and KDM6A in different goat breeds

图3 KDM6A位点分型结果Fig.3 The results of KDM6A locus typing
2.3 候选SNPs位点与云上黑山羊繁殖性能的关联分析
EGR4 g.11029600T>A位点TT型的初生窝重和断奶窝重显著高于AA型(P<0.05)。KDM4C g.37764228T>A位点TT和TA型的产羔数、初生窝重和断奶窝重显著高于AA型(P<0.05)。KDM6A g.27177505C>A位点CC型产羔数显著高于CA型和AA型(P<0.05);KDM6A g.27102554T>A位点TT型的初生窝重和断奶窝重显著高于AA型(P<0.05)。其余SNPs位点多态性与云上黑山羊产羔数、初生窝重和断奶窝重无显著相关(P>0.05),见表5。
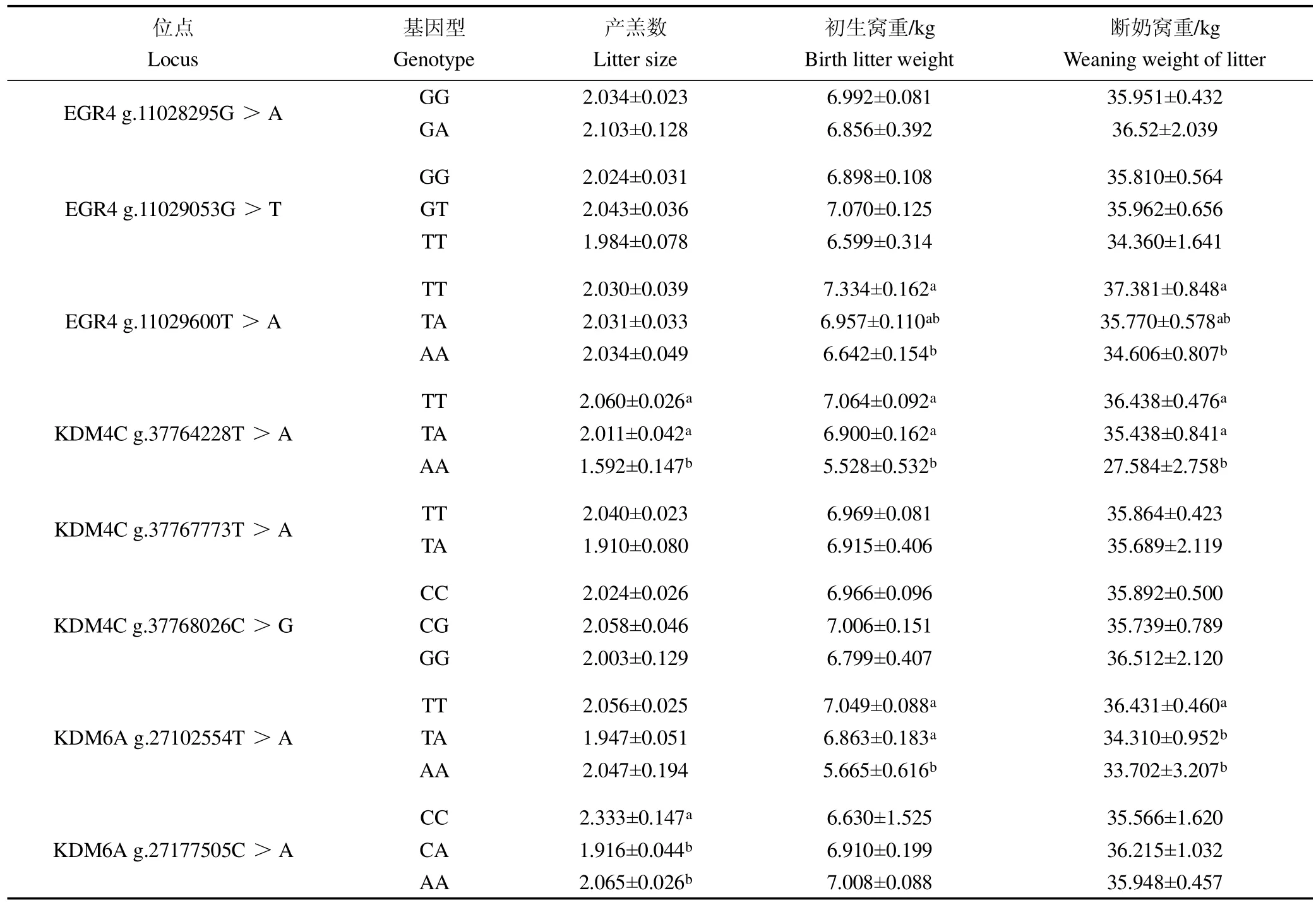
表5 EGR4、KDM4C和KDM6A对云上黑山羊产羔性能的影响(平均数±标准误)Table 5 The influence of EGR4,KDM4C and KDM6A on the reproduction performance of Yun shang black goats(mean±standard error)
3 讨论
3.1 EGR4与生殖性状的关系
EGR4最初发现于中枢神经系统,但是EGR家族的其他成员在中枢神经系统外也存在着广泛的表达[11]。有研究表明,EGR4的缺失会导致小鼠生殖细胞发育的不成熟,进而导致雄性小鼠的不育[12]。在Sertoli细胞中,EGR4对于Sertoli细胞的分裂有一定调控作用,进而调节精子的发生,EGR4也可在管周肌样细胞和其他一些生殖细胞中发挥作用[13]。此外,有研究表明EGR4在人类的不孕症中也发挥了一定的作用[14]。我们的研究表明在云上黑山羊中EGR4g.11029600T>A位点TT型个体的初生窝重和断奶窝重显著高于TA和AA型个体。因此,我们推测EGR4g.11029600T>A位点的突变可能影响了羔羊初生体重,并在初生羔羊的初期发育中起到了一定的作用。EGR4 g.11029600T>A位点或可作为云上黑山羊初生窝重和断奶窝重选择的一个潜在分子标记。
3.2 KDM4C和KDM6A与生殖性状的关系
有研究表明,KDM6A可以影响配子体的发育,对动物繁殖至关重要,在啮齿动物中,敲除KDM6A后破坏了原始生殖细胞的发育[15]。在雌性小鼠中,包含生殖相关同源框基因的Rhox基因簇也受KDM6A调控[16]。此外,KDM6A还可以调控小鼠卵母细胞的成熟[17]。我们的研究表明,KDM4C g.37764228T>A位点TT和TA型个体的产羔数、初生窝重和断奶窝重显著高于AA型个体,KDM6A g.27177505C>A位点CC型个体产羔数显著高于CA型和AA型个体。这些结果都表明KDM4C和KDM6A的多态性对于云上黑山羊母羊的繁殖性能是有一定的影响的。KDM4C g.37764228T>A可作为云上黑山羊产羔数、初生窝重和断奶窝重选择的一个潜在分子标记。KDM6A g.27177505C>A可作为云上黑山羊产羔数选择的一个潜在分子标记。此外,KDM6A g.27102554T>A位点的多态性与云上黑山羊的初生窝重和断奶窝重显著相关。总体而言,KDM4C和KDM6A在调控山羊繁殖性能方面有一定的作用。
4 结论
本研究表明,EGR4 g.11029600T>A、KDM4C g.37764228T>A和KDM6A g.27102554T>A位点与云上黑山羊初生窝重和断奶窝重存在显著关联,可作为云上黑山羊窝重选择的潜在分子标记。KDM4C g.37764228T>A和KDM6A g.27177505C>A位点与云上黑山羊产羔数存在显著关联,可作为云上黑山羊产羔数选择的潜在分子标记。
