云南安宁酱菜中的细菌多样性和致病菌组成分析
2023-02-17杨振光刘秉珍曹建新李莉蓉
杨振光,刘秉珍,曹建新,李莉蓉
(昆明理工大学食品科学与工程学院 昆明 650500)
酱菜历史悠久,是一种经盐腌、微生物发酵和酱渍而成的特色加工品[1]。 酱菜采用开放式生产,利用附着在原料表面上的乳酸菌发酵形成了其独特的风味[2-3]。由于酱菜特殊的制作方式,使其最终形成了复杂的细菌群落结构[4]。 研究表明,乳酸菌发酵产生的乳酸、 醇和酯等物质是酱菜的主要风味来源[5-7]。葛菁萍等[8]在黄豆酱中检测到嗜盐片球菌(Pediococcus halophilus)、 酱油片球菌(Pediococcus sojae) 和酱油四联球菌(Tetragenococcus sojae)等乳酸菌。 辛星等[9]从黑龙江酱菜中分离得到乳酸片球菌(Pediococcus acidilactici)等7 株乳酸菌。 除乳酸菌外,在酱菜的制作、运输和销售环节中可能带入食源性致病菌在内的各种污染微生物[10],轻则造成酱菜中营养成分的流失和风味发生变化等不良影响,重则导致食源性疾病的发生,不仅对食品本身的安全性、营养价值等产生影响,而且对人体健康造成不同程度的危害[11-12]。
近年来,高通量测序技术 (High-throughput sequencing)飞速发展,代替了传统微生物分析所采用的分离培养方法,检测过程可一次性对样品中的几十万到几百万条DNA 分子进行序列测定,较传统的分离、纯化、鉴定方法,可快速确定其中微生物的种类和丰度,不仅可以检测到普通的可培养物种,而且能全面反映样品的菌群结构[13-14]。目前高通量测序已被广泛应用于分析各种环境中的微生物群落结构。
本研究以云南省安宁市的9 种酱菜样品为研究对象,采用高通量测序技术对其细菌多样性进行解析,并通过传统分离培养方法分析酱菜中的食源性致病菌组成,探究样品可能存在的食源性致病菌污染情况,为后续云南特色酱菜的微生物多样性研究和制作方法的改良提供一定的数据参考。
1 材料与方法
1.1 材料与试剂
细菌基因组DNA 提取试剂盒 (DP1301),北京百泰克生物技术有限公司。
食源性致病菌选择培养基: 沙门氏菌显色培养基、李斯特菌显色培养基、O157 显色培养基、蜡样芽孢杆菌显色培养基、坂崎肠杆菌显色培养基、金黄色葡萄球菌显色培养基、孤菌显色培养基、志贺氏菌显色培养基、弯曲菌显色培养基,上海欣中生物工程有限公司。
1.2 仪器与设备
XR+PCR 仪,美国BIO-RAD 公司;凝胶成像分析系统,美国BIO-RAD 公司;水平电泳仪,北京市六一仪器厂;LDZX-40AI 型立式电热压力灭菌锅,上海申安医疗器械厂;TGL-16aR 高速冷冻离心机,上海安亭科学仪器厂;YJ-875 型医用超净工作台,吴江市生化净化设备厂。
1.3 样品处理
从云南省昆明市安宁市农贸市场的3 个摊位采集到9 种酱菜样品。 从摊位1 采集到的样品分别为豆瓣酱1、黄豆酱和辣椒酱,从摊位2 采集到的样品为豆瓣酱2、麻辣酱和香辣酱,从摊位3 采集到的样品为豆瓣酱C、藠头酱和麦芽酱。 将这9种酱菜分别进行编号(表1),置于-80 ℃冰箱储存。

表1 各种酱菜对应编号Table 1 Various pickles corresponding number
1.4 细菌基因组DNA 提取和PCR 扩增
参照DNA 提取试剂盒的方法提取样品细菌基因组DNA。 之后,利用1%琼脂糖凝胶电泳检测DNA 的纯度和浓度。 根据DNA 浓度,用无菌水稀释DNA 至1 ng/μL。
以提取的细菌基因组DNA 为聚合酶链式反应(PCR)模板,利用特异性引物515F-806R 进行16S rDNA 扩增。 PCR 产物使用2%琼脂糖凝胶电泳检测合格后,寄往北京诺禾致源科技股份有限公司,完成高通量测序,测序平台为Illumina NovaSeq6000。 PCR 反应体系如表2 所示。

表2 PCR 反应体系Table 2 PCR reaction system
反应程序:98 ℃预变性1 min;30 个循环包括(98 ℃,10 s;50 ℃,30 s;72 ℃,30 s);72 ℃,5 min。
1.5 数据处理及分析
通过Illumina NovaSeq 测序平台得到原始数据(Raw Data),对其进行拼接、过滤,得到有效数据(Clean Data)。 有效数据以97%的一致性进行OTUs(Operational Taxonomic Units)聚类和物种分类分析。 根据OTUs 聚类结果,一方面对每个OTU 的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况。 同时,对OTUs 进行丰度、Alpha 多样性计算,Venn 图和花瓣图等分析,以得到样本内物种丰富度和均匀度信息,不同样本或分组间的共有和特有OTUs 信息等。
1.6 食源性致病菌的分离培养与鉴定
将采集到的酱菜样品进行10 倍梯度稀释后,吸取200 μL 样品稀释液涂布不同的选择培养基,置于33 ℃培养箱培养48 h 后观察菌落形态。
挑取平板中的代表性菌落由上海捷瑞生物工程有限公司完成16S rDNA 序列扩增、测序,利用NCBI(美国国家生物技信息中心)数据库进行比对分析。
2 结果与分析
2.1 酱菜细菌多样性分析
2.1.1 测序数据及稀释曲线分析 9 种酱菜样品的稀释曲线如图1 所示。随着测序数据量的增加,各组样品稀释曲线逐渐上升并趋于平坦,说明测序数据量增加,OUT 数量不再增加,测序数量足够覆盖样品中绝大多数微生物信息。
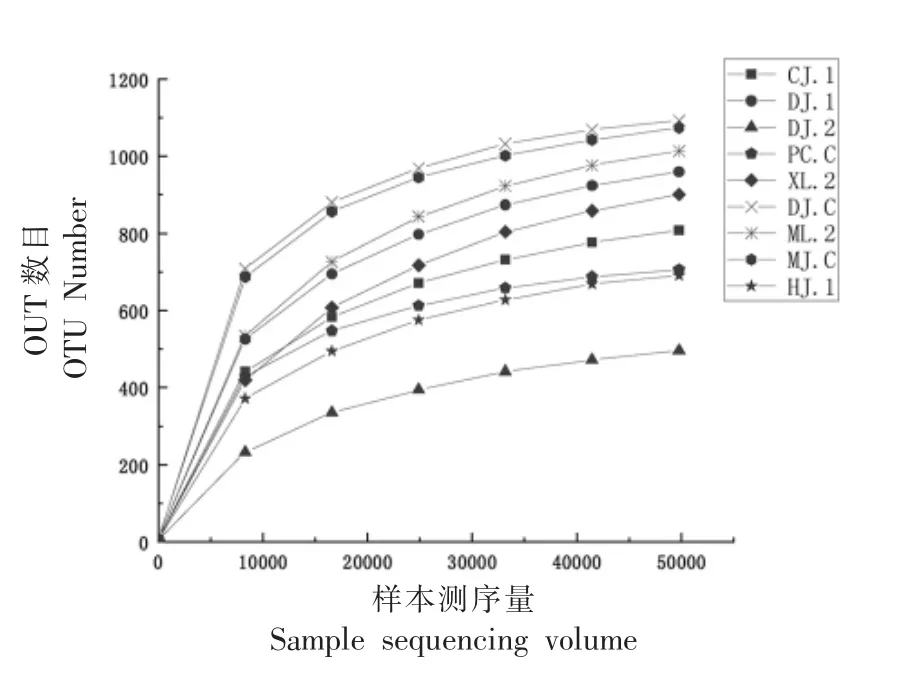
图1 细菌16S rDNA 克隆文库稀释曲线Fig.1 Rarefaction analysis of bacteria 16S rDNA clone library
2.1.2 细菌群落OTU 分布 通过R 软件(Version 3.0.3,R package=VennDiagram) 绘制成花瓣图。酱菜样本中的细菌群落OTU 分布结果见图2。 9组酱菜样本共注释出OTUs 1 018 个OUT,共有35 个相同的OTU 样本,其中CJ.1 组产生54 个OUT,HJ.1 组产生34 个OTU,DJ.1 组产生63 个OUT。 XL.2 组产生44 个OTU,DJ.2 组产生139 个OTU,ML.2 组产生94 个OUT。PC.C 组产生117 个OTU,DJ.C 组产生121 个OTU,MJ.C 组产生107个OTU。 DJ.2 组所具有的特殊OUT 数量最多。
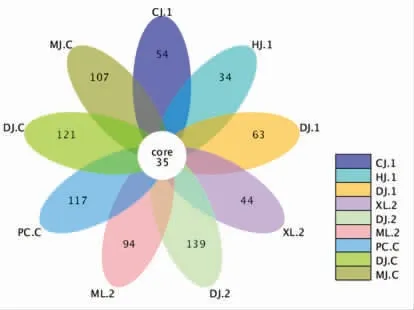
图2 样本OTU 分布花瓣图Fig.2 Flower diagram of sample OTUs distribution
2.1.3 多样性指数和菌落丰富度分析 α-多样性分析能够评价微生物群落的丰度和多样性。 通过6 个指数,包括Observed-species,Chao1,Shannon,Simpson,ACE,Good-coverage 等,对样本的物种多样性进行分析[16]。 酱菜样本的α-多样性分析结果见表3。Good-coverage 表示测序的深度,样品中coverage 覆盖率均达到99.5%~99.8%,这表明多样性测序结果既真实又准确。 根据多样性检测结果,Chao1 指数和Ace 指数代表菌群丰富度。 Chao1 指数越大,代表样品中菌群丰富度越高[15]。其中,MJ.C 的Chao1 指数最高,达1 259.244,其次是DJ.C 和ML.2,分别为1 158.106 和1 080.657。HJ.1 的Chao1 指数最低,仅742.136。 这表明MJ.C样品中的细菌菌群较多、丰富度较高,而相比较之下HJ.1 样品中的细菌菌落较少、丰富度较低。Ace指数代表估计群落中OTU 数目,DJ.1、ML.2 和DJ.C 的Ace 指数较高,分别为1085.260,1123.712和1 165.155,MJ.C 的Ace 指数最高,其指数为1 179.523,而DJ.2 的Ace 指数最低,为577.161。Shannon 指数和Simpson 指数表征群落内物种分布的多样性和均匀度[15]。Shannon 指数代表样品中的分数总数及其占比,Shannon 指数越大,群落多样性越高,物种分布越均匀。MJ.C 的Shannon 指数最高,为6.720,其次为DJ.C(6.212)、DJ.1(5.833)和ML.2(5.236)。同时,Simpson 指数最高的4 个酱菜样本分别是:MJ.C(0.952)、DJ.1(0.937)、ML.2(0.903)和CJ.1(0.903)。从细菌多样性指标可以得出结论:9 种酱菜样品中,MJ.C 样品具有最高的菌落丰富度且分布均匀。

表3 细菌生物多样性指标Table 3 Indicators of bacterial biodiversity
2.1.4 不同酱菜样本的微生物群落结构的差异比较 通过菌群丰度柱状图表示分组在门水平(图3)和属水平(图4)的菌落丰度。
由图3 可知,在门分类水平上,以相对丰度≥0.01%为阈值,将<0.01%的菌门归为others,按照相对丰度从高到低的排序依次为厚壁菌门(Firmicutes)、 变形菌门 (Proteobacteria)、 蓝藻菌门(Cyanobacteria)、类杆菌门(Bacteroidota)、放线菌门 (Actinobacteria)、 放线杆菌门(Actinobacteriota)、疣菌门 (verrucomicrobiota)、 脱硫菌(Desulfobacterota)和弯曲杆菌(Campilobacterota)。 其中优势菌门 (平均丰富大于1.00%) 分别为厚壁菌门、变形菌门、蓝藻菌门。 虽然关于云南酱菜细菌多样性的研究相对较少,既往研究表明中国其它传统发酵食品,如扎辣椒[16]和泡菜[17]中的细菌菌门组成与本研究结果相似。 对比不同酱菜样本的细菌门水平相对丰度,可以发现不同类型的酱菜产品,其菌门种类相似而相对丰度具有较大的差异。其中弯曲杆菌门在DJ.C 中丰度较高,脱铁杆菌门在MJ.C 中丰度较高。而在ML.2 和XL.2 中细菌菌种较少,微生物种类多样性相对较低,这说明不同的酱菜样本中细菌群落结构存在差异,且同一菌门在不同样本中的相对丰度差异较大。

图3 酱菜样品中细菌门水平分布图Fig.3 Horizontal distribution of bacterial in phylum level in pickles
如图4 所示,在属水平上,丰度≥0.1%的细菌属分别是乳酸杆菌属(Lactobacillus)、葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)、色盐杆菌 属(Chromohalobacter)、泛菌属(Pantoea)、克雷伯菌属(Klebsiella)、柠檬酸杆菌属(Citrobacter)、四链球菌属 (Tetragenococcus) 和伊格氏菌(Ignatzschineria)。 在不同的酱菜样本中,主要菌属的组成相似,优势细菌丰度差异较大。 其中,乳酸杆菌属和芽孢杆菌属在9 种酱菜样本中均有检出,高吉祥等[2]研究结果表明,酱菜发酵过程中乳酸菌能够产生乳酸等有机酸。同时,研究表明乳酸菌能够酶解蛋白质产生多种氨基酸,这一发酵过程中生成的有机酸和氨基酸是酱菜的主要风味来源之一[18]。 此外,乳酸菌在发酵过程中能促进风味组分(醛类、醇类、酯类等)的形成。 乳酸菌在酱菜发酵中提供了良好的风味和丰富的营养价值,是酱菜发酵中不可缺少的菌种[19]。 除乳酸杆菌属外,芽孢杆菌属微生物在9 种样本中也均有检出,其中在DJ.C 中芽孢杆菌的丰度占40.57%,是DJ.C 中的绝对优势菌种,这一点与成晓苑[20]的研究结果相吻合。 芽孢杆菌属可以产生各种水解酶,如蛋白酶、纤维素酶和淀粉酶,从而促进碳水化合物的液化和糖化。此外,在DJ.1、XL.2、DJ.2 和ML.2 中,均有葡萄球菌属微生物检出。 田媛等[20]和Iacumin等[21]的研究结果表明,葡萄球菌在发酵过程中能够降解脂肪和蛋白质,还可还原硝酸盐,促进风味形成,在发酵过程中属于有益菌。 除此之外,在摊位一采集到的CJ.1、HJ.1 和DJ.1 中都检出柠檬酸杆菌(Citrobacteri)和和克雷伯菌(Klebsiella),在摊位二采集到的XL.2、DJ.2 和ML.2 中均检出柠檬酸杆菌(Citrobacteri),在DJ.2 和ML.2 中检出克雷伯菌(Klebsiella)。柠檬酸杆菌(Citrobacteri)和克雷伯菌(Klebsiella)都属于致病菌群[22-23],这一检测结果说明摊位一和摊位二酱菜在制作、 运输和销售过程中可能存在微生物污染,也进一步说明这2个摊位其生产制造的环境卫生条件较差。
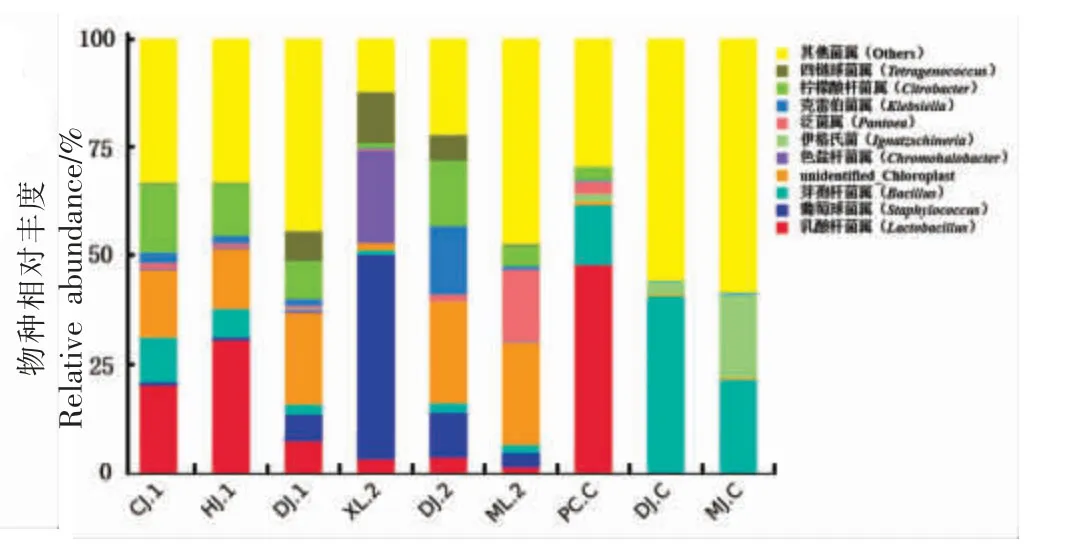
图4 酱菜样品中细菌属水平分布图Fig.4 Horizontal distribution of bacteria in genus level in pickles
2.2 酱菜致病菌组成分析
根据1.3 节样品分类分离筛选酱菜样品中微生物,从9 种显色培养基中获得具有显著特征的菌株。 从显色培养基中分离筛选得到的活性菌株的菌落形态如表4 所示。 其中坂崎肠杆菌显色培养基没有菌落。

表4 选择培养基菌株生长情况Table 4 The growth of strains in selective medium
根据1.6 节的序列测定方法,挑取不同的目标菌株进行16S rDNA 测序比对,共检出食源性致病菌5 种。 样品中食源性致病菌检测结果如图5 所示。 CJ.1 中检出蜡样芽胞杆菌、金黄色葡萄球菌和李斯特菌;HJ.1 中检出大肠杆菌O157 和李斯特菌;DJ.1 中检出副溶血性弧菌、 大肠杆菌O157 和李斯特菌;DJ.2 和PC.C 中检出大肠杆菌O157;DJ.C 中检出副溶血性弧菌;MJ.C 中检出蜡样芽胞杆菌、 沙门氏菌和李斯特菌。 上述结果表明,蜡样芽胞杆菌和李斯特菌在样品中检出率较高。分析其原因在于芽孢杆菌属微生物独特的,对外界有害因子抵抗力极强的芽孢杆菌,具有耐高温、快速复活等特点,在有氧和无氧的条件下都能存活[11],并且研究表明蜡样芽孢杆菌具有较强的耐盐性[24]。 单增李斯特菌是李斯特菌属中唯一能够引起人类疾病的菌种,对盐和碱的抵抗力都较强,并且在4 ℃的环境中也能存活[25]。

图5 样品中食源性致病菌检测结果Fig.5 Detection results of foodborne pathogens in samples
3 结论
对9 种云南安宁酱菜的致病菌组成和细菌多样性进行研究。 通过对9 组酱菜样品进行稀释曲线、OTU 分布、相似性、多样性指数和菌落丰富度等方面的分析,得出结论:从OTU 分布以及相似性分析来看,9 酱菜样品中,DJ.2 组所具有的特有OUT 数量最多,说明DJ.2 样品细菌群落结构多样,细菌群落组成特异性最强,同时这9 组酱菜样品具有相似的细菌群落丰度; 从多样性指数和菌落丰富度分析来看,MJ.C 样品具有最高的菌落丰富度;从样本细菌群落结构的差异来看,不同的酱菜样本中细菌群落结构存在显著差异。本次测序,在门水平上,厚壁菌门、变形菌门、蓝藻菌门为优势菌门。在属水平上,各种酱菜样本菌落组成差异较大,乳酸杆菌属、葡萄球菌属和芽孢杆菌属都是酱菜中常见的微生物属。
为探究云南安宁酱菜中的致病菌组成,采用传统分离培养的方法和16S rDNA 测序技术,从这9 种安宁酱菜中分离得到蜡样芽孢杆菌、 大肠杆菌、金黄色葡萄球菌等常见食源性致病菌。值得一提的是,蜡样芽孢杆菌在大部分酱菜样本中都有检出,属于绝对优势菌种。芽孢杆菌属广泛存在于自然界中,而其特性是在不利条件下能够产生具有特殊抵抗力的芽孢,难以除去。
酱菜的制作、发酵是一个复杂的发酵体系,发酵过程中涉及微生物种类繁多,不同的外部因素如气候、地域、原辅料、发酵方法等均影响发酵酱菜微生物群落结构,因此研究酱菜中的细菌多样性,对开发利用酱菜中的微生物资源奠定了基础。如今食品安全越来越受到人们的重视,食源性致病菌成为食品质量与安全的首要影响因素,对酱菜中食源性致病菌进行分析,对确保酱菜食用安全具有重要意义。
