催化MgH2水解制氢的研究进展
2023-02-17戴庆伟
黄 旭,戴庆伟,徐 超
(1.重庆科技学院化学化工学院,重庆 401331;2.重庆科技学院冶金与材料工程学院,重庆 401331)
“双碳”国家战略对氢能源发展意味着全新的机遇与挑战。以氢能源发展经济的理念可追朔到1969 年,其有望实现从化石燃料向清洁能源的转变,缓解日益严峻的碳排放,解决能源供应问题并改善气候环境[1]。在内燃机应用中,以氢能源作为燃料供应可促进其零碳化转型,如在国家大力投入的质子交换膜燃料电池技术研究中,以氢能源为燃料可获得高比能量,延长使用寿命并降低成本,促进商业化发展[2]。
通常,高纯度氢气可通过活性金属水解快速获取,且水解金属可在需氢目的点附近直接制备氢气[3],极大地减少氢能源在运输中的损耗及物流成本。因此,金属水解已成为具有前景的制氢方法,在这类高活性金属中,镁基材料尤其MgH2因其优异的电化学活性及高储氢容量而备受关注。
1 水解MgH2制氢研究现状
相比其他适用于储氢的可逆氢化物,MgH2具有极高的氢容量[4],水解析氢反应如下:
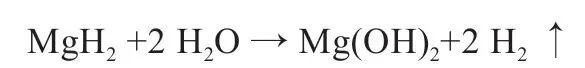
然而,利用该反应制备氢气的首要限制为高工作温度。由于牢固的Mg-H 键合作用,MgH2的析氢温度需达到300 ℃以上[5],这在质子交换膜燃料电池的大部分使用场景如汽车应用中很难实现。其次,MgH2表面会在空气中自发氧化形成钝化膜,阻碍基体与溶液接触,且水解过程中Mg(OH)2产物在表面沉积[6],暴露面积随反应进行而减少,限制了进一步水解。因此,除预处理外,还需在反应进程中抑制沉淀覆盖或对其及时清除。此外,由于解离氢化学吸附的高活化障碍,氢吸附/脱附的缓慢动力学[7]同样限制其进一步的储氢应用。
球磨工艺已广泛应用于水解制氢的金属反应物的预处理中,通过球磨获取纳米级MgH2颗粒有助于增大反应活性表面,降低氢脱附温度并提高反应速率。然而实际中纳米颗粒易聚集成团簇,导致析氢速率随活性表面减少而降低[8]。在水解液中引入新离子有望优先与OH-结合,进而消除表面氢氧化物沉积层[9]。然而由于MgH2的绝缘性,无法像纯Mg 在表面发生强电偶腐蚀,对沉积层的破坏并不理想[10]。现阶段,水解MgH2制氢反应催化剂的选择与调配已得到广泛研究,本文探讨并分析了各类催化剂机理与工艺优化,围绕MgH2绝缘性质总结催化机制的局限,并对未来催化剂发展提出展望。
2 金属催化剂
2.1 钯催化剂
为抑制Mg 暴露表面的惰性氧化膜生成,Higuchi 等[11-12]通过在Mg 的上下表面同时覆盖Pd 层,建立了具有储氢析氢功能的新型原位体系复合材料。当复合材料氢化时,Mg 表层首先形成Mg 的氢化物(MgH)。MgH 的存在抑制了Mg 层中氢的再次外溢,在较高氢压下,Pd 层中的氢浓度增大,而MgH 在低氢浓度的Mg 层中饱和,导致氢产量随着氢气压力的增加反而降低,该现象同时解释了负压依赖关系[13]。由于Pd 不易被氢化,氢易从上下Pd 层中脱附,对Mg 层的上下表面产生压缩应力。这种强烈应力使Mg 层中的氢变得活泼,最终导致氢气在较低温度下脱附。值得一提的是,这种复合结构可以同时保留Mg 的高储氢容量性能以及Pd 的低脱附温度特征[11-12]。
然而,由于Pd 和Mg 的热膨胀系数差异,氢化后体积膨胀的Mg 层在界面处产生应力,致使在仅经历几个氢吸附和氢脱附循环后,Pd 层和Mg 层部分分离,导致最大氢吸附量显著降低[14]。Kumar 等[7]选择更高催化活性的Pd 纳米粒子替代Pd层,可有效抑制Pd 层和Mg 层分离现象。作为氢分子吸附和脱附的催化剂,低解氢活化能垒(0.39 eV)的Pd 纳米粒子作为Mg 层上氢化物纳米域形成的局部催化形核位点,可催化分解氢分子为反应原子,导致Mg 纳米膜转化为局部的MgH2纳米域,Pd 纳米粒子与其紧密接触保证了其催化活性不受界面层分离而降低。
2.2 钛催化剂
Pd 对氢的强解离作用可促进氢原子的快速扩散,而Ti 的添加有助于锚定精细的Mg 纳米晶结构,阻止其形核和生长,进而保持大面积晶界网络所赋予的高动力学[15]。Cui 等[16]在MgH2表面覆盖Ti 层,其表面共存的多种价态Ti 离子(Ti2+、Ti3+和Ti4+)的3D 态分裂诱导其比Mg 离子易获得电子,同时比H离子易失去电子,进而加速脱氢反应进程的电子转移[6],削弱Mg-H 的键合力而解离出H,最终加快脱氢速率并同时降低脱附温度。
Wu 等[17]通过密度泛函方法和第一原理模型进一步探讨了Ti 对MgH2析氢性能的催化机制。四价的Ti 原子位于Mg-Ti-H 复合团簇的中心,通过H 桥连接Mg 原子。所有Mg 原子通过连接三个H 桥和一个末端H 原子形成四面体配位,末端H 原子在Ti 掺杂的团簇中形成的Mg-H 键键长比连接镁的H桥短。另一方面,添加Ti 催化剂的复合材料电荷值比纯MgH2要小,且Ti 连接的H 桥加大了电荷值的差距。综合键长和电荷值差异,Ti 催化剂可通过破坏牢固的Mg-H 键进而克服高温限制。
然而,Ti 的添加量存在临界值。在低Ti 含量下,Ti 原子通过削弱Mg-H 键而有利于初始脱氢。但由于Ti-H 键相比Mg-H 键的高键能,MgH2无法脱氢完全[18]。近年来,以添加10%(质量分数)的Ti 促进纳米晶Mg 复合材料吸附4.5%(质量分数)氢的效果得到认可,当小于该添加量时,将削弱循环中的氢吸附/脱附动力学[19]。此外,对Ti 催化剂的优化仍在进行中,Wang 等[20]发现TiF3作为催化剂的效果明显优于纯Ti 的添加。这归因于在氢脱附过程中,TiF3可与MgH2反应形成高活性TiH2中间体,促进解吸。
2.3 铁等过渡金属催化剂
小原子H 较完美晶格更倾向于在晶胞缺陷处快速扩散,同时缺陷在Mg 的相变中充当异质形核中心,导致金属与氢化物的体积不匹配而生长成核屏障[21]。添加硬质和脆性金属粉末有助于增加球磨过程中氢化物的缺陷数量[22],抑制沉积并提高析氢效率。尤其像Fe 这种具有大原子利用率的3D 过渡金属,其3D 电子层处于倾向失电子或夺取电子的不稳定状态,促进电子转移以克服Mg-H 键,提高氢效率。此外,常见过渡金属如锰、钒、铂等作为水解析氢催化剂已受到广泛青睐。
除单组分金属催化剂外,Amirkhiz 等[23]制备了Ti 和Fe 的复合催化剂,过渡金属元素Fe 作为催化的活性中心,同时Ti通过形成氢化钛限制Mg 颗粒的尺寸,防止析氢效率因团聚而降低。
3 特殊结构催化剂
3.1 1D 铌酸盐
Brum 等[18]制备出具有八面体微孔晶体结构的一维线性铌酸盐催化剂。微孔结构有助于催化活性粒子进入Mg 颗粒中心内部,促进镁颗粒与氢原子结合成氢化物,加速氢化反应的同时提升了氢容量。对比常规铌酸盐,一维线型铌酸盐以无定形形式结合MgH2,具有更快的动力学及更高的氢脱附容量。
3.2 2D 类石墨烯TiO2(B)纳米片
Chen 等[24]制备出的2D 类石墨烯TiO2(B)纳米片有望实现中温固定式储氢装置的现实应用。呈石墨烯状的TiO2(B)的薄片由于表面张力导致部分起皱,在循环中被还原为Ti 纳米粒子和褶皱脊状Ti2O3,提升MgH2的储氢性能。此外,2D TiO2(B)纳米片可有效限制二维相界脱氢动力学行为的触发,抑制动力学屏障的生成。
3.3 3D 花朵状TiO2@C
Zhang 等[25]通过一步溶剂热法和低温热解制备出由多根短杆构成的三维花状碳包被TiO2催化剂,如图1 所示。疏松结构导致花状TiO2在球磨过程中易被破坏成小颗粒分散在Mg/MgH2表面。脱氢后,TiO2部分还原为低价态,多价态的Ti发挥催化作用[16]以降低MgH2的活化能及析氢工作温度。此外,无定形碳的存在不仅可限制TiO2粒子的聚集和生长,还可显著降低MgH2中氢的解吸能。
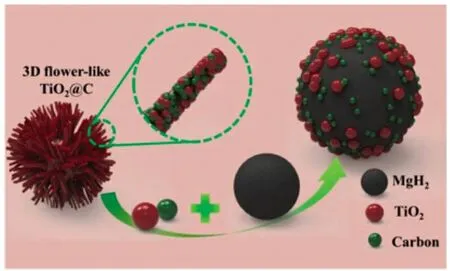
图1 三维花状TiO2催化剂示意图[25]
4 纯酸添加剂
作为价格低廉且高效的添加剂,纯酸可大幅降低水解MgH2反应的成本,在环境限制下满足对催化剂的需求。大多数纯酸(如盐酸、硫酸、硝酸、醋酸、柠檬酸)都对水解制氢反应有明显的加速效果,然而其本质都在于加速MgH2基体的腐蚀,以及消除反应进程中的Mg(OH)2沉积层[9,26]。
以盐酸为例来简述其消除钝化层的机理。在添加盐酸的水解液中,Cl-的存在可以加速单价Mg+的电化学反应速率,从而提高水解反应活性。此外,Cl-能够在溶液中替代OH-与Mg2+形成易于溶解的MgCl2,消除MgH2表面的氢氧化物沉积,增大与水接触的活性表面。此外,强酸还可通过与中强碱Mg(OH)2发生中和反应进而清除,加速析氢动力学并提高氢的产率。
5 催化MgH2水解机制局限
由于MgH2具有绝缘性质,在电化学腐蚀中无法高效传递电子[10],不能与催化剂构成原电池进行阳极反应,因而达不到理想的加速腐蚀及析氢效果。MoS2因其独特的层状结构和优异的催化性能,在光催化制氢中的应用中已得到认可[27]。以纯镁为例,在球磨过程中添加的MoS2通过开裂成小薄片随机分散在Mg 表面上,纳米级的MoS2和Mg 颗粒组成数以万计的微原电池,通过Mg 阳极反应加速水解进程[28]。然而MoS2催化机制主要归因于高活性S 为氢扩散提供了活性位点,且附着在MgH2表面的非晶态MoS2可起到表面润滑与分散作用[29-30]。在相同条件下,由于MgH2不倾向发生阳极反应,MoS2催化效率是否不及纯Mg,或能否发挥最大效能,还不得而知。
6 结论与展望
在“双碳”背景下,水解高储氢、析氢性能的MgH2制备清洁氢能源,在燃料电池领域如质子交换膜燃料电池行业中具有巨大的发展潜力。以添加催化剂为主要手段能有效解决MgH2水解时的高工作温度瓶颈,清除其表面钝化膜及提升析氢动力学。水解催化剂发展至今种类繁多,其常见的催化机制可总结为:(1)解除Mg-H 键进而降低析氢温度;(2)通过电子转移加速H 的解离;(3)提供活性位点,加快析氢速率;(4)增大MgH2暴露表面,提高反应效率。在对新型催化剂的开发与优化中,需结合成本做出合理选择。虽然Pd、Pt 等过渡金属已证实具有催化效果,但其价格昂贵,在没有发现其特殊催化机制时,Ti基催化剂是明智选择。其次,未来催化剂的研发思路应朝向多组分催化剂或特殊结构催化剂,其独特的结构和相组成可解决动力学缓慢、析氢温度高等难题,且合理添加辅助元素(如C 等)可达到事半功倍的效果。最后,由于MgH2的强绝缘缺陷而无法与高活性催化剂构成原电池进行阳极反应,致使催化效果不明显。MoS2等催化剂能否克服绝缘性达到理想催化效率,还亟待探究。
质子交换膜燃料电池产业正蓬勃发展,其水解制氢技术前景光明。新型水解催化剂研发有望促进制氢技术的完善,加速氢能源经济发展进程,助力国家早日实现“碳达峰”与“碳中和”目标。
