超声波辅助提取新疆香梨多糖的工艺研究
2023-02-17李文宇王茜沈静刘梦文贺诗茹阿依努尔白克热肖辉
李文宇,王茜,沈静,刘梦文,贺诗茹,阿依努尔·白克热,肖辉
(新疆医科大学公共卫生学院,新疆 乌鲁木齐 830000)
香梨,别名快果、果宗、大头梨,是蔷薇科苹果亚科梨属植物。香梨具有皮薄味甜、渣少肉细等特点[1],一般在每年的9月中旬成熟[2]。香梨种植历史悠久,已有1400余年[3],且营养价值高,富含果糖、维生素、矿物质、苹果酸等营养成分,具有清热润肺、消炎解毒等功效[4]。作为我国独有特色水果,香梨既可鲜食又可药用,是生活中常见的药食同源类食材[5],其中多糖类化合物和黄酮类化合物被证实为梨果肉中的有效成分[6-7],广泛存在于梨果实[8]、铁皮石斛[9]、秋葵[10]、丹参[11]、银杏[12]、枇杷[13]等植物中。现代药理学研究表明,梨具有抗氧化[14]、抗溃疡[15]、抗癌[16]、免疫调节[17]、镇咳祛痰平喘[18]等功效。
近年来,对食品中多糖成分开发在功能性食品界有着广阔的研究前景[19]。新疆的香梨仅2020年产量就高达154.47万t[20],所以有着巨大的开发和利用价值。因此本研究通过响应面法进行香梨多糖提取条件的优化试验,采用单因素和响应面试验设计得出香梨多糖的最优提取条件,并比较了不同地区香梨多糖含量以及提取率的差异,以期补充新疆地产食物植物化学物标准数据库,为新疆香梨产业的发展提供数据支撑和参考。
1 材料与方法
1.1 材料与试剂
11种香梨样品分别来自于库尔勒市哈拉苏、库尔勒市区、库尔勒市沙依东、和田市皮山、阿克苏市沙雅、和田市区、库车市区、喀什市莎车、喀什市叶城、喀什市巴楚、阿克苏市区,每个样品采购3 kg。
无水乙醇(分析纯):天津市致远化学试剂有限公司;苯酚溶液(分析纯):天津市北联精细化学品开发有限公司;硫酸(分析纯):国药集团化学试剂有限公司;葡萄糖标准品(分析纯):上海源叶生物科技有限公司。
1.2 仪器与设备
DZ-2BC11真空干燥箱:天津市斯泰特仪器有限公司;IDH30多功能超声波清洗机:德国IRM/ci有限公司;5430R离心机:德国eppendorf有限公司;UV2600紫外分光光度计:日本岛津公司;RE-52A旋转蒸发仪:上海亚荣生化仪器有限公司。
1.3 方法
1.3.1 香梨多糖的提取
1.3.1.1 香梨预处理
将香梨洗净后去蒂去核切块,放入破壁机匀浆,匀浆后装入样品瓶放置于超低温冰箱。
1.3.1.2 香梨粗多糖提取工艺
10 g样品→超声波辅助提取→离心(5 000 r/min,10 min)→残渣重复提取两次→离心(5 000 r/min,10 min)→合并滤液→浓缩→乙醇醇沉→-4℃冰箱静置过夜→离心(5 000 r/min,10 min)→弃上清液取其沉淀→香梨粗多糖→真空干燥箱干燥→粗多糖粉末。
1.3.2 葡萄糖标准曲线的建立
采用苯酚-硫酸比色法[21]测定香梨多糖提取液的浓度,葡萄糖标准曲线的建立参考国标SN/T4260—2015《出口植物源食品中粗多糖的测定》。
标准溶液的配制:精确称取0.010 0 g葡萄糖标准品于100 mL容量瓶中,用纯水定容至100 mL,置于涡旋振荡器振荡混合均匀后得到100 mg/L的标准葡萄糖溶液,将标准溶液放于4℃冰箱中储存。
标准曲线的绘制:分别吸取 0、0.2、0.4、0.6、0.8、1.0 mL的葡萄糖标准溶液置于20 mL具塞试管中,用蒸馏水补充至1.0mL。向溶液中加入5%苯酚溶液1mL,然后快速加入5.0 mL浓硫酸,静置10 min,使用涡旋振荡器将试管中的液体充分混合后置于30℃恒温水浴锅水浴20 min,在最大吸收波长486 nm处测吸光度。以葡萄糖质量为横坐标,吸光度值为纵坐标,绘制葡萄糖标准曲线。得到回归方程为y=0.010 2x+0.019 1,R2=0.998 8。该方程在葡萄糖质量0~100 μg范围内,线性关系良好。
1.3.3 香梨多糖提取率的测定
吸取香梨粗多糖溶液1 mL,将其稀释到一定体积。按照1.3.2步骤进行操作,于486 nm处测量其吸光值。香梨多糖提取率计算公式[22]如下。

1.3.4 超声波辅助提取香梨多糖的单因素试验
1.3.4.1 液料比对香梨多糖提取率的影响
分别称取10 g香梨样品于5个锥形瓶中,设置液料比 1∶1、2∶1、3∶1、4∶1、5∶1(mL/g)5 个水平。设定超声时间50 min、超声温度50℃、乙醇浓度85%,考察液料比对香梨多糖提取率的影响。
1.3.4.2 超声时间对香梨多糖提取率的影响
分别称取10 g香梨样品于5个锥形瓶中,设置超声时间 30、40、50、60、70 min 5 个水平。设定液料比3∶1(mL/g)、超声温度 50 ℃、乙醇浓度 85%,考察超声时间对香梨多糖提取率的影响。
1.3.4.3 超声温度对香梨多糖提取率的影响
分别称取10 g香梨样品于5个锥形瓶中,设置超声温度 30、40、50、60、70 ℃ 5 个水平。设定液料比3∶1(mL/g)、超声时间 50 min、乙醇浓度 85%,考察超声温度对香梨多糖提取率的影响。
1.3.4.4 乙醇浓度对香梨多糖提取率的影响
分别称取10 g香梨样品于5个锥形瓶中,设置乙醇浓度75%、80%、85%、90%、95%5个水平。设定液料比 3∶1(mL/g)、超声时间 50 min、超声温度 50 ℃,考察乙醇浓度对香梨多糖提取率的影响。
1.3.5 Box-Behnken试验设计
在单因素试验的基础上,采用design expert软件中Box-Behnken进行试验设计,响应值为香梨多糖提取率(Y),以液料比(A)、超声时间(B)、超声温度(C)、乙醇浓度(D)为因素进行四因素三水平响应面试验。因素水平见表1。
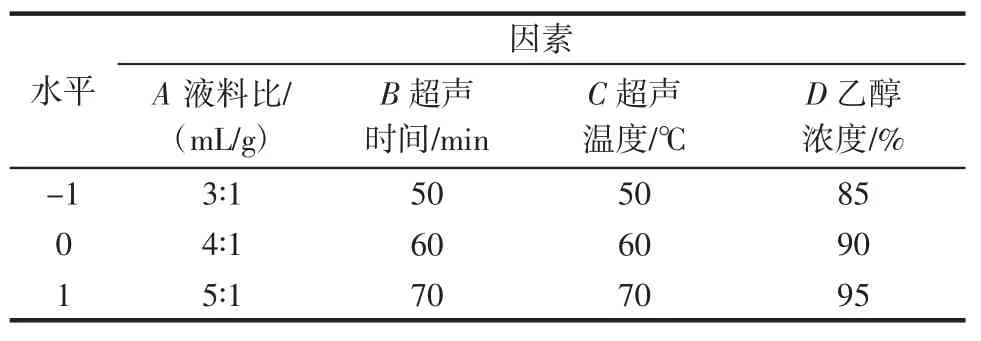
表1 响应面试验因素与水平Table 1 Factors and levels of response surface test
1.4 数据处理
用Excel 2016和Design Expert软件进行图表绘制和数据分析。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 液料比香梨多糖提取率的影响
液料比对香梨多糖提取率的影响见图1。
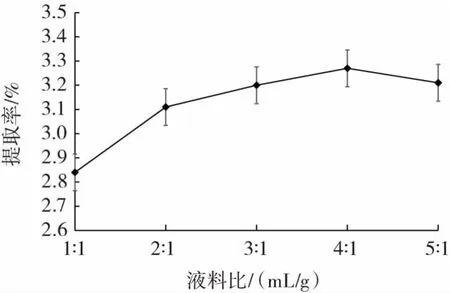
图1 液料比对多糖提取率的影响Fig.1 Effect of liquid-to-material ratio on yield of polysaccharides
由图 1 可知,液料比为 1∶1(mL/g)~5∶1(mL/g)时,香梨多糖的提取率呈现先上升后下降的趋势,且在液料比4∶1(mL/g)时达到最大值3.27%。这与溶剂添加量有关,由于溶剂较少,溶液稠密且黏性大,溶解能力达到饱和[23]。此外,溶液浓度过高,多糖易在超声、过滤、离心、烘干等环节中有所损失,导致提取率较低;随着溶剂的增多,溶剂与香梨样品接触面积增大,且超声的空化效应和振动效果,使得溶出的多糖增加[24]。当液料比超过4∶1(mL/g)时,提取率略有下降可能是由于随着溶剂量逐渐增加,原料被过度稀释使多糖更易被水解,从而导致多糖提取率下降[25]。因此,选择液料比为 3∶1、4∶1、5∶1(mL/g)进行后续试验。
2.1.2 超声时间对香梨多糖提取率的影响
超声时间对香梨多糖提取率的影响见图2。

图2 超声时间对多糖提取率的影响Fig.2 Effect of ultrasonic time on yield of polysaccharides
由图2可知,超声时间为30 min~70 min时,香梨多糖的提取率随着超声时间延长呈现先上升后下降的趋势,在超声时间60 min时达到最大值3.23%。在30 min~60 min时,随着超声时间的延长,多糖提取率随之增大,这可能是由于在超声作用下多糖不断析出使提取率升高[26]。而当超声时间超过60 min后,多糖得率下降,这可能是由于超声时间过长致使提取液中的多糖被分解[27]。因此,选择超声时间50、60、70 min进行后续试验。
2.1.3 超声温度对香梨多糖提取率的影响
超声温度对香梨多糖提取率的影响见图3。

图3 超声温度对多糖提取率的影响Fig.3 Effect of ultrasonic temperature on yield of polysaccharides
由图3可知,超声温度为30℃~70℃时,香梨多糖提取率随着超声温度升高呈现先上升后下降的趋势,在超声温度60℃时达到最大值3.15%。当温度较低时,溶液中物质之间的分子运动较慢,而在30℃~60℃时,随着温度升高,物质之间的分子运动加快,有利于多糖的溶出和分散,使得多糖在水中的溶解度不断提高[28]。当温度高于60℃时,可能由于高温破坏多糖结构,导致多糖的提取率下降[29]。因此,选择超声温度50、60、70℃进行后续试验。
2.1.4 乙醇浓度对香梨多糖提取率的影响
乙醇浓度对香梨多糖提取率的影响见图4。

图4 乙醇浓度对多糖提取率的影响Fig.4 Effect of ethanol concentration on yield of polysaccharides
由图4可知,乙醇浓度为75%~95%时,香梨多糖提取率随着乙醇浓度增大呈现递增趋势,在乙醇浓度为95%时达到最大值3.37%。这可能是因为在醇沉过程,随着乙醇浓度的提高,乙醇对多糖的醇沉能力逐渐增强,从而使多糖的提取率不断提高,但考虑到试验过程中随着乙醇浓度的提高,乙醇消耗量也随之增加且乙醇浓度已达到较高水平,故不再设置更高乙醇浓度。因此,选择乙醇浓度85%、90%、95%进行后续试验。
2.2 响应面试验结果及方差分析
2.2.1 Box-Behnken试验
Box-Behnken试验结果如表2所示。
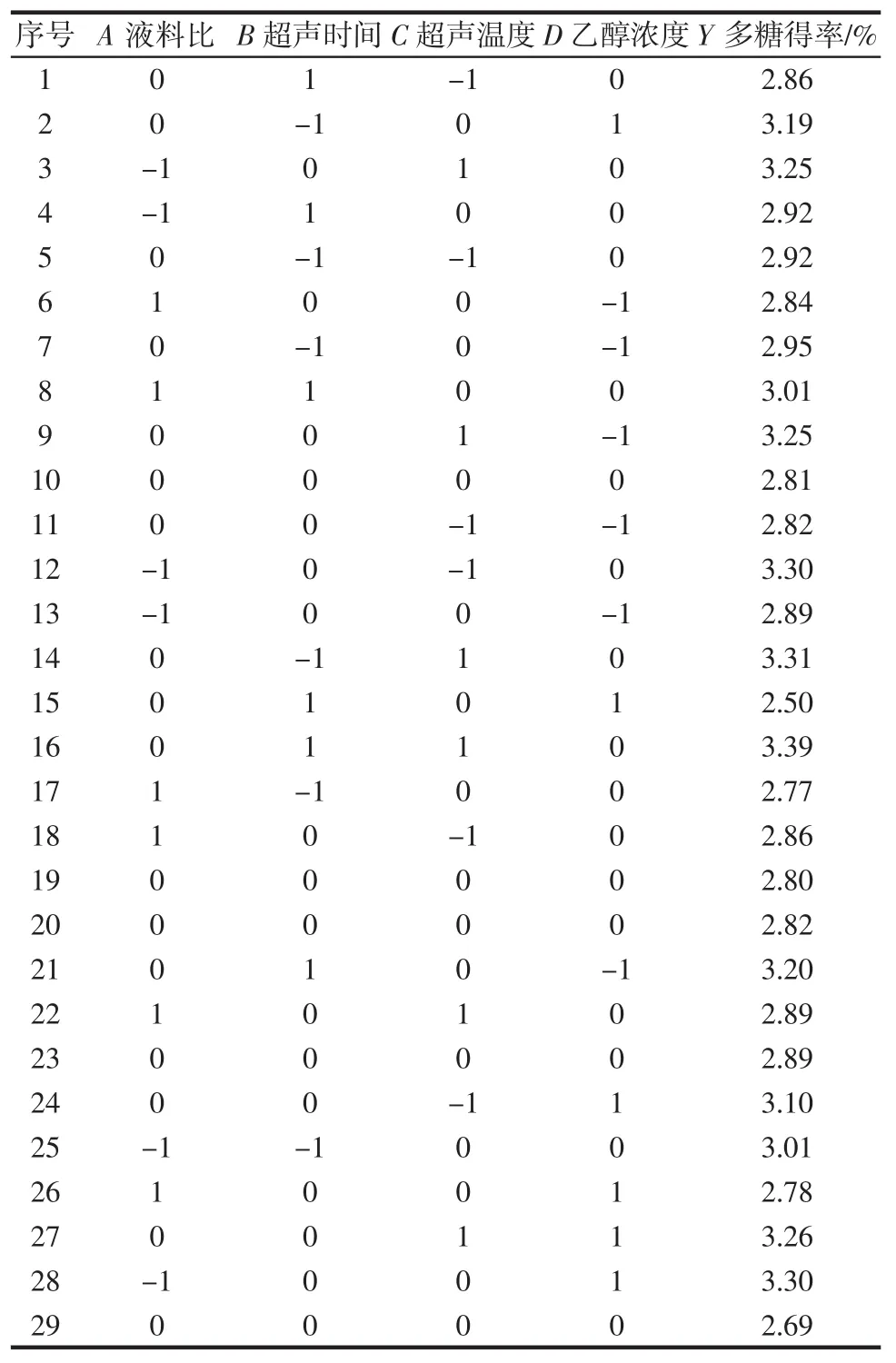
表2 响应面试验结果Table 2 Response surface test results
用Design Expert软件对数据进行多元回归拟合分析从而得出回归方程:Y=3.23+0.093 3A+0.045 8B+0.003 3C+0.182 5D-0.057 5AB+0.032 5AC+0.105 0AD+0.022 5BC+0.057 5BD-0.020 0CD-0.260 8A2-0.242 1B2-0.128 3C2+0.022 9D2。
2.2.2 响应面回归模型的显著性检验
回归模型方差分析见表3。

表3 回归模型方差分析Table 3 Regression model variance analysis
由表 3 可知,模型 F=40.8,P<0.000 1,失拟项(P=0.160 9>0.05)不显著,说明该模型拟合程度较好,可以用其进行响应面优化试验。液料比、超声时间与乙醇浓度对香梨多糖的提取率有极显著影响;AB、BD对香梨多糖提取率的影响显著(P<0.05);AD、A2、B2、C2对香梨多糖提取率的影响极显著(P<0.01)。R2=0.976 1,表明该模型可以解释97.61%的响应值变化,R2adj=0.952 2,表明该模型具有较好的线性拟合。以上结果均表明回归模型可信度高,可以对香梨多糖提取率进行准确的预测和分析。
根据F值可知,4个因素对香梨多糖提取率影响的先后顺序为:D(乙醇浓度)>A(液料比)>B(超声时间)>C(超声温度)。
2.2.3 响应面分析
通过Design expert软件得到的三维曲面图和等高线图可以很好地反映出两因素之间的交互作用对香梨多糖提取率的影响,结果见图5~图7。
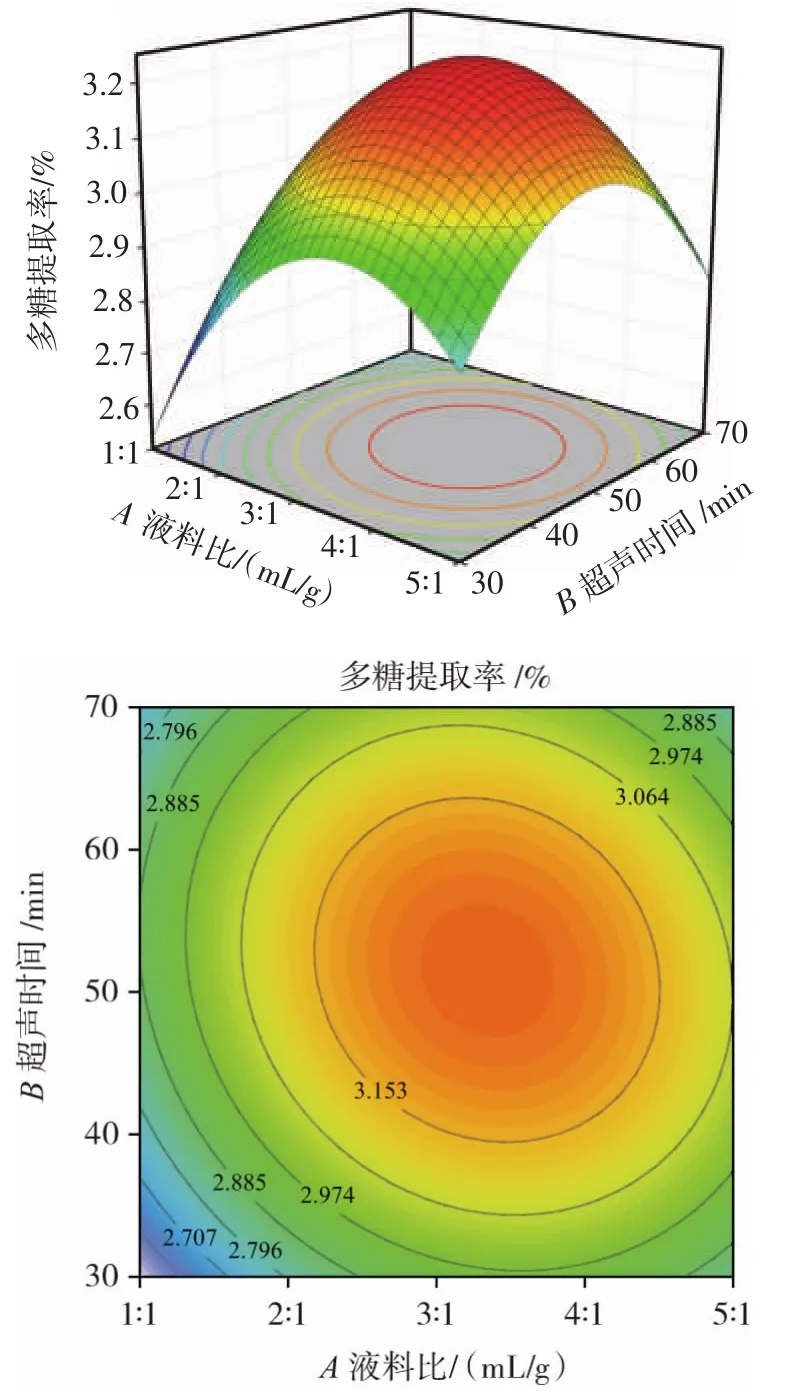
图5 液料比与超声时间对多糖提取率的影响Fig.5 Effect of liquid-to-material ratio and ultrasonic time on polysaccharide yield
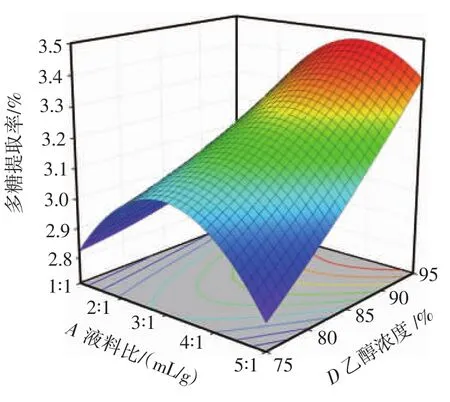
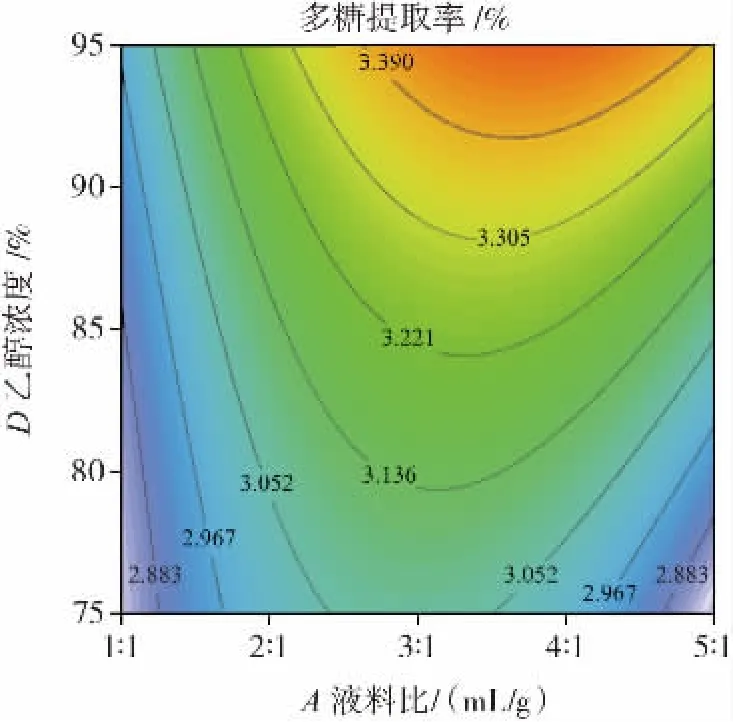
图6 液料比与乙醇浓度对多糖提取率的影响Fig.6 Effect of liquid-to-material ratio and ethanol concentration on polysaccharide yield

图7 超声时间与乙醇浓度对多糖提取率的影响Fig.7 Effect of ultrasonic time and ethanol concentration on polysaccharide yield
由图5可知,当A(液料比)确定时,多糖的提取率呈现先升高后下降的趋势,当B(超声时间)确定时,多糖的提取率呈现先升高后下降的趋势,等高线呈椭圆形,响应曲面坡度较陡峭,这说明A(液料比)和B(超声时间)之间的交互作用对香梨多糖得率有显著影响,这与表3回归模型方差分析结果一致。
由图6可知,A(液料比)确定时,多糖的提取率呈现先升高后下降的趋势,当D(乙醇浓度)确定时,多糖的提取率呈现先升高后下降的趋势,等高线呈椭圆形。表明A(液料比)和D(乙醇浓度)之间的交互作用对香梨多糖得率作用极显著,这与表3回归模型方差分析结果一致。
由图7可知,当B(超声时间)确定时,多糖的提取率呈现递增趋势,当D(乙醇浓度)确定时,多糖的提取率呈现先升高后下降的趋势,等高线呈椭圆形。表明B(超声时间)和D(乙醇浓度)之间的交互作用对香梨多糖得率有显著影响,这与表3回归模型方差分析结果一致。
2.2.4 最优工艺和验证试验
通过Design expert软件拟合得出最优的提取条件为液料比 3.777∶1(mL/g)、超声时间 53.416 min、超声温度47.581℃、乙醇浓度95%。考虑到实验室的实际情况和可行性,最终将香梨多糖的最优提取条件调整为液料比 4∶1(mL/g)、超声时间 53 min、超声温度 48 ℃、乙醇浓度95%。通过该条件得出香梨多糖提取率为3.45%,该值与预测值(3.48%)的相对误差为0.97%,验证了提取工艺参数的可靠性。
2.3 11处采样点多糖提取率
根据1.3.3中公式依次代入多糖质量、稀释倍数和样品质量,每个采样点做3个平行样取均值,得出11处采样点多糖的提取率见表4。
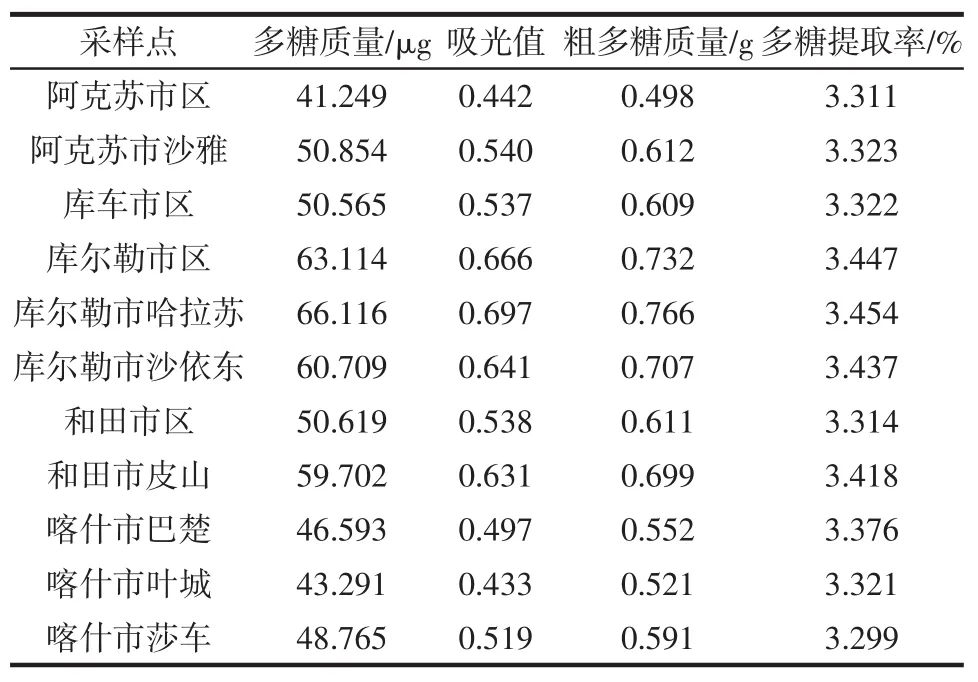
表4 11处采样点香梨多糖提取率Table 4 Yield of polysaccharide from fragrant pears at 11 sampling sites
由表4可知,11处采样点多糖提取率排序依次为库尔勒市哈拉苏>库尔勒市区>库尔勒市沙依东>和田市皮山>喀什市巴楚>阿克苏市沙雅>库车市区>喀什市叶城>和田市区>阿克苏市区>喀什市莎车。
3 结论
本研究采用单因素试验和响应面试验,考察液料比、超声时间、超声温度、乙醇浓度4个单因素对香梨多糖提取率的影响,得出香梨多糖最优提取条件:液料比 4∶1(mL/g)、超声时间 53 min、超声温度 48 ℃、乙醇浓度95%,此条件下香梨多糖提取率为3.45%。在最优工艺条件下,新疆11个采样点香梨多糖提取率顺序依次为库尔勒市哈拉苏>库尔勒市区>库尔勒市沙依东>和田市皮山>喀什市巴楚>阿克苏市沙雅>库车市区>喀什市叶城>和田市区>阿克苏市区>喀什市莎车。本研究补充了新疆地产食物植物化学物标准数据库,有利于为新疆香梨的开发与利用提供一定的数据支撑和参考。
