破壁处理对松花粉营养成分和理化性质的影响
2023-02-17王桐曲涛程勇王召君曾茂茂秦昉陈洁何志勇
王桐,曲涛,程勇,王召君,曾茂茂,秦昉,陈洁,何志勇*
(1.烟台新时代健康产业有限公司,山东 烟台 264000;2.江南大学食品科学与技术国家重点实验室,江苏 无锡 214122)
松花粉是松属植物的精细胞,是我国传统的药食同源花粉品种,因其富含多种氨基酸、矿物质、维生素、酶和多酚类物质,被誉为“微量营养库”[1]。国内外研究显示松花粉具有多种生理功效[2],如抗氧化、抗炎、调节血糖和血脂等,具有广阔的开发前景,越来越受到食品和医药行业的关注。
松花粉细胞壁结构坚固,能够抗酸、碱、腐蚀等,但同时也降低了其人体胃肠消化率,影响营养成分的吸收利用,极大限制了松花粉的开发利用[3]。因此,采收回的原松花粉需要进行破壁处理。目前,超微粉碎技术因其具有效率高、污染小、可在无菌条件下操作等优点,广泛应用于花粉细胞壁的破碎处理。该技术原理是原料通过借助压缩空气,高速进入研磨室并与研磨室内壁剧烈摩擦振动和颗粒间碰撞使原料细胞壁被破坏[4]。已有文献报道超微粉碎破壁处理对花粉或其它样品的营养成分溶出具有明显的效果[5]。此外,松花粉中水不溶性膳食纤维含量为42.6%~47.2%[6],而膳食纤维具有明显的润肠通便功能,其中与膳食纤维密切相关的理化性质(包括持水力、持油力、阳离子交换能力、胆固醇吸附能力、亚硝酸盐清除能力和金属离子吸附能力等)可以反映出样品润肠通便功能的强弱[7]。因此,本研究采用超微粉碎破壁处理松花粉,评价松花粉破壁处理前后的成分以及相关理化性质的变化,为松花粉的加工、开发利用提供参考依据。
1 材料与方法
1.1 材料与试剂
原松花粉、破壁松花粉:烟台新时代健康产业集团有限公司;大豆油、玉米油、花生油、菜籽油:市售;芦丁、没食子酸、Folin-Ciocalteu、熊果酸:美国Sigma公司;无水乙醇、氯化铝、亚硝酸钠、氢氧化钠、碳酸钠、高氯酸、氯化钠、Cd(NO3)2、Pb(NO3)2、CuSO4、对氨基苯磺酸、盐酸萘乙二胺、浓硫酸、冰乙酸、胆固醇、盐酸(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
全波长酶标仪(SpectraMax 190):美国 Molecular Devices公司;高效液相色谱仪(Waters 1525):美国Waters公司;离子色谱仪(ICS-5000):美国戴安公司;冷冻离心机(5910R):德国Eppendorf公司。
1.3 方法
1.3.1 水分、灰分、粗蛋白、粗脂肪和可溶性总糖含量测定
水分、灰分、粗蛋白、粗脂肪和可溶性总糖含量分别按照GB 5009.3—2016《食品安全国家标准食品中水分的测定》中的直接干燥法、GB 5009.4—2016《食品安全国家标准食品中灰分的测定》中的第一法、GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》中的凯式定氮法、GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》中的索式抽提法和任婧[8]的蒽酮比色法进行测定。
1.3.2 膳食纤维含量测定
松花粉中膳食纤维含量按照GB 5009.88—2014《食品安全国家标准食品中膳食纤维的测定》中的酶-重量法进行测定。
1.3.3 总黄酮、总酚和总三萜含量测定
样品溶液的制备:向2.5 g松花粉中加入20倍体积的70%乙醇溶液,超声辅助提取30 min(30℃)后过滤(提取3次),合并滤液浓缩至50 mL,于-20℃冰箱保存待用。
采用Cheng等[4]的方法测定总黄酮含量:向0.2 mL松花粉提取液中加入蒸馏水至4 mL并摇匀,分别加入0.3 mL 5%NaNO2溶液(混匀并静置5 min)、0.3 mL 10%AlCl3溶液(混匀并静置6 min)和2 mL 1 mol/L NaOH溶液,蒸馏水定容至10mL,摇匀静置显色10 min后测定510 nm处的吸光度(A510)。总黄酮含量以芦丁当量(rutin equivalent,RE)表示,单位记为 mg RE/g。
采用Quan等[9]的方法进行总酚含量测定:向0.2mL松花粉提取液中加入1 mL Folin-Ciocalteu试剂(稀释10倍)混匀,静置5min后加入3mLNa2CO3溶液(75g/L),蒸馏水定容至10 mL混匀后避光反应2 h,测定765 nm处的吸光度(A765)。总酚含量以没食子酸当量(gallic acid equivalent,GAE)表示,单位记为 mg GAE/g。
采用何策等[10]的方法进行总三萜含量测定:量取1.0 mL松花粉提取液并挥干其中的乙醇(85℃水浴),加入0.3 mL香草醛-冰醋酸溶液(5%)和1.0 mL高氯酸,60℃水浴15 min后冷却,加入5.0 mL冰醋酸,摇匀,测定550 nm处的吸光度(A550),以无水乙醇为空白对照。总三萜含量以熊果酸当量(ursolic acid equivalent,UAE)表示,单位记为 mg UAE/g。
1.3.4 可溶性蛋白分子量分布测定
将1g松花粉与50mL水混匀并超声辅助提取2h,浓缩至5 mL,0.45 μm微孔滤膜过滤,使用高效液相色谱仪测定分子量分布。色谱条件:TSK gel 2000 SWXL(300 mm × 7.8 mm,5 μm)色谱柱;流动相为乙腈-水-三氟乙酸(45∶55∶0.1,体积比);检测波长为 220 nm;流速为0.5 mL/min;柱温为30℃。
1.3.5 单糖组成测定
将300mg脱脂干燥的松花粉与40mL硫酸(1mol/L)于120℃下水解3 h后冷却,稀释200倍,过0.22 μm膜待测。色谱条件:CarboPac PA20色谱柱;检测器为脉冲安培检测器;流动相A为水、B为250 mmol/L NaOH、C为1 mol/L醋酸钠溶液;梯度洗脱程序为0~21 min,98%A;21 min~21.1 min,98%~93%A;21.1 min~30 min,93%~78%A;30 min~30.1 min,78%~20%A;30.1 min~50 min,20%A;进样量 10 μL。
1.3.6 持水力和持油力测定
参考Liu等[11]的方法测定样品的持水力和持油力:将0.5 g松花粉与30 mL去离子水或植物油(大豆油、玉米油、花生油和菜籽油)置于烧杯中,室温下搅拌过夜。静置 1 h后离心(10 000 r/min,20 min,25℃)去上清液并称重。持水力或持油力按照下列公式计算。
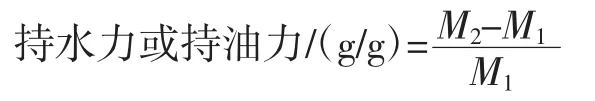
式中:M1为样品干质量,g;M2为样品湿质量,g。
1.3.7 阳离子交换能力测定
采用Chau等[12]的方法对样品的阳离子交换能力进行测定:将0.2g松花粉与70倍体积的盐酸(0.1mmol/L)置于锥形瓶中混匀,于室温下磁力搅拌酸化24 h,使用蒸馏水将样品中Cl-冲洗干净。使用50 mL NaCl溶液(5%)酸化样品,以酚酞为指示剂并用NaOH溶液(0.01 mmol/L)滴定至溶液颜色变为微红色,记录NaOH溶液的消耗体积。阳离子交换能力按下列公式计算。
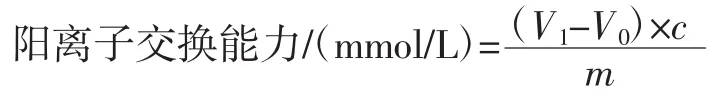
式中:V1和V0分别为滴定样品组和空白组消耗NaOH溶液的体积,mL;c为 NaOH溶液浓度,mol/L;m为样品质量,g。
1.3.8 胆固醇吸附能力测定
采用张启月等[13]的方法对样品的胆固醇吸附能力进行测定:将2.0 g样品与50 g蛋黄乳液(由新鲜制备的蛋黄液用水稀释10倍所得)搅拌均匀,调节pH值为2.0和7.0,37℃振荡2 h后离心(4 000 r/min,20 min)并收集上清液。向0.1 mL上清液中加入冰乙酸至1.0 mL,再加入0.4 mL邻苯二甲醛(l.0 mg/mL)和8.0 mL混合酸(冰乙酸与浓硫酸体积比1∶1),室温放置10 min后测定550 nm处的吸光度(A550)。以胆固醇标准液进行定量,并按下列公式计算样品对胆固醇的吸附能力。
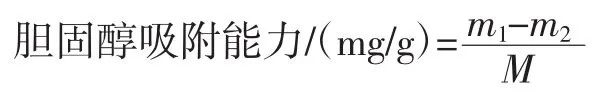
式中:m1和m2分别为吸附前和吸附后蛋黄液中胆固醇量,mg;M为样品质量,g。
1.3.9 亚硝酸盐清除能力测定
采用郑佳欣[14]的方法测定样品的亚硝酸盐清除能力:向0.5g样品中加入100mLNaNO2溶液(100μmol/L),调节pH值至2.0和7.0,磁力搅拌至完全分散后,于37℃下恒温水浴振荡2 h,取出静置。向上清液(2.0mL)中加入2 mL对氨基苯磺酸溶液(0.4%),混匀并放置5 min,再加入1 mL盐酸萘乙二胺溶液(0.2%),定容至50 mL,混匀并静置15 min后测定538 nm处的吸光度(A538)。以空管为参比,NaNO2溶液为标准液测定NO2-含量,按下列公式计算亚硝酸盐清除率。
[5]赵晋、张建军、王奕俊:《大数据思维下教育发展机遇与挑战的再思考》,《电化教育研究》2018年5月。
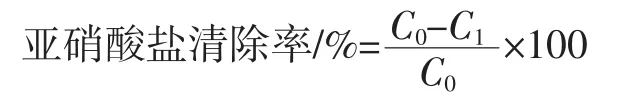
式中:C0为溶液中 NO2-初始摩尔浓度,μmol/L;C1为溶液中NO2-最终摩尔浓度,μmol/L。
1.3.10 金属离子吸附能力测定
样品对Cd2+、Pb2+、Cu2+的吸附能力测定按照李晗等[15]的方法进行:分别取 100 mL 100 mg/L 的 Cd(NO3)2、Pb(NO3)2和 CuSO4溶液置于 250 mL 的三角瓶中,用HNO3和NaOH溶液(0.01 mol/L)依次调节溶液pH值至2.0和7.0。然后在每个三角瓶中分别加入0.50 g样品,于37℃下振荡培养(120 r/min)2 h后吸取适量吸附液离心(8 000 r/min,10 min,25℃)取上清液,采用电感耦合等离子体质谱法测定各上清液中金属离子的浓度。按下列公式计算样品对金属离子的吸附率。
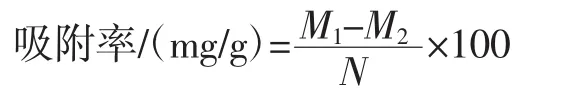
式中:100为反应总体积,mL;M1和M2分别为初始和吸附2 h后的离子质量浓度,g/L;N为样品质量,g。
1.4 数据分析
所有试验均重复3次,结果以平均值±标准差表示。数据结果采用Statistix 9.0软件进行单因素方差分析,并采用最小显著性差异法(least significant difference,LSD)分析平均值之间的差异。
2 结果与分析
2.1 破壁处理对松花粉营养成分的影响
原松花粉和破壁松花粉基本成分含量如表1所示。

表1 破壁处理对松花粉基本成分含量的影响Table 1 Effect of cell wall disruption on content of basic components in pine pollen%
由表1可知,原松花粉和破壁松花粉水分含量分别为6.69%、5.46%,灰分含量分别为4.36%、2.35%,粗蛋白含量分别为11.59%、11.64%,与文献[2]报道的含量接近。破壁松花粉粗脂肪含量显著高于原松花粉粗脂肪含量,这是由于松花粉经过破壁处理后,有机溶剂更易进入花粉细胞内,从而可以提取出更多的脂肪[3]。破壁松花粉的可溶性总糖含量(20.15%)显著高于原松花粉(13.84%),这可能是松花粉经破壁处理后由于比表面积的增加而溶出了更多的总糖,这与高歌[16]对灵芝的研究结果一致。
原松花粉和破壁松花粉膳食纤维含量如表2所示。

表2 破壁处理对松花粉膳食纤维的影响Table 2 Effect of cell wall disruption on dietary fiber of pine pollen%
由表2可知,原松花粉与破壁松花粉的总膳食纤维含量分别为55.16%和54.47%,主要以不溶性膳食纤维为主,不溶性膳食纤维含量分别为53.93%和52.98%。破壁处理对松花粉总膳食纤维、不溶性膳食纤维和可溶性膳食纤维含量无显著影响。
松花粉破壁处理前后的总黄酮、总酚和总三萜含量如表3所示。

表3 破壁处理对松花粉中总黄酮、总酚和总三萜含量的影响Table 3 Effect of cell wall disruption on total flavonoids,phenols,and triterpenes of pine pollen
由表3可知,经过破壁处理后,松花粉中总黄酮、总酚和总三萜含量分别增加了18.6%、30.2%和29.6%,这表明破壁处理后松花粉比表面积增大使酚类物质更易溶出[17],也有文献报道松花粉在加工过程中产生的局部碰撞可能使结合态酚类物质降解释放为游离态,使得总游离态酚含量明显升高[4]。此外,由于总黄酮、总酚和总三萜含量均采用比色法进行测定,样品中的多糖和蛋白质等物质的存在对测定结果有一定的干扰[9]。
松花粉破壁处理前后的可溶性蛋白分子量分布如表4所示。
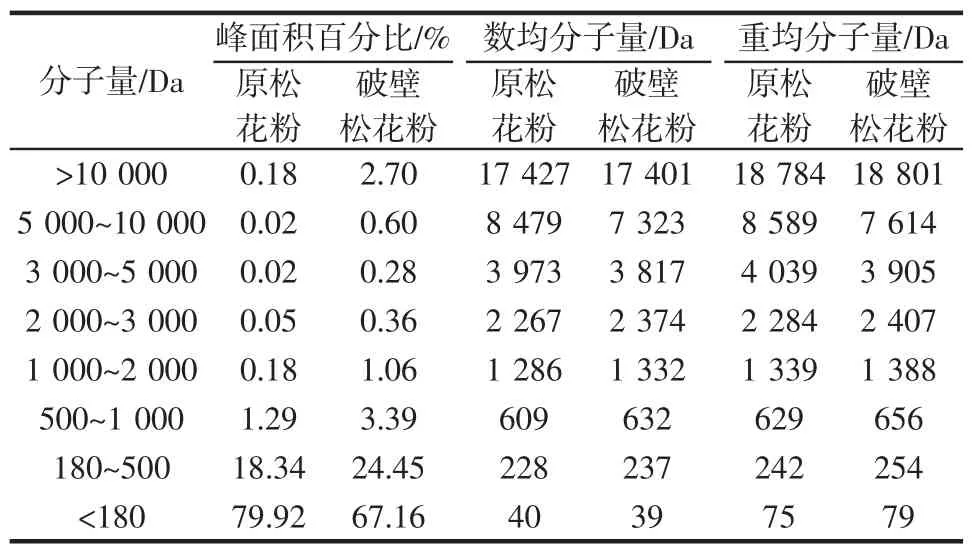
表4 破壁处理对松花粉中可溶性蛋白分子量分布的影响Table 4 Effect of cell wall disruption on molecular weight of soluble proteins in pine pollen
由表4可知,原松花粉和破壁松花粉可溶性蛋白分子量主要以分子量<180Da为主,分子量180Da~500Da次之,经过破壁处理后,松花粉可溶性蛋白分子量<180 Da的占比由79.92%降低为67.16%,分子量在180 Da~500 Da的占比由18.34%升高到24.45%。此外,破壁松花粉中可溶性蛋白分子量>10 000 Da的占比(2.70%)要明显高于原松花粉(0.18%)。松花粉可溶性蛋白中主要以小分子肽段为主,小分子肽具有多种生理活性,如抗氧化性、免疫活性等。
松花粉破壁处理前后的单糖组成如表5所示。

表5 破壁处理对松花粉单糖组成的影响Table 5 Effect of cell wall disruption on monosaccharides of pine pollen%
由表5可知,原松花粉和破壁松花粉中主要以葡萄糖(73.99%~75.51%)和鼠李糖(14.36%~14.78%)为主,破壁处理对松花粉单糖组成影响较小。有文献报道松花粉中主要以葡萄糖(69.17%)、阿拉伯糖(10.43%)和木糖(5.63%)为主[18],荞麦花粉主要以阿拉伯糖(45.30%)和半乳糖(36.80%)为主[19],玉米花粉中以葡萄糖(67.3%)、半乳糖(22.32%)和阿拉伯糖(10.33%)为主[20],这些含量差异主要与花粉品种、产地、生长条件、采后贮藏时间和贮藏环境等因素有关。本研究中松花粉葡萄糖占比要明显高于其他花粉中葡萄糖占比。
2.2 破壁处理对松花粉理化性质的影响
松花粉中含有丰富的膳食纤维,而膳食纤维具有多种理化特性,如持水力、持油力、阳离子交换能力、胆固醇吸附能力、亚硝酸盐清除能力和金属离子吸附能力等。尽管破壁处理前后松花粉中膳食纤维含量并未有明显变化,但破壁处理前后松花粉形态及结构发生较大改变[4],这可能极大影响着松花粉的上述理化特性。
松花粉破壁处理前后的持水力和持油力如表6所示。

表6 破壁处理对松花粉持水力和持油力的影响Table 6 Effect of cell wall disruption on water-holding capacity and oil-holding capacity of pine pollen g/g
持水力与样品的水化性能相关。样品的微粒大小、加工条件、表面特性等极大影响着样品的持水力[15,21]。由表6可知,破壁松花粉的持水力显著强于原松花粉(P<0.05)。
持油力可用来简单模拟样品吸收脂肪的能力,具有高持油力的样品可以减少其在加工过程中脂肪的流失,还可以在肠道中吸附脂类从而降低血清中胆固醇的含量[21-22]。由表6可知,除对大豆油持油力没有明显影响外,破壁松花粉的玉米油、花生油和菜籽油持油力均显著强于原松花粉(P<0.05)。样品的持油力与样品的表面特性、电荷密度、微粒疏水性息息相关[21]。受样品粒子的表面性质和疏水性质的影响,理论上,比表面积大的粒子对油性成分的吸收率更强[23]。
松花粉的阳离子交换能力、胆固醇吸附能力和亚硝酸盐清除能力如表7所示。

表7 破壁处理对松花粉阳离子交换能力、胆固醇吸附能力和亚硝酸盐清除能力的影响Table 7 Effect of cell wall disruption on cation exchange capacity,cholesterol-adsorbing capacity,and nitrite-scavenging capacity of pine pollen
由表7可知,破壁松花粉的阳离子交换能力显著强于原松花粉(P<0.05),这是由于松花粉经过破壁处理后其粒径减小、比表面积增大,松花粉表面所带的羧基与羟基等官能团裸露[24]。原松花粉和破壁松花粉的胆固醇吸附能力分别为12.24 mg/g和13.78 mg/g,未见明显差异。样品表面的正负电荷所产生的排斥力或吸引力极大影响了纤维样品与胆固醇的结合力,从而影响其胆固醇吸附能力[12]。
破壁松花粉亚硝酸盐清除能力显著强于原松花粉,这种差异可能是由于样品暴露出不同种类和数量的羧基、羟基等官能团[13]。以纤维素、半纤维素和木质素为主要成分的不溶性膳食纤维可从消化道吸收水分,减少排泄物在肠道的停留时间,增加粪便的体积,从而减轻或者预防便秘;而可溶性膳食纤维在吸水后黏度增大,可延长胃排空的时间[25-26]。
破壁处理对松花粉金属离子吸附能力的影响如表8所示。
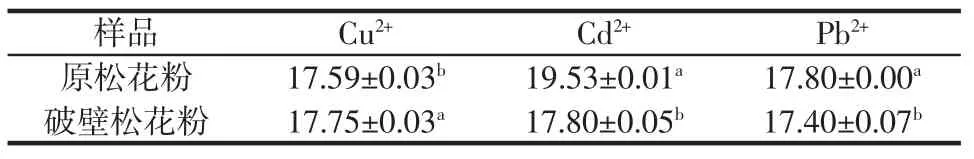
表8 破壁处理对松花粉金属离子吸附率的影响Table 8 Effect of cell wall disruption on metal ion-adsorbing capacity of pine pollen mg/g
高含量膳食纤维的破壁松花粉由于其具有比表面积大、表面粗糙、结构疏松等特点,可能具有良好的金属离子吸附特性,如吸附Cu2+、Cd2+、和Pb2+等重金属离子。由表8可知,破壁松花粉对Cu2+的吸附能力显著强于原松花粉,而原松花粉对Cd2+和Pb2+的吸附能力显著强于破壁松花粉。各个样品的结构与成分的不同是其对金属离子吸附能力不同的主要原因,样品与金属离子间的物理、化学和分子间相互作用决定样品的吸附能力[27]。
3 结论
本文研究了破壁处理对松花粉营养成分及理化特性(包括持水力、持油力、阳离子交换能力、胆固醇吸附能力、亚硝酸盐清除能力和金属离子吸附能力)的影响。结果表明:经过破壁处理后,松花粉具有更高含量的粗脂肪和可溶性总糖;膳食纤维含量无显著变化;总黄酮、总酚和总三萜含量分别增加了18.6%、30.2%和29.6%;可溶性蛋白分子量<180 Da的占比降低,分子量在180 Da~500 Da的占比升高;单糖组成无明显变化。破壁松花粉的持水力、持油力、阳离子交换能力和亚硝酸盐清除能力明显强于原松花粉;破壁处理对松花粉胆固醇吸附能力无显著影响,但对不同金属离子吸附能力具有一定的影响,其中破壁松花粉相比于原松花粉对Cu2+吸附能力增强,而对Cd2+和Pb2+吸附能力减弱。从以上结果可以发现,松花粉经过破壁处理后其中的主要营养和功能成分溶出较多、含量明显增加,大部分理化性质明显提高,这可为松花粉的加工处理与开发利用提供支持。
