原发性肝脏神经内分泌肿瘤42例临床分析
2023-02-17彭联威施长鹰张向化周华邦伍路张蜀豫张彩虹
彭联威,施长鹰,张向化,周华邦,伍路,张蜀豫,张彩虹
(中国人民解放军海军军医大学第三附属医院 肝外四科,上海 201805)
神经内分泌肿瘤(neuroendocrine neoplasm,NEN)是一组来源于神经内分泌系统的异质性肿瘤,其发病率较低,占全部恶性肿瘤的比例不到1%,多见于消化道及胰腺[1]。近年来,NEN的发病率呈上升趋势[2]。原发性肝脏神经内分泌肿瘤(primary hepatic neuroendocrine neoplasm,PHNEN)极为罕见,国内外均极少有报道[3-4]。PHNEN的诊断主要依赖病理分析,且需排除肝外原发病灶。本文回顾性分析中国人民解放军海军军医大学第三附属医院收治的42例PHNEN患者的临床资料,现报告如下。
1 资料与方法
1.1 一般资料
本组患者共42例,男24例,女18例;年龄29~82岁,中位年龄53.5岁。其中1例既往行胃癌根治术,术后病理示胃腺癌,其余患者均无既往肿瘤病史。消化系统肿瘤WHO分类(2019年)胃肠胰肝NEN分级标准中,根据核分裂象计数及Ki-67的增殖指数,将NEN分为高分化的神经内分泌瘤(neuroendocrine tumor,NET)和低分化的神经内分泌癌(neuroendocrine carcinoma,NEC),其中NET可分为G1、G2和G3级,NEC包括大细胞和小细胞NEC[5]。
1.2 临床表现
26例查体时发现,占比61.9%,其他16例表现为上腹部不适、上腹部包块、乏力、食欲减退、发热等。11例有肝炎病毒感染史,占比16.7%。影像学检查肝脏实性占位31例,肝脏囊实性占位11例。肝脏病灶单发19例,其中肝右叶15例,肝左叶4例;多发23例。巨块型(肿瘤直径>10 cm)13例。伴骨转移2例,门静脉癌栓1例,肿瘤破裂出血1例。中位肿瘤直径为7.6 cm。合并肝硬化的比例为14.3%。所有患者的肝功能Child-Pugh分级均为A级。
1.3 辅助检查
血清神经元特异性烯醇化酶(NSE)、甲胎蛋白(AFP)、糖类抗原19-9(CA19-9)、癌胚抗原(CEA)、CA125及异常凝血酶原(PIVKA)等肿瘤标志物检测;42例均行上腹部CT和(或)MRI增强检查。免疫组化指标包括突触素(Syn)、嗜铬素A(CgA)、NSE、簇分化抗原56(CD56)、肌酸激酶(CK)、CK19、CK7等指标。
1.4 随访
所有患者均获得规律随访,随访开始时间为病理确诊为PHNEN时间,随访截止时间为患者死亡或末次随访时间,均为电话随访,末次随访时间为2022年5月22日。
1.5 统计学处理
用SPSS 26.0软件进行生存分析,计数资料比较采用χ2检验,计量资料比较采用t检验,并用Kaplan-Meier法绘制生存曲线。检验水准a=0.05。
2 结 果
2.1 肿瘤标志物检测
血清:NSE阳性率61.5%(16/26),AFP阳性率7.1%(3/42),CA19-9阳性率为16.7%(7/42),CEA阳性率为14.3%(6/42),CA125阳性率3.8%(1/26),PIVKA阳性率7.5%(3/40);免疫组化:NSE阳性率66.7%(8/12),Syn阳性率73.1%(19/26),CgA阳性率76.2%(16/21),CK阳性率83.3%(5/6),CK7阳性率20%(3/15),CK19阳性率50%(7/14),CD56阳性率78.6%(11/14)(表1)。
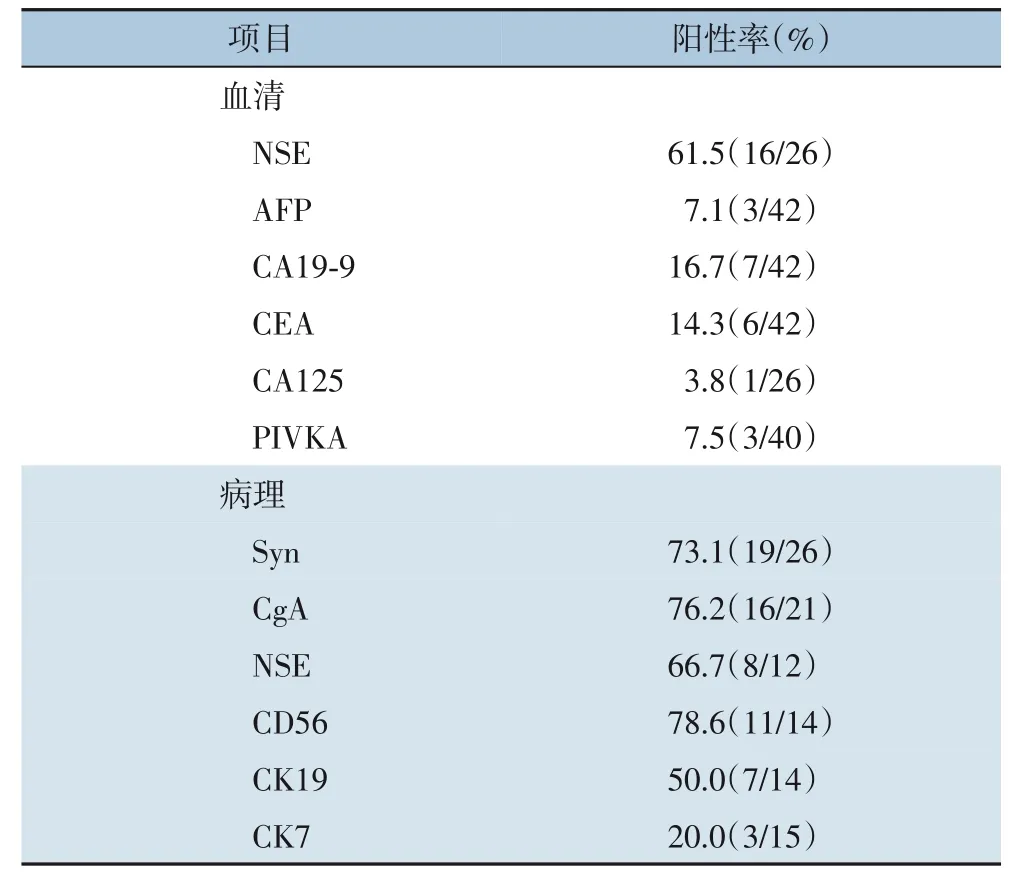
表1 血清与病理免疫组化肿瘤标志物阳性率
2.2 影像学检查
在上腹部CT上常表现为平扫肝内多发大小不等块状结节状稍低密度影,中心区不规则片状液性影及斑片状高密度影,增强动脉期病灶边缘实质部分不均匀强化,门脉及延迟期实质强化部分稍减退(图1)。上腹部MRI上表现为不均质团块状,T2WI高信号,T1WI低信号,DWI呈部分高信号影,动脉期呈不均匀的环状或周边区域强化,门脉期及延迟期呈持续强化(图2)。
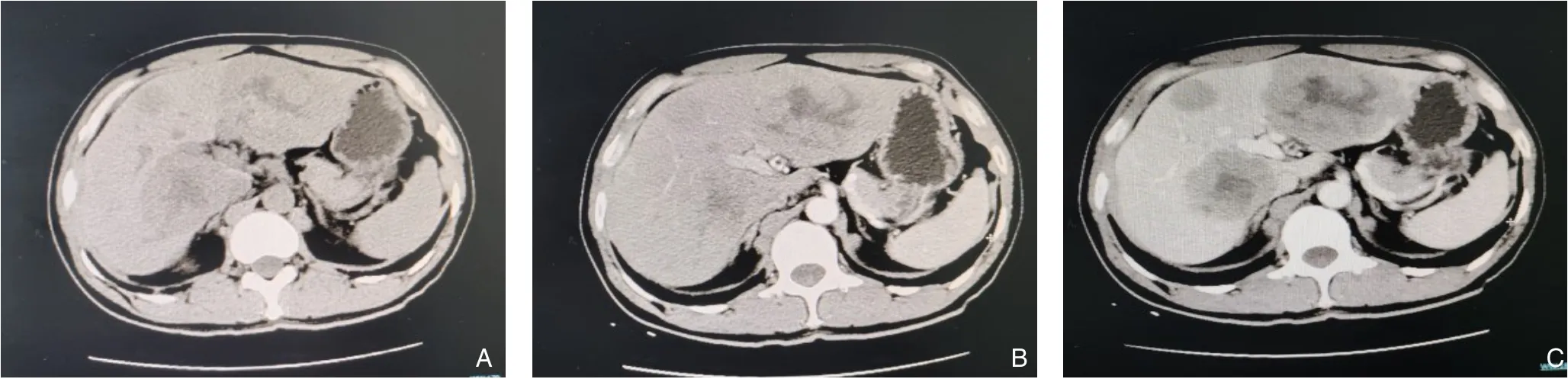
图1 PHNEN患者CT(多发病灶) A:平扫见肝内多发大小不等块状结节状稍低密度影,中心区不规则片状液性影;B:增强动脉期病灶边缘实质部分不均匀强化;C:门脉期实质强化部分稍减退

图2 PHNEN患者术前MRI(单个病灶) A:团块状病灶T1低信号;B:T2WI高信号;C:DWI部分高信号;D:增强动脉期不均匀分割样强化;E-F:静脉期及延迟期持续强化
2.3 治疗与病理结果
27例为切除肝脏标本,15例为肝穿刺活检标本,胃肠镜检查、PET/CT及后续治疗过程中均未发现肝外原发病灶。42例病理均诊断为PHNEN(图3),其中G1级12例、G2级19例、G3级6例、NEC 5例。

图3 术后病理检测 A:病理组织学检查(HE×400);B:CyA免疫组化染色阳性(DAB×400)
2.4 随访情况
所有患者均得到规律随访,随访时间7~116个月。随访期内,手术组(n=27)24例患者出现复发,其中15例在1年内复发。3例复发患者接受再次手术切除,2例复发患者接受微波消融术(microwave ablation,MWA),14例复发患者接受经肝动脉化疗栓塞术 (transcatheter arterial chemoembolization,TACE)。其余复发患者接受放疗,醋酸奥曲肽,依维莫司,化疗等。非手术患者(n=15)的治疗以系统性化疗(11例)或TACE(7例)为主,辅以MWA、醋酸奥曲肽、依维莫司等;2例骨转移均应用唑来膦酸。
2.5 生存情况
手术组的单发肿瘤比例高于非手术组(63.0%vs.13.3%,P=0.003)。手术组和非手术组患者在性别、年龄、有无乙肝、有无肝硬化、AFP、NSE、肿瘤大小和WHO分级上无明显差异(均P>0.05)(表2),27例手术患者平均生存时间(60.78±30.89)个月,15例未手术患者平均生存时间(34.27±21.76)个月,手术患者平均生存时间明显长于未手术患者(P<0.05)(图4A)。G1级平均生存时间为(69.42±33.63)个月,G2级平均生存时间为(53.11±24.70)个月,G3级平均生存时间为(35.33±25.34)个月,NEC平均生存时间为(20.20±17.46)个月。G1、G2级患者的平均生存时间明显长于G3级、NEC患者(均P<0.05)(图4B)。
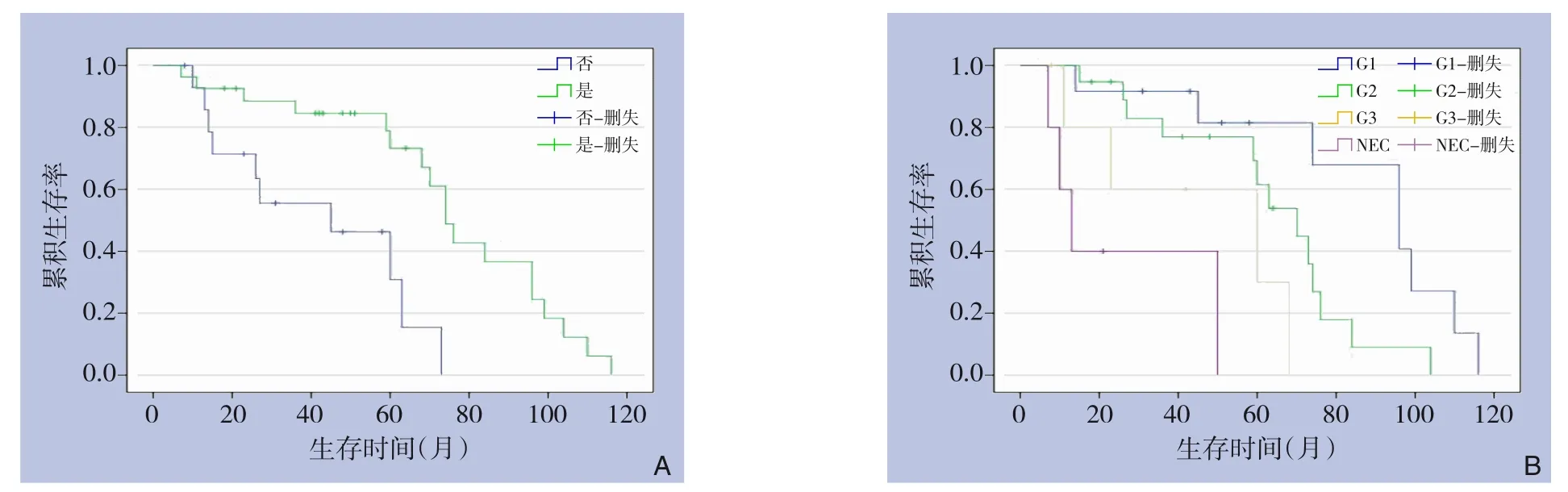
图4 患者生存曲线 A:手术与非手术患者比较;B:不同分级患者比较

表2 手术组与非手术组患者基线特征
3 讨 论
部分NEN患者能够产生生物活性胺或多肽激素[6],根据是否分泌过量激素及患者是否表现激素相关临床症状,分为功能性NEN和无功能性NEN,其中功能性NEN约占20%,如胰岛素瘤、胃泌素瘤、胰高血糖素瘤等[7]。其原发部位多起源于胃肠道、胰腺、阑尾,散发病例亦见于肺、乳腺、肝脏等器官[8]。PHNEN极为罕见,约占所有NEN的0.3%~4%及所有肝肿瘤的1%~5%,可发生在各年龄段[8-9],Zhang等[10]回顾了1975—2016年SEER数据库中获得明确病理诊断的PHNEN患者仅140例。PHNEN最常见的转移部位是肝内转移[11],偶见血管侵犯。远处转移的数据较少,转移部位包括骨和淋巴结等,转移途径和机制不明。本组患者中首次诊断时发现有肝内多发病灶23例(54.8%),骨转移2例,门静脉癌栓1例。PHNEN的临床表现无特异性,大部分患者无明显症状,由查体发现。少部分患者出现消化道症状,可能由于肿瘤压迫周围脏器引发,如上腹部疼痛不适、右上腹包块、腹胀等。极少部分患者可出现类癌综合征[12-13],包括反复腹泻、低血糖、糖尿病、皮肤潮红、难治性消化道溃疡、心律失常等,其原因可能与由于NEN的旁分泌效应有关。本组61.9%患者由查体发现,无任何临床症状,其余患者表现为消化道症状、乏力、食欲减退、发热等,均未出现类癌综合征。另外PHNEN病灶大小不等,单发或者多发,较大病灶易出现囊变、坏死、出血等。
3.1 诊断
PHNEN的实验室及影像学表现具有一定特征,但当前尚无临床诊断标准。此类患者多无肝炎及肝硬化病史,AFP、CA19-9、CEA、CA125及PIVKA等常用消化道肿瘤标志物常为正常水平或轻度升高。本组患者中16.7%有肝炎病毒感染史。HBsAg携带者获得切除的概率更高(37.0%vs.6.7%,P=0.064),提示对肝炎患者的肝癌筛查管理可能有助于PHNEN的早期诊断。血清NSE的阳性率为61.5%,AFP阳性率为7.1%。B超(超声造影)、CT及MRI上多表现为不均质的囊实性病变,具备肝细胞癌或肝内胆管癌的部分特征。肝脏B超常规检查方便快捷,但其检查NEN所得图像的特异性相对较低,鉴别其他肿瘤难度较大,超声造影中PHNEN表现为动脉期高增强,呈现“快进快出”或“同进快出”,且在动脉期病灶强度均高于肝实质,在门脉期和延迟期减退。在CT上常表现为平扫肝内多发大小不等块状结节状稍低密度影,中心区不规则片状液性影及斑片状高密度影,增强动脉期病灶边缘实质部分不均匀强化,门脉及延迟期实质强化部分稍减退[14]。MRI上表现为不均质团块状,T2WI高信号,T1WI低信号,DWI呈部分高信号影,动脉期呈不均匀的环状或周边区域强化,门脉期及延迟期呈持续强化[15]。少部分患者亦可出现门脉期及延迟期廓清征象[16]。本组患者影像学表现大部分呈多发,部分表现为巨块型,与发现该疾病较晚或肿瘤恶性程度较高有关。在PET/CT上的表现与PHNEN的恶性程度有一定关联,G2或G3的PHNEN常表现为高摄取的病灶。PET/CT是排除肝外病灶的重要手段。使用68Ga标记的生长抑素类似物的68Ga-DOTATATE PET/CT被认为优于常用的18F-FDG PET/CT,但尚缺乏高级别的循证医学证据。由于肝脏是NEN最常见的转移部位,故PHNEN的确诊需要病理结果的支持,并排除肝外原发病灶。NSE、CgA、Syn、CD56、CK等标志物对NEN有高敏感度和特异度,免疫组化是当前建立PHNEN病理诊断的重要依据之一。本组患者的免疫组化中,NSE的阳性率为66.7%,Syn的阳性率为73.1%,CyA的阳性率为76.2%,CK的阳性率为83.3%,CD56为阳性率78.6%,这些免疫组化指标的组合对PHNEN的病理诊断具有重要参考价值。Ki-67是反映肿瘤细胞增殖能力的标志,与神经内分瘤的恶性程度、分级和预后相关[17]。一般根据Ki-67表达水平将NEN分为高分化和低分化两大类,高分化的NET分为G1、G2、G3 3个不同的分级,低分化的NEC包括大细胞和小细胞NEC两种类型。本研究中,G3级、NEC患者的预后显著差于G1、G2级患者,提示WHO分类也与PHNEN患者的预后相关,可能也适用于PHNEN患者的分级。
3.2 治疗
手术切除是PHNEN的主要根治性疗法,早期切除效果较好,5年生存率约18.6%~64.7%[6,18]。在积极治疗情况下如果肿瘤仍有进展时,应充分评估利弊,也可考虑是否进行肝移植治疗[19]。对于不可手术切除的PHNEN,临床上常综合使用生长抑素类似物、全身化疗、TACE及放疗等疗法[20]。生长抑素类似物(如奥曲肽)可抑制肿瘤增殖,改善类癌综合征,但不改变肿瘤大小。由于PHNEN血供丰富,常由肝动脉供血,对缺血敏感,对于不可切除肿块伴肝内外转移,TACE治疗效果较好,可使肿瘤缩小。对伴有肿瘤远处转移,可联合全身化疗或放疗。近年来,依维莫司、舒尼替尼、索凡替尼等靶向治疗药物在NEN的治疗上表现出一定疗法,但评估这些疗法在PHNEN患者中的数据尚较有限。本组患者中手术组24例患者出现复发,3例复发患者接受再次手术切除,2例复发患者接受MWA,14例复发患者接受TACE。其余复发患者接受放疗、醋酸奥曲肽、依维莫司、化疗等。非手术组患者的治疗以系统性化疗或TACE为主,辅以微波消融、醋酸奥曲肽、依维莫司等,当前对于不可切除的PHNEN,尚缺乏标准的一线治疗方案。
综上所述,PHNEN的发病率极低,多不伴肝炎病史,临床表现无明显特异性,CT或MRI多表现为不均质的囊实性病变,血清NSE升高有一定诊断价值。确诊依赖病理学,同时应排除肝外原发病灶。手术切除是PHNEN的首选根治性疗法。G3级、NEC患者的预后显著差于G1、G2级患者。对于不可切除的PHNEN,尚缺乏标准的一线治疗方案。
利益冲突:所有作者均声明不存在利益冲突。
