三维可视化技术联合荷瘤门静脉流域分析在腹腔镜解剖性肝切除中的应用
2023-02-17肖亮谭盛米星宇苏文欣莫蕾杨瀚睿周乐杜
肖亮,谭盛,米星宇,苏文欣,莫蕾,杨瀚睿,周乐杜
(中南大学湘雅医院 肝脏外科,湖南 长沙 410008)
解剖性肝切除术(anatomic hepatectomy,AH)最早由日本的幕内雅敏教授系统性提出[1],是以荷瘤门静脉流域为基本单位的肝切除,可称为基于门脉流域的AH(portal vein territory-based anatomic hepatectomy,PT-AH)[2]。随着手术技术的不断进步,腹腔镜解剖性肝切除(laparoscopic anatomical hepatectomy,LAH)已经逐渐成为各大医院的常规手术[3-4],然而,既往有不少报道[5-7]认为,对于肝细胞癌(hepatocellular carcinoma,HCC)患者,AH与非解剖性肝切除(non-anatomic hepatectomy,NAH)相比,并没有显著的肿瘤学获益。但也有学者[8-13]认为AH能够显著延长HCC患者的术后无瘤生存期。导致上述争议的原因,可能是由于以往实施AH常依据传统Couinaud肝脏分段法进行肝段或肝叶切除,可称之为基于Couinaud解剖的AH(Couinaud-AH),而实际上肝脏脉管变异很多,可能有来自邻近肝段的门静脉为肿瘤供血,加之HCC很容易侵犯门静脉导致微血管侵犯(microvascular invasion,MVI)甚至门静脉癌栓(portal vein tumor thrombus,PVTT),这使得单纯的Couinaud-AH可能遗漏了邻近的某支荷瘤门静脉及其流域肝组织,导致肿瘤细胞残留,成为术后早期复发的来源[2,11-15]。近年来,三维(3D)可视化技术在肝脏外科迅速普及,它可帮助外科医师在术前更加直观、充分地了解患者的肝内脉管走行和变异情况,做出最贴合实际的荷瘤门静脉流域分析,指导制定个体化的精准LAH[16]。在本文中,笔者结合临床经验介绍此类术式的实施步骤与体会以及对PT-AH的思考。
1 临床资料
1.1 病例资料
患者1 男,47岁,既往乙肝感染:入院查HBsAg阳性,HBeAb 阳性,HBcAb 阳性,乙肝DNA阳性。AFP:2.47 ng/mL,异常凝血酶原(DCP):22.67 mAU/mL,CA19-9 12.55 U/mL,MRI提示左肝肿块,大小约3 cm×4 cm,考虑HCC(图1A)。临床诊断为HCC CNLC Ia期。
患者2 男,53岁,既往无乙肝病史,入院查HBsAg阴性,HBeAb阴性,HBcAb阳性,乙肝DNA阴 性。AFP:1.47 ng/mL,DCP:306.42 mAU/mL,CA19-9 7.27 U/mL,CT提示右肝低密度灶,大小约8.6 cm×8.1 cm,考虑HCC(图1B)。临床诊断为HCC CNLC Ib期。本研究通过了中南大学湘雅医院伦理委员会批准(批件号:202002023),患者术前签署知情同意书。

图1 患者的影像学资料 A:患者1的肝脏核磁共振图像(肝胆期),可见肿瘤主要位于左内叶,同时接受右前叶肝蒂分支供血;B:患者2的肝脏CT图像,可见肿瘤主要位于右后叶Figure 1 Imaging data of patients A: Liver MRI images (hepatobiliary stage) of patient 1 showing the tumor mainly located in the left medial lobe, with blood supply from the hepatic pedicle branch of the right anterior lobe; B: Liver CT images of patient 2 showing that the tumor mainly located in the right posterior lobe
1.2 3D可视化荷瘤门脉流域分析
采集患者CT或MRI数据通过专业软件(VitaWorks,上海)进行肝脏3D重建及荷瘤门脉流域分析,发现患者1的肿块累及左内叶及右前叶,主要由IVb段门脉(P4b)和V段腹侧门脉第一支(P5v1)供血,流域分析证实,切除P4b和P5v1门静脉流域后,可完全覆盖肿瘤,且预计切缘超过1 cm(图2),遂决定行针对上述门脉流域的腹腔镜下PT-AH。患者2的肿块位于右后叶,累及整个Ⅵ段和Ⅶ段腹侧。主要由右后区门脉第一支(PPa)和第二支(PPb)供血,流域分析证实,切除PPa和PPb门静脉流域后,可完全覆盖肿瘤,且预计切缘超过1 cm(图3),遂决定行针对上述门脉流域的腹腔镜下PT-AH。
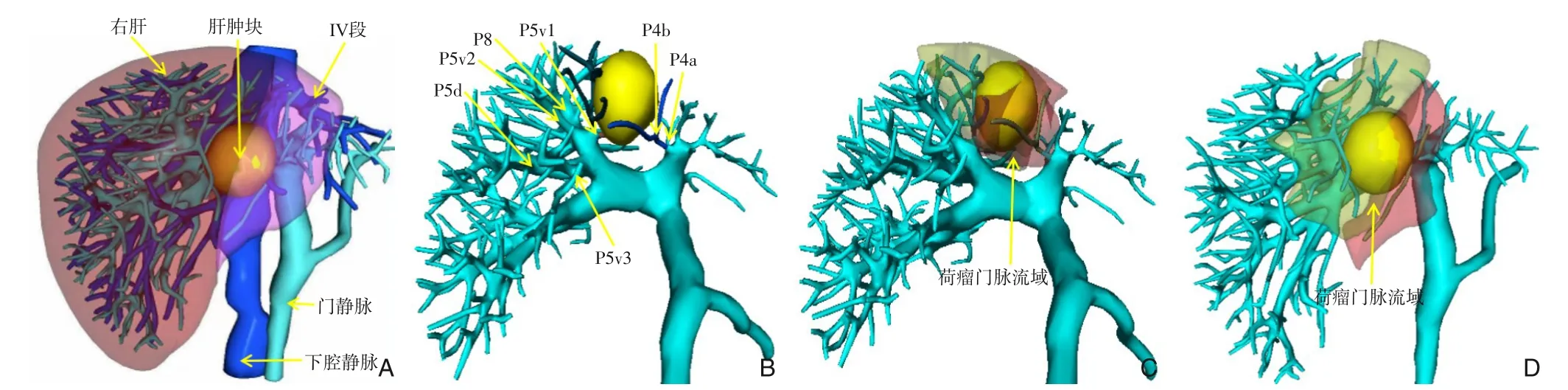
图2 患者1的肝脏3D成像及流域分析 A:肿瘤累及肝脏左内叶及右前叶;B:肿瘤由IVb段门脉(P4b)和V段腹侧门脉第一支(P5v1)供血;C-D:流域分析证实,切除P4b和P5v1门静脉流域后,可完全覆盖肿瘤,且预计切缘超过1 cmFigure 2 3D imaging of the liver and tumor-bearing portal territory analysis of patient 1 A: The tumor is located in the left medial lobe and right anterior lobe of the liver; B: The tumor is supplied by the portal vein of segment Ⅳb (P4b) and the first ventral portal vein of segment V (P5v1); C-D: Territory analysis confirms that the tumor can be completely covered after resection of the P4b and P5v1 portal vein territory, and the resection margin is expected to exceed 1 cm

图3 患者2的肝脏3D成像及流域分析 A:可见肿瘤累及肝脏Ⅵ、Ⅶ段;B:肿瘤由右后区门脉第一支(PPa)和第二支(PPb)供血;C-D:流域分析证实,切除PPa和PPb门静脉流域后,可完全覆盖肿瘤,且预计切缘超过1 cmFigure 3 3D imaging of the liver and tumor-bearing portal veins territory analysis of patient 2 A: The tumor is located in the segments Ⅵ and Ⅶ; B: The tumor is supplied by the portal veins of the first (PPa) and second (PPb) branch of the right posterior lobe; C-D: Territory analysis confirms that the tumor can be completely covered after resection of the PPa and PPb portal vein territory, and the resection margin is expected to exceed 1 cm
1.3 麻醉及手术方法
体位与麻醉:患者仰卧位,气管插管下全麻,切肝过程中采用低中心静脉压技术(0~5 cmH2O)(1 cmH2O=0.098 kPa)[17-19]。手术步骤:5孔法布置Trocar[20],建立气腹,探查确认肿块位置,排除腹腔内转移。必要时离断肝圆韧带、镰状韧带。间歇性阻断第一肝门,阻断15 min松开5 min[21]。
对于患者1,腔镜下超声定位肿块外周1 cm左右边界(图4A)。将胆囊与肝脏Laennec膜分离以便显露右肝蒂[22]。沿右前叶肝蒂左侧解剖出P5v1(图4B)后在根部予以暂时性阻断,恢复入肝血流,发现肝脏表面缺血范围和腔镜超声定位的肿瘤右侧边界基本一致,用电钩标记此缺血分界线即右侧切除线(图4C)。用超声刀沿镰状韧带右侧(左侧切除线)向第一、二肝门方向解剖肝实质,遇P4b予Hamolok夹闭后于根部离断(图4D)。再沿此线离断肝实质及该区域引流肝静脉,直至两侧切面汇合,将肝肿块完整切除,创面显露V段腹侧门脉第二支(P5v2)及Ⅷ段门脉(P8)(图4E)。术后剖检标本,肿瘤切缘>1 cm(图4F)。对于患者2,用超声刀沿Rouvier沟解剖出PPa(图5A),暂时性阻断后恢复入肝血流,发现肝脏腹侧缺血范围和术前3D流域分析一致,电钩标记V段和Ⅵ段分界线(图5B)。继续沿此线解剖肝实质,直至显露PPb(图5C),暂时性阻断后恢复入肝血流,电钩标记肿块背侧切除线(图5D),再沿此线离断肝实质及该区域引流肝静脉,直至两侧切面汇合,将肝肿块完整切除(图5E)。术后剖检标本,肿瘤切缘>1 cm(图5F)。于右膈下和/或肝创面放置腹腔引流管,从右侧Trocar孔引出体外后缝合固定于皮肤。

图4 患者1术中照片 A:腔镜下超声定位肿块外周1 cm边界;B:沿右前叶肝蒂左侧解剖出P5v1后在根部予以暂时性阻断,恢复入肝血流;C:用电钩标记此肝表面缺血分界线即右侧切除线;D:用超声刀沿镰状韧带右侧(左侧切除线)向第一、二肝门方向解剖肝实质,遇P4b予Hamolok夹闭后于根部离断;E:沿此线离断肝实质及该区域引流肝静脉,直至两侧切面汇合,将肝肿块完整切除,创面显露V段腹侧门脉第二支(P5v2)及Ⅷ段门脉(P8);F:术后剖检标本,肿瘤切缘>1 cmFigure 4 Intraoperative photos of patient 1 A: Laparoscopic ultrasound location of the outer boundary of the tumor extending 1 cm beyond the tumor; B: Dissection of the P5v1 along the left side of the liver pedicle of right anterior lobe and temporary blockage at its root before restoring the hepatic blood flow; C: Marking the ischemia line on the liver surface as the right resection line using an electric hook; D: Dissection of the liver parenchyma along the right side of the sickle ligament (left excision line) and toward the first and second hepatic hila using an ultrasound scalpel, and division of the P4 after clipping at its root using Hamoloks; E: Further dissection of the liver parenchyma along the ischemia line until the confluence of the two sections, complete removal of the liver tumor and the hepatic veins draining this territory, and exposure of the second branch of the ventral portal vein of segment V (P5v2) and the portal vein of segment Ⅷ (P8) on the cut surface; F: Postoperative autopsy specimen revealing the resection margin >1 cm

图5 患者2术中照片 A:用超声刀沿Rouvier沟解剖出PPa;B:暂时性阻断PPa后恢复入肝血流,电钩标记V段和Ⅵ段分界线;C:继续沿此线解剖肝实质,直至显露PPb;D:暂时性阻断PPb后恢复入肝血流,电钩标记肿块背侧切除线;E:沿此线离断肝实质及该区域引流肝静脉,直至两侧切面汇合,将肝肿块完整切除;F:术后剖检标本,肿瘤切缘>1 cmFigure 5 Intraoperative photos of patient 2 A: Dissection of the PPa along the Rouvier's groove using an ultrasonic scalpel;B: Restoration of the hepatic blood flow after temporary blockage of the PPa, and marking the line between segments V and Ⅵ using an electric hook; C: Further dissection of the liver parenchyma along this line until exposure of the PPb;D: Temporary blockage of the PPb before restoring the hepatic blood flow, and marking the dorsal resection line of the mass using an electric hook; E: Further dissection of the liver parenchyma along the ischemia line until the confluence of the two sections, and then complete removal of the liver tumor and the hepatic veins draining this territory; F: Postoperative autopsy specimen revealing the resection margin >1 cm
1.4 术后观察与治疗
术后密切监测患者生命体征及腹部体征,引流液性状及引流量。手术当天、术后第1天和术后第3天复查血常规,肝肾功能电解质,凝血功能,如有异常,及时处理。于术后第3天(患者已恢复饮食)和第4天分2次留腹水标本检查总胆红素(大于血清总胆红素3倍为胆汁漏)以排除胆汁漏。常规给予抗病毒、抗感染、护肝等治疗。
2 结 果
2.1 术中及术后恢复情况
患者1手术时间为150 min,术中出血量约为100 mL。患者2手术时间为230 min,术中出血量约为200 mL。两例患者术后第1天进食流质,第2天下床活动,术后第3天肠道功能恢复,恢复正常饮食,未发生腹腔内大出血或胆汁漏等并发症。术后第5天均拔除腹腔引流管后出院。
2.2 病理结果
患者1:高分化HCC(1个肿块,大小约3.4 cm×3 cm×2.8 cm),未见卫星结节,未见微血管侵犯(M0),未见神经侵犯,切缘阴性,癌旁组织肝纤维化改变。患者2:高分化HCC(1个肿块,大小约8.5 cm× 6.8 cm×6 cm),未见微血管侵犯(M0),切缘阴性,癌旁组织肝纤维化改变。
2.3 随访
2例患者均使用槐耳颗粒[23]预防肿瘤复发,患者1出院后继续抗乙肝病毒治疗。患者1随访8个月,患者2随访6个月未见肿瘤复发,一般状况良好。
3 讨 论
HCC是严重危害我国人民群众生命健康的重大疾病。据统计,它是我国第五大常见癌症和第二位致死癌种,2020年我国HCC的新发病例超过41万例,死亡超过39万例,接近全球新发和死亡病例的一半。提高HCC患者的长期生存率是医务工作者为之不懈奋斗的目标。
尽管近年来多种新型抗肿瘤药物取得了较好的临床疗效,极大地提高了晚期HCC患者生存期,HCC的治疗仍然是以手术为中心的综合治疗。特别是对于CNLC Ia~Ⅱa[24],甚至部分CNLC Ⅱb期患者,根治性手术切除是治疗首选,其疗效优于传统的介入治疗[25-28]。另外,由于HCC的侵袭性很强,肿瘤细胞很容易侵入门静脉,导致肝内的播散或术后早期复发。有研究[29]发现,即便是直径不超过2 cm的小HCC,MVI的发生率也高达26.5%。如果MVI继续发展,则可能进展为影像学可见的PVTT,此类CNLC Ⅲa期患者已不适合首选手术切除,而推荐先行局部(介入、放疗)联合全身治疗(靶向、免疫治疗)以达到转化切除、改善预后的目的[30]。
基于以上共识,外科医师在HCC患者的治疗过程中仍扮演着核心角色。对于HCC的根治性手术切除方式,早在20世纪,日本的幕内雅敏教授就创新性地提出了AH的理念:即系统性地沿门静脉将一个肝段及其所属门静脉分支支配的区域连同动脉等一并切除。包括肝叶,肝段和亚肝段的切除。AH主要包括4个步骤:⑴ 通过血流阻断或染色法标记肝表面的肝段边界;⑵ 超声引导下以该肝段标志性静脉为边界进行肝实质离断;⑶ 肝断面暴露具有重要意义的肝静脉;⑷ 肝蒂根部结扎Glisson系统。笔者认为,该理念实际上是PTAH。该术式的理论优势在于切除了肿瘤的门静脉引流区域,尽最大可能清除了MVI甚至PVTT,消除了术后早期复发的根源,是最可能使患者获得最大肿瘤学获益的根治性术式。
然而,在既往的临床实践中,有不少学者[5-7]报道AH相对于NAH在肿瘤学方面并没有显著性优势。笔者认为导致上述现象的原因可能是:⑴ 在早期实施PT-AH时,由于技术条件的限制,术前通常只能获得二维的影像学图片,临床医师难以全面地分析支配肿瘤的全部门静脉分支及其引流区域,尤其当肿块累及相邻2个肝段,术中可能遗漏邻近肝段而来的某支供应肿瘤的门脉分支及其引流区域中的MVI。⑵ 既往行解剖性的肝叶或肝段切除,往往依据的是传统的Couinaud肝脏分段法,很少行联合荷瘤肝脏亚段的切除,因此,以往实施的AH实际上是Couinaud-AH而非PT-AH。而随着对肝内脉管解剖研究的不断深入,人们逐渐发现,肝内的脉管结构在不同患者中往往有很大的变异,甚至可以说没有两个完全相同的肝内脉管走行。按照传统的Couinaud肝脏分段法往往难以达到PT-AH的要求。例如,笔者曾行1例解剖性Ⅵ段切除,在Rouvier沟中解剖出“Ⅵ段”肝蒂并阻断后,发现真正缺血肝脏的是V段背侧[20]。这充分说明术前有必要对荷瘤门静脉作出精准分析和定位,不能拘泥于依靠传统的Couinaud肝脏分段法实施单一的肝段切除。⑶ AH要求肝断面暴露有重要意义的肝静脉,而既往术中低中心静脉压和手术技巧的限制或不完善,术中暴露肝静脉使得AH可能伴随更多的出血,随之而来的术中输血可能降低患者免疫力,在某种程度上促进了术后肿瘤早期复发。因此,笔者认为要真正实现精准的PTAH,有赖于更为精准的术前荷瘤门静脉流域分析。实际上,随着科技水平的进步,目前肝脏3D可视化成像技术已经颇为成熟和普及,给临床带来了极大的便利。关键在于肝脏外科医师能真正转变观念,将其应用到HCC的术前荷瘤门静脉流域分析中,充分发挥它的优势,尽快将腹腔镜肝切除的术式由Couinaud-AH向PT-AH转变。
当然,有学者会提出,患者1为什么不做中肝叶切除,患者2为什么不做右半肝切除,这样安全切缘更大,残留MVI的可能性更小。这是另外一个值得探讨的问题,要实施多大范围的AH才足够?亚段、肝段、肝叶、半肝、肝三叶甚至从广义上讲,全肝切除(肝移植)都是AH,而且肝移植是极致的AH。尽管有大量的报道认为肝移植的远期肿瘤学疗效优于单纯AH,但显然,临床上不可能让所有的患者都接受肝移植(供体来源受限),即使是肝移植,仍然不能杜绝术后的HCC复发。
那么,一个兼顾肿瘤学获益和术后肝功能恢复的AH平衡点在哪里?笔者认为,董家鸿教授提出的“精准肝切除”理念能较好地解决这一问题,该理论以“最大化清除病灶、最大化肝脏保护、最小化创伤侵袭”为核心,即并不强调一味扩大手术范围。目前,临床证据显示,距离肿瘤1 cm以上切除较1 cm以下切除更有利于减低肿瘤复发率,延长患者的长期生存[31-33]。因此,距离肿瘤至少1 cm是较为公认的安全切缘。基于以上研究和治疗理念,笔者认为,满足至少1 cm的安全切缘的PT-AH就已足够。反之,如术前3D规划预测切除荷瘤门脉流域后不能满足1 cm安全切缘,则需要纳入邻近1~2支门脉引流区域,适当扩大切除范围以满足切缘要求。在此基础上,如果患者的肝功能和残肝体积足够,为增加手术实施的便利性或获得更好的肿瘤学疗效,可以考虑适当扩大AH的范围:例如同时累计V、Ⅷ段可选择右前叶切除(如肿块靠近中肝静脉可联合左内叶切除,如靠近右肝静脉会考虑右半肝切除),如同时累计Ⅵ、Ⅶ段可考虑右后叶切除(如肿块靠近右肝静脉可联合右前叶背侧切除)。但是,具体扩大多少最为恰当,目前没有定论,还有待更多临床随机对照研究的探讨。目前还缺少有效的手段能够在术前或术中明确距离肿块多远能够完全清除MVI。另外,扩大手术范围必然带来更大的手术创伤,甚至增加出血、胆汁漏等并发症发生的风险,影响患者的术后恢复。
本研究的2例患者,实施了兼顾术后肝功能恢复的及最小安全切缘(1 cm)的最小范围PT-AH,近期效果好,患者恢复快,并发症少,目前随访未见肿瘤复发,远期效果有待进一步观察。笔者认为此类PT-AH对于需要保留更多肝实质的肝功能欠佳患者尤其具有借鉴意义。笔者单位的PT-AH实施步骤如下:⑴ 开具高质量的二维影像学检查,如(普美显)肝脏核磁共振平扫增强;⑵ 尽量使用MRI(除非体内有金属成分不能行MRI检查)影像学数据进行肝脏3D重建(MRI敏感性优于CT);⑶ 在3D软件上进行HCC的荷瘤门静脉流域分析,确定能达到1 cm安全切缘的最小PT-AH范围;⑷ 如HCC靠近重要门静脉或肝静脉分支(如左、右肝蒂或肝静脉主干),则需扩大切除范围,如行肝叶或半肝切除;⑸ 计算残肝体积是否达标准肝体积的40%以上,如残肝体积不足,需调整切除范围(或行术前门静脉栓塞,待保留侧肝脏增生达标后再手术);⑹ 术中腔镜超声定位距离肿块1 cm安全边界。全入肝血流阻断下(可减少出血)解剖出目标肝蒂予以暂时性阻断(大钛夹夹闭,注意力度适中,减少血管损伤),观察肝表面缺血范围是否符合术前规划;⑺ 按照缺血线离断肝实质,肝脏断面显露具有重要意义的肝静脉;⑻ 由于肝内解剖平面较之肝表面更难把握,断肝过程中可使用荧光反染技术协助判断肝内离断平面;⑼ 充分显露各支荷瘤肝蒂后在根部离断。
总之,笔者认为,在精准肝脏外科时代,3D可视化技术联合荷瘤门静脉流域分析在HCC患者LAH中具有重要的应用价值和前景,关键在于外科医师尽快将AH从传统的Couinaud-AH向PT-AH理念转变。当然,其远期肿瘤学效果值得更多临床研究的证实。
利益冲突:所有作者均声明不存在利益冲突。
