远隔缺血预处理对肝切除术患者干预效果的系统评价与Meta分析
2023-02-17田春王爱华高苑淞邓小红
田春,王爱华,高苑淞,邓小红
(1.重庆医科大学附属永川医院 麻醉科,重庆 402160;2. 重庆市永川区人民医院 重症医学科,重庆 402160)
2020年全球癌症监测数据[1]显示,肝癌发病率居全球恶性肿瘤第5位(发病率为9.5/10万),病死率却居所有恶性肿瘤第3位(病死率为8.7/10万)。目前,肝切除术仍是治疗原发性和继发性肝癌最基础有效的治疗方法,特别是对于早、中期局限性肝癌患者,可以将肿瘤完全切除而明显改善预后[2-3]。随着现代医学的发展,精准肝切除术日益成熟,但对麻醉和围术期管理也提出了更高要求[4]。在肝切除术中,外科医师和麻醉医师常分别借助入肝血流阻断(Pringle手法)和限制性液体输入策略来实现控制性低中心静脉压(control low central venous pressure,CLCVP)状态,最终达到提供清晰手术视野和有效减少术中出血量的目的[5]。但上述策略往往会显著降低患者肝实质离断之前肝组织的灌注及氧合,引起残余肝脏的肝缺血-再灌注损伤 (hepatic ischemia-reperfusion injury,HIRI)[6]。
HIRI是肝切除术的主要并发症,也是导致术后肝功能衰竭的主要原因之一[7]。HIRI主要通过激活肝Kupffer细胞、肝窦内皮细胞、肝星状细胞等释放大量炎症介质引发一系列炎症级联反应,进而导致肝细胞凋亡和坏死[6]。同时,肝切除术患者常伴有肝脂肪变性、肝硬化、肝功能受损等,围术期发生HIRI的风险会更高,更易导致患者预后不良甚至死亡[8-9]。因此,采取适当的保护性预防策略降低HIRI可以促进肝切除患者术后肝功能恢复,改善患者预后和生活质量。近年来,大量的动物实验[6,9-11]已证实远隔缺血预处理(remote ischemic preconditioning,RIPC)可显著改善肝切除术后残余肝早期的组织灌注和氧合作用,减少HIRI,改善手术预后,提高生存率。然而,在临床研究中关于RIPC减少HIRI的作用仍存在争议[12]。因此,本研究通过系统回顾已发表的中英文文献,旨在评价RIPC在肝切除术中的有效性和安全性。
1 资料与方法
1.1 文献检索策略
计算机检索Cochrane Library、PubMed、OVID、EMBASE、CBM、CNKI、VIP、万方等文献数据库,检索时间段为建库至2022年5月。中文检索词包括:远隔缺血预处理、远端缺血预处理、缺血预处理、肝切除术、肝脏手术、随机对照试验;英文检索词包括:Remote Ischemic Preconditioning、Ischemic Preconditioning、 Hepatectomy、 Liver Resection、Randomized Controlled Trial、RCT。同 时在临床研究论文或综述的参考文献中追踪查阅相关文献。必要时邮箱联系原研究者,获取相关文献或数据资料。
1.2 文献纳排标准
纳入标准:⑴ 研究对象为成人,年龄>18岁且均为肝脏部分切除术患者;⑵ 分组包括RIPC组和对照组;⑶ 研究类型仅包括RCT,出版物状态不限;⑷ 研究结局指标包括:丙氨酸氨基转移酶(alanine transaminase,ALT)、天门冬氨酸氨基转移酶(aspartate transaminase,AST)、总胆红素(total bilirubin,TBIL)、白蛋白(albumin,ALB)、手术时间、术中出血量、住院时间、主要手术并发症(术后切口感染、胆汁漏、腹腔内出血、肺部并发症)等;⑸ 同一研究团队的重复研究,选取最新和最完整的研究。排除标准:⑴ 非RCTs、无对照组的临床试验、回顾性或单组设计的研究;⑵ 对细胞系或动物进行实验研究;⑶ 儿童或孕妇研究;⑷ 肝移植手术受体患者;⑸ 案例报告、评论、Meta分析和综述研究;⑹ 无法获得原文或准确提取数据的研究。
1.3 原始文献筛选方法及数据提取
首先由2名研究人员独立筛选文献和数据提取。文献筛选过程中,如意见分歧,双方讨论解决,必要时请第三方(项目负责人)仲裁。数据提取内容包括:⑴ 文献一般情况,包括标题、作者、国家或地区、发表年份等;⑵ 研究纳入患者数、患者年龄、性别、干预措施等基本特征;⑶ 结局指标,包括术前及术后肝功能指标、手术时间、术中出血量、住院时间、主要手术并发症等。
1.4 质量评价
纳入的RCT采用Cochrane协作网推荐的偏倚风险评估表来进行评价,偏倚风险评估表内容包括随机序列的产生、分配隐藏、入选者的盲法、结果评估的盲法、结果数据不完整、选择性报告、其他偏倚共7项。每个项目的风险被分为高、低或不明确的偏差风险。
1.5 统计学处理
采用Cochrane协作网提供的RevMan 5.3统计软件进行分析。计量资料选择加权均数差值(weight mean difference,WMD),计数资料选择比值比(odds ratio,OR)为合并统计量,各效应量均以95%可信区间(confidence interval,CI)表示。异质性检验结果P≥0.05或I2≤50%时代表研究异质性低,采用固定效应模型分析;异质性检验结果P<0.05或者I2>50%时,代表研究异质性高,采用随机效应模型分析;同时分析原因,进行亚组分析或敏感度分析,若无法进行Meta分析,则进行描述性分析。采用漏斗图评估发表偏倚。P<0.05为差异有统计学意义。
2 结 果
2.1 纳入研究描述
初检获得相关文献805篇。去除重复文献后为667篇,阅读标题及摘要后33篇进入全文筛选。同一研究团队重复研究2篇,全文数据不全9篇,缺少对照组文献11篇,最终纳入研究文献11篇(包括中文5篇、英文6篇)[13-23],共851例患者,RIPC组422例,对照组429例。11项纳入研究的基本特征无统计学意义。文献筛选流程图见图1,纳入研究的基本情况见表1。纳入研究的风险偏倚评估表见图2。

图1 文献筛选流程图Figure 1 The literature screening process
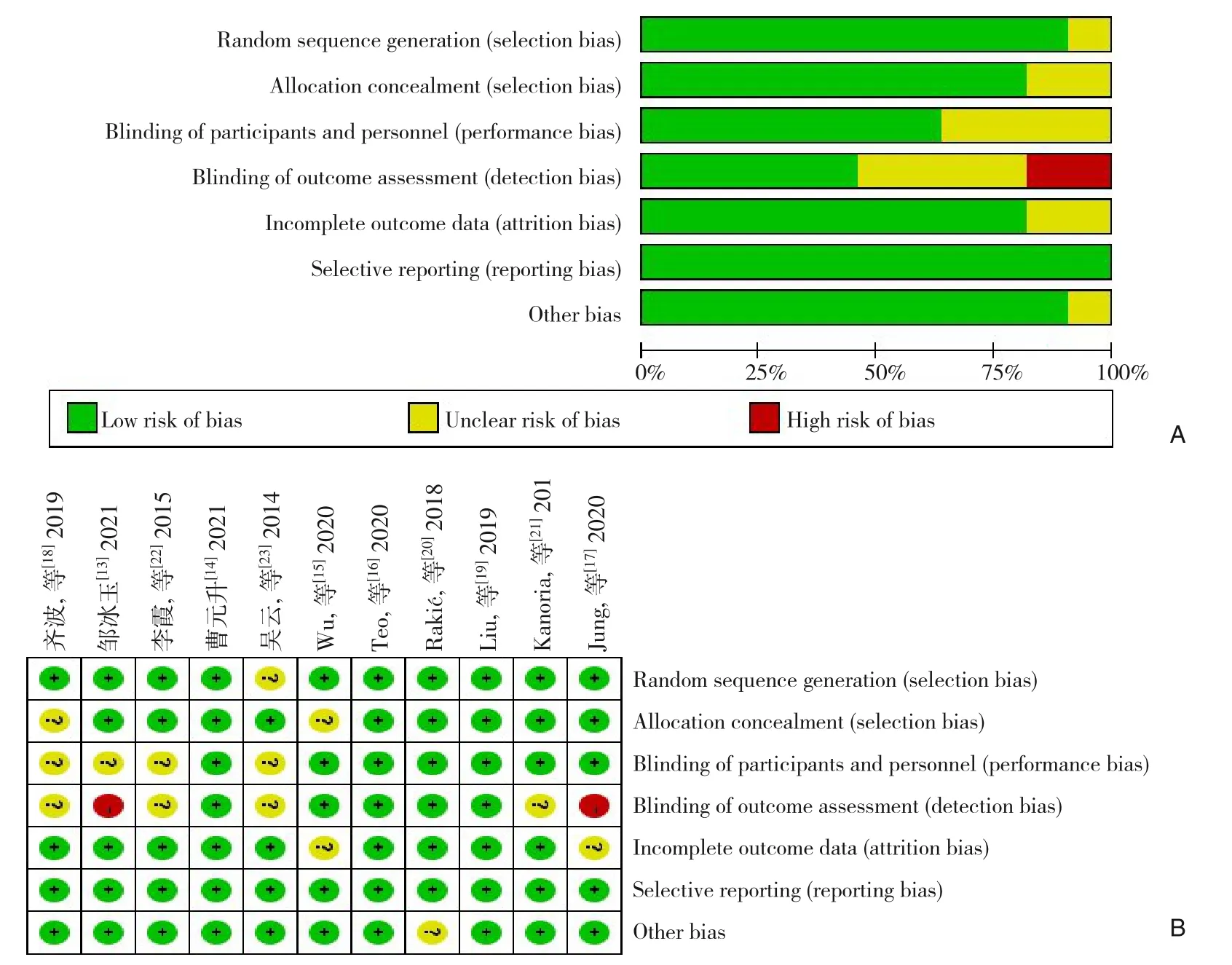
图2 纳入研究的风险偏倚评估表 A:风险偏倚图;B:风险偏倚汇总Figure 2 Assessment of risk of bias of the included studies A: Risk of bias graph; B: Risk of bias summary

表1 纳入文献的基本特征Table 1 The baseline characteristics of the included studies
2.2 Meta分析结果
2.2.1 ALT水平 9项研究[13-19,22-23]报告了手术前ALT水平,各研究结果间异质性无统计学意义(P=0.53,I2=0%),故采用固定效应模型进行Meta分析。结果显示,两组患者术前ALT水平无统计学意义(WMD=-0.17,95%CI=-1.49~1.16,P=0.81)(图3)。11项研究[13-23]报告了术后第1天ALT水平,6项研究[13,15,17-19,23]报告了术后第3天ALT水平,4项研究[13,15,17,23]报告了术后第7天ALT水平,各研究结果间异质性有统计学意义(P<0.05,I²=99%),故采用随机效应模型进行Meta分析。结果显示,术后第1天ALT水平差异有统计学意义(WMD=-74.92,95%CI=-126.18~-23.67,P=0.004)、第3、7天ALT水平差异无统计学意义(术后第3天:WMD=-4.77,95%CI=-20.47~10.94,P=0.55;术 后 第7天:WMD=2.27,95%CI=-2.61~7.16,P=0.36)(图4)。

图3 术前ALT水平比较Meta分析Figure 3 Meta-analysis comparing the preoperative ALT levels
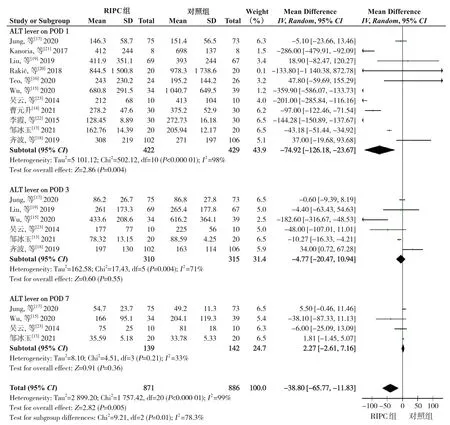
图4 术后ALT水平比较的Meta分析Figure 4 Meta-analysis comparing the postperative ALT levels
2.2.2 AST水平 9项研究[13-19,22-23]报告了手术前AST水平,各研究结果间异质性无统计学意义(P=0.21,I2=26%),故采用固定效应模型进行Meta分析。结果显示,两组患者术前AST水平无统计学意 义(WMD=-0.33,95%CI=-1.08~0.42,P=0.39)(图5)。11项研究[13-23]报告了术后第1天AST水平,6项研究[13,15,17-19,23]报告了术后第3天AST水平,4项研究[13,15,17,23]报告了术后第7天AST水平,各研究结果间异质性有统计学意义(P<0.05,I²=99%),故采用随机效应模型进行Meta分析。结果显示,术后第1天AST水平差异有统计学意义(WMD=-66.37,95%CI=-106.47~-26.27,P=0.001)、第3、7天AST水平差异无统计学意义(术后第3天:WMD=-5.33,95%CI=-24.73~14.07,P=0.59;术 后第7天:WMD=0.27,95%CI=-0.49~1.02,P=0.49)(图6)。

图5 术前AST水平比较的Meta分析Figure 5 Meta-analysis comparing the preoperative AST levels

图6 术后AST水平比较的Meta分析Figure 6 Meta-analysis comparing the postoperative AST levels
2.2.3 TBIL水平 7项研究[13-15,17-19,23]报告了手术前TBIL水平,各研究结果间异质性有统计学意义(P<0.05,I2=100%),故采用随机效应模型进行Meta分析。结果显示,两组患者术前TBIL水平差异无统计学意义(WMD=-17.36,95%CI=-56.30~21.58,P=0.38)(图7)。7项研究[13-15,17-19,23]报告了术后第1天TBIL水平,6项研究[13,15,17-19,23]报告了术后第3天TBIL水平,5项研究[13,15,17,20,23]报告了术后第7天TBIL水平,各研究结果间异质性有统计学意义(P<0.05,I²=76%),故采用随机效应模型进行Meta分析。结果显示,术后第1、3、7天TBIL水平差异均无统计学意义(术后第1天:WMD=-0.93,95%CI=-4.73~2.87,P=0.63;术 后第3天:WMD=-0.07,95%CI=-1.91~1.78,P=0.94;术后第7天:WMD=0.13,95%CI=-0.67~0.93,P=0.75)(图8)。
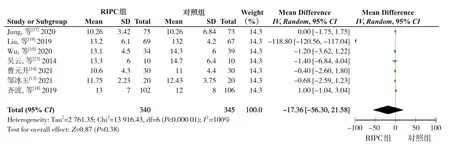
图7 术前TBIL水平比较的Meta分析Figure 7 Meta-analysis comparing the preoperative TBIL levels

图8 术后TBIL水平比较的Meta分析Figure 8 Meta-analysis comparing the postoperative TBIL levels
2.2.4 ALB水平 4项研究[13,15,18-19]报告了手术前ALB水平,各研究结果间异质性无统计学意义(P=0.14,I2=45%),故采用固定效应模型进行Meta分析。结果显示,两组患者术前ALB水平差异无统计学意义(WMD=-0.13,95%CI=-1.12~0.95,P=0.81)(图9)。4项研究[13,15,18-19]报告了术后第1、3天ALB水平,2项研究[13,15]报告了术后第7天ALB水平,各研究结果间异质性无统计学意义(P=0.10,I²=38%),故采用固定效应模型进行Meta分析。结果显示,术后第1、3、7天ALB水平差异无统计学意义(术后第1天:WMD=0.38,95%CI=-0.13~0.89,P=0.14;术 后 第3天:WMD=-0.44,95%CI=-0.95~0.06,P=0.09;术 后 第7天:WMD=-0.81,95%CI=-1.84~0.21,P=0.12)(图10)。

图9 术前ALB水平比较的Meta分析Figure 9 Meta-analysis comparing the preoperative ALB levels

图10 术后ALB水平比较的Meta分析Figure 10 Meta-analysis comparing the postoperative ALB levels
2.2.5 手术时间 9项研究[13-19,22-23]报告了手术时间,各研究结果间异质性无统计学意义(P=0.42,I2=2%),故采用固定效应模型进行Meta分析。结果显示,两组患者手术时间差异无统计学意义(WMD=3.05,95%CI=-1.59~7.68,P=0.20)(图11)。

图11 手术时间比较的Meta分析Figure 11 Meta-analysis comparing the operative time
2.2.6 术中出血量 7项研究[13-16,18-19,22]报告了术中出血量,各研究结果间异质性无统计学意义(P=0.15,I2=36%),故采用固定效应模型进行Meta分析。结果显示,两组患者术中出血量差异无统计学 意 义(WMD=-2.30,95%CI=-18.33~13.73,P=0.78)(图12)。

图12 术中出血量比较的Meta分析Figure 12 Meta-analysis comparing the intraoperative blood loss
2.2.7 住院时间 4项研究[14,19,22-23]报告了住院时间,各研究结果间异质性无统计学意义(P=0.09,I²=54%),故采用随机效应模型进行Meta分析。结果显示,两组患者住院时间差异无统计学意义(WMD=-0.24,95%CI=-1.04~0.55,P=0.55)(图13)。

图13 住院时间比较的Meta分析Figure 13 Meta-analysis comparing the length of hospital stay
2.2.8 主要手术并发症 5项研究[14,17,19,21-22]报告了术后切口感染情况,各研究结果间异质性无统计学意义(P=0.63,I2=0%),故采用固定效应模型进行Meta分析。结果显示,两组术后切口感染发生率差异无统计学意义(OR=0.99,95%CI=0.35~2.83,P=0.99)(图14A)。3项 研究[14,17,19]报告了术后胆汁漏情况,各研究结果间异质性无统计学意义(P=0.51,I²=0%),故采用固定效应模型进行Meta分析。结果显示,两组术后胆汁漏发生率差异无统计学意义(OR=1.65,95%CI=0.39~7.02,P=0.50)(图14B)。4项 研究[14,17,19,22]报告了术后腹腔出血情况,各研究结果间异质性无统计学意义(P=0.75,I2=0%),故采用固定效应模型进行Meta分析。结果显示,两组术后腹腔出血发生率差异无统计学意义(OR=0.79,95%CI=0.21~2.98,P=0.72)(图14C)。3项 研究[14,19,21]报告了术后肺部并发症情况,各研究结果间异质性无统计学意义(P=0.78,I2=0%),故采用固定效应模型进行Meta分析。结果显示,两组术后肺部并发症发生率差异无统计学意义(OR=1.24,95%CI=0.33~4.66,P=0.76)(图14D)。
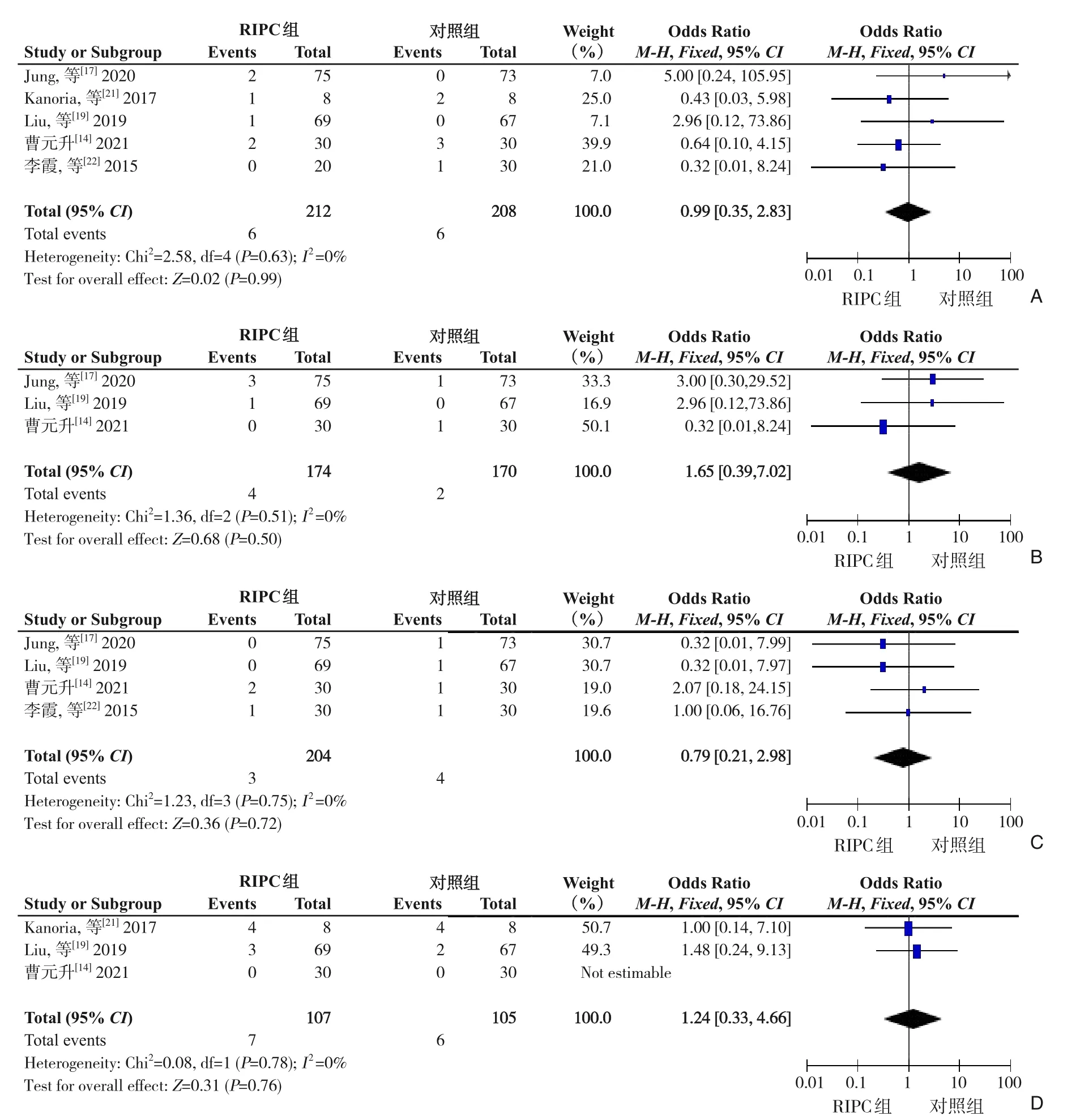
图14 主要手术并发症比较的Meta分析 A:切口感染;B:胆汁漏;C:腹腔出血;D:肺部并发症Figure 14 Meta-analysis comparing the main surgical complications A: Wound infection; B: Bile leakage; C: Intra-abdominal bleeding; D: Pulmonary complications
2.3 敏感度分析和发表偏倚
当剔除任意1项研究,或更改效应模型时,异质性无明显变化,且对最终分析结果也没有产生影响,提示本Meta分析结果较稳定。但纳入研究的RCT术后ALT、AST和TBIL水平漏斗图呈现不对称模式,提示在本Meta分析中存在发表偏倚(图15)。
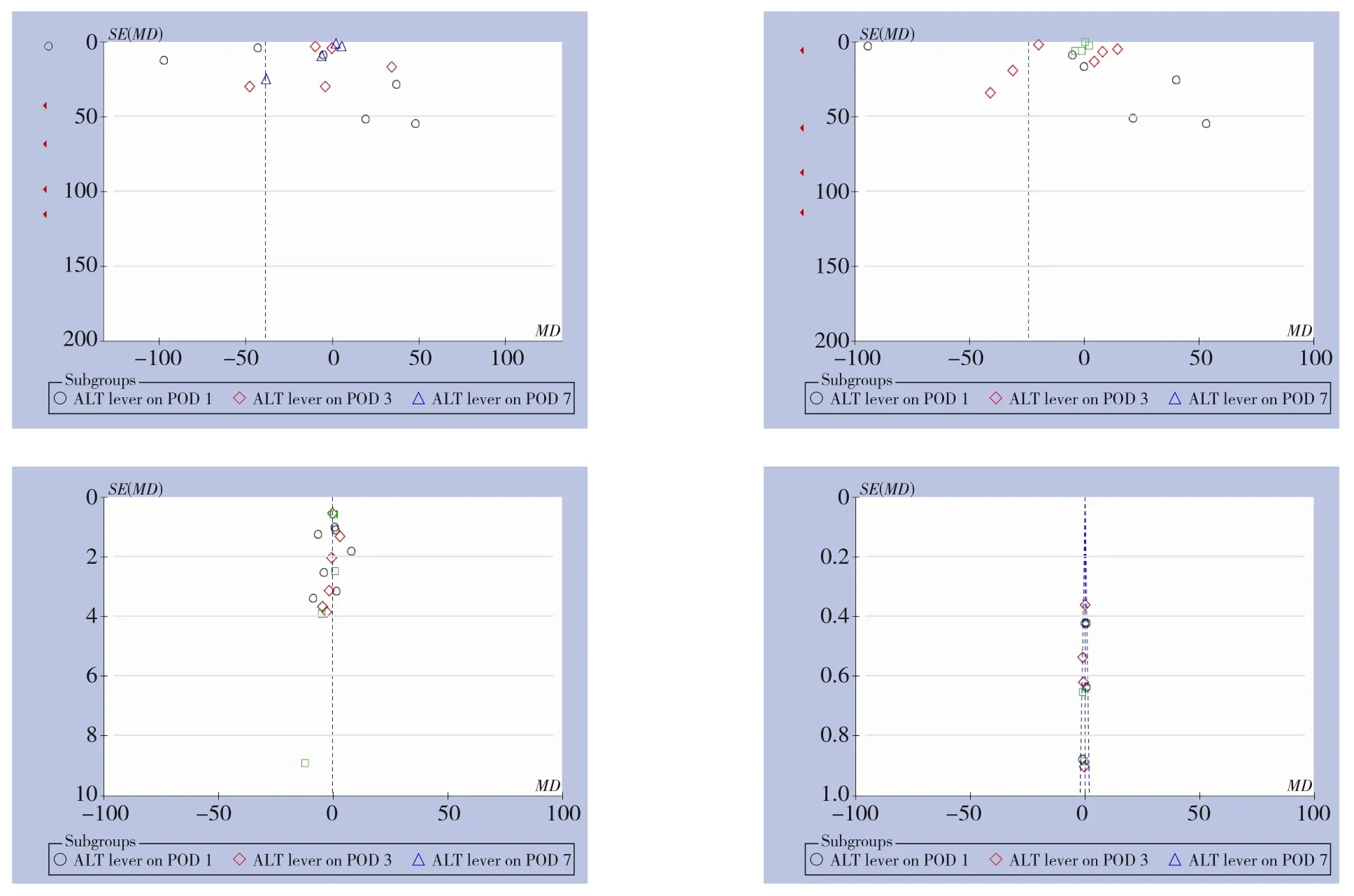
图15 术后肝功能指标漏斗图Figure 15 Funnel plot based on the postoperative liver function parameters
3 讨 论
目前,肝切除术仍被认为是早期原发性和继发性肝癌治疗的金标准[3],同时也是有症状或直径超过10 cm的肝囊肿、肝海绵状血管瘤,有症状的腺瘤、局灶性结节增生、肝内胆管结石等良性疾病的首选治疗方法[24]。众所周知,肝脏对缺血缺氧极为敏感,在肝切除术后容易发生HIRI,因此在术中如何采取有效措施减少术中出血量,为肝切除手术提供清晰的手术视野,同时降低术后HIRI,是决定肝脏切除手术成功与否和患者术后早期康复的关键[5,25]。RIPC是指通过在远离靶器官的远端部位或器官实施多次短暂缺血-再灌注(ischemia/reperfusion,I/R)周期,可能对靶器官或部位发挥保护作用,预防或减轻重要器官再灌注损伤(ischemia-reperfusion injury,IRI)。临床上,实施RIPC干预一般是通过血压袖带对四肢进行循环充气和放气操作,使袖带充气压比收缩压大20 mmHg左右(或设置为200 mmHg),造成上肢或下肢缺血5~10 min,接着将袖带放气灌注5~10 min,连续重复3~4个周期[13-16]。本研究系统评价了RIPC组和对照组患者在接受肝切除术后肝功能情况、术中出血量、主要手术并发症、手术时间、住院时间等,结果显示RIPC应用于肝切除术中的临床获益有限。
许多动物实验和临床研究[26-30]已经证实,RIPC对许多重要器官的IRI具有保护作用,包括心脏、肾脏、大脑和肺等。RIPC缓解IRI的机制之一,可能涉及神经、体液和系统通路之间的相互作用[8,31]。远端肢体的血管床和组织因RIPC后缺血性刺激激活自主神经系统,促进产生神经-体液活性物质如腺苷、阿片类、缓激肽、血红素加氧酶1(heme oxygenase 1,HO-1)等,并加速分泌进入血液抗氧化应激和抑制全身性炎症反应,这些物质还可激活上行神经纤维,作用于人体远端靶器官。神经-体液保护作用主要表现在刺激信号的产生、信号向靶器官的传递、靶器官的保护等3个方面,尽管RIPC对肝脏保护的确切机制尚不完全清楚,但基于体液和外周神经纤维触发刺激性信号及信号转导调控的观点已经被提出[32]。值得注意的是,这些神经-体液保护因子的信号转导调控十分复杂,当RIPC激活自主神经系统可以促进神经-体液因子的产生和释放,反过来神经-体液因子也可以激活自主神经系统。RIPC缓解IRI的另一机制,可能是其通过相关外泌体基因调控和线粒体自噬激活抗凋亡和抗炎信号通路而达到肝脏保护作用。Zhou等[33]对RIPC的大鼠HIRI模型研究显示,透射电镜(TEM)观察下残余肝线粒体自噬体有所增加,同时自噬标志物LC3和Beclin-1蛋白表达水平也显著升高,表明RIPC可能是通过激活线粒体自噬减轻HIRI作用。Koh等[34]通过分析基因表达谱发现,RIPC可通过调节Toll样受体(toll-like receptor,TLR)信号通路缓解HIRI介导的肝脏细胞凋亡。HMGB1合成后被分泌出细胞外,通过体液循环运送到靶器官细胞周围,当HMGB1与胞膜TLR结合后,激活NF-κB并将信号传递到胞内,促进TNF-a产生和释放,发挥其生物学效应。另外,Belon等[11]研究还发现,接受RIPC的动物肝脏中凋亡基因BAX和抑癌基因Bcl-XL的表达降低,为进一步探索RIPC的肝脏保护作用机制提供了新的思路。
转氨酶是肝功能的主要指标,其异常升高表明肝细胞受损严重[35-37],因此肝切除术后ALT、AST水平是评价残余肝功能、反映肝损伤程度等情况的重要指标之一[31,38]。在本Meta分析中,RIPC组术后第1天的ALT和AST水平低于对照组,但是纳入的研究样本具有高度异质性(I²分别为98%和95%),且术后第3、7天的ALT和AST水平组间无统计学意义,因此必须谨慎解释该结果。同时,TBIL、ALB水平也被认为是肝切除术后残余肝代谢功能受损的一个敏感指标[39-40],白蛋白-胆红素(ALBI)分级已被证明与生存率、肿瘤复发和肝切除术后肝衰竭相关[41-43],而本研究中RIPC组与对照组术后TBIL、ALB水平无明显差异。因此,笔者认为RIPC不能减轻肝切除术后HIRI引起的肝损伤。事实上,接受肝切除术的患者都有发生HIRI的风险,这是不可避免的。为了探究对HIRI的有效保护,缺血后处理(ischemic postconditioning,IPOS)这一概念正在从其他器官保护经验中引进来。2012年,Song等[44]首次在小鼠HIRI模型上分别单独测试RIPC和IPOS治疗策略,与单独治疗相比,RIPC联合IPOS可以提供额外的临床益处。2021年,Yasojima等[45]通过小鼠HIRI模型也得出,IPOS可增加抗氧化物质,减轻HIRI,具有较高的潜在临床应用前景。然而,目前还没有关于RIPC联合IPOS应用于临床肝切除术的研究发表,其临床意义也还有待进一步证实。本研究存在一定的局限性。首先,在常用的肝功能诊断和监测指标中,本研究只分析了4项(ALT、AST、TBIL和ALB);主要术后并发症也只分析了4种(术后切口感染、胆汁漏、腹腔内出血、肺部并发症)。其次,本研究中AST和ALT的分析结果存在显著的异质性,且无法消除。再次,存在发表偏倚,这可能会使合并分析的结果不稳定,但并不影响本研究的结论。最后,未对患者术前肝功能情况进行亚组分析[46],因为RIPC在老年患者或肝硬化患者中可能会减弱作用[12,47];同时由于RCT中数据的缺失和局限性,未能对不同疾病种类进行系统分析,也未分析患者的远期转归。此外,目前所有临床研究都是在异丙酚麻醉或异丙酚复合吸入性麻醉下进行的,这也是一个争论的热点话题[48-50]。
近年来,在肝切除术中应用RIPC策略的一系列临床研究项目已陆续公开发表,但就目前来看RIPC是否能减轻肝脏手术后HIRI仍存在争议[13,15-17,51],在肝切除术中的最终临床获益还缺乏具有说服力的研究证据。本研究结果表明,RIPC并不能缓解肝切除术后HIRI引起的肝脏损伤,但未来需要纳入更多高质量的多中心RCT 研究,以便得到更加严谨可靠的结果。
利益冲突:所有作者均声明不存在利益冲突。
