成人肝脏腺泡状横纹肌肉瘤1例并文献复习
2023-02-17江亚徐文漭龙世溢吕安亚徐开军康红艳王媛媛
江亚,徐文漭,龙世溢,吕安亚,徐开军,康红艳,王媛媛
(中国人民解放军联勤保障部队第九二〇医院 1. 病理科 2. 健康医学科,云南 昆明 650032;云南省第三人民医院 3. 病理科4. 肝胆胰外科,云南 昆明 650011)
横纹肌肉瘤(rhabdomyosarcoma,RMS)是儿童中最常见的软组织肉瘤,显示骨骼肌分化的原始间叶性恶性肿瘤,成人罕见[1]。RMS最常见的部位是头颈部、四肢、泌尿生殖道和腹膜后[2]。RMS分为腺泡状横纹肌肉瘤(alveolar rhabdomyosarcoma,ARMS)、胚胎性横纹肌肉瘤 (embryonal rhabdomyosarcoma,ERMS)、多形性横纹肌肉瘤(plemorphic rhabdomyosarcoma,PRMS)和硬化/梭形细胞性横纹肌肉瘤 (spindle cell/sclerosing rhabdomyosarcoma)4种亚型[3]。最常见的是ERMS,其次是ARMS,起源于成年人肝脏的ARMS更极为罕见,仅有1例报道[4]。本文报道1例43岁男性肝脏ARMS患者的诊治经过,并结合文献复习,现报告如下。
1 病例报告
患者 男,43岁,因“反复上中腹胀痛1月余,加重半月”收治入当地医院。患者于2021年10月开始无明显诱因反复出现中上腹胀痛不适,未予重视;2021年11月15日上述症状加重,呈持续性胀痛,无恶心、呕吐、腹泻,无呕血、黑便,体质量无明显增减。乙肝病史3年,长期自服恩替卡韦(1片/d)治疗,其余用药史不详。患者入院后完善相关检查,全腹CT检查提示:肝S8段见不规则斑片状稍低密度影,大小约5.5 cm×3.7 cm,边界模糊,增强后不均匀强化;肝门区、腹膜后及腹主动脉旁见多发淋巴结肿大,部分融合。考虑:肝S8段肝细胞肝癌并肝门区、腹膜后及腹主动脉淋巴结转移(图1);肝硬化;门静脉高压;脾大;腹水。胸部CT示:双肺多发实性结节,建议3个月后复查。实验室检查:血生化检查:谷草转氨酶、球蛋白、碱性磷酸酶、γ-谷氨酰转肽酶升高,其余正常;肿瘤标志物:甲胎蛋白(AFP)、癌胚抗原、CA19-9、铁蛋白正常,CA125增高(538.98 U/mL);病毒抗体检测:乙肝核心抗体、乙肝表面抗原阳性,提示乙肝小二阳。患者及家属因费用问题,拒绝行PET/CT检查。肝胆外科医生经综合评估,拟为患者行中肝肿瘤切除术+腹腔肿大结节切除术。
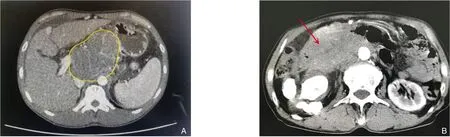
图1 腹部CT图像 A:肝门处肿瘤(黄线范围所示);B:腹腔内肿瘤(红色箭头所示)
手术过程中肝脏呈肝硬化表现,中肝膈面可见一大小6 cm×6 cm的外生性肿瘤,且有破溃出血,与膈肌粘连致密,余肝未见异常占位,肝门区、中上腹部可见多个类圆形结节,部分融合,周围组织、脏器(胃、肠管、胰腺等)均受压、推移,肝门区静脉曲张明显无法解剖第一肝门,且肝肿瘤破溃出血,故决定行减瘤手术,行肝肿瘤切除及行腹腔结节切除后,切开肿瘤肉眼似鱼肉样。术后标本送病理检查,当地医院诊断为肝细胞癌,要求多院联合病理会诊,遂送至中国人民解放军联勤保障部队第九二〇医院病理科会诊。
术后肝S8段肿瘤及腹腔结节经10%中性福尔马林固定,石蜡包埋,行HE染色。免疫组化染色采用EnVision两步法,一抗Pan-CK、EMA、CK19、CK8/18、AFP、arginase 1、hepatocyte、CD56、Syn、CgA、CD99、TFE-3、vimentin、desmin、MyoD1、myogenin、S-100、melan-A、HMB45、Ki-67均购自福州迈新生物技术有限公司。操作流程均严格按照试剂盒说明书进行,并设置阳性对照,DAB显色。肿瘤细胞胞质、胞膜或胞核呈棕黄色(不同抗体部位不同)即判定为阳性。荧光原位杂交(FISH)检测FOXO1基因断裂情况,FOXO1基因断裂探针试剂盒购自武汉康录公司,操作步骤按照说明书进行。结果判度:在荧光显微镜1 000倍视野下,计数200个细胞,其中分别计数FOXO1基因正常和断裂细胞个数,计算FOXO1断裂比值,当比值≥30%,提示FOXO1基因发生断裂。
HE镜检示肿瘤细胞排列成巢状、实性片状,浸润性生长,破坏肝脏结构,肿瘤组织侵犯肝内胆管(图2A-B)。部分排列成腺泡状,腺泡间为纤维血管性间隔(图2C)。瘤细胞圆形或卵圆形,大小较一致,胞质较少,核深染,部分瘤细胞具有纤细的空泡状染色质和小的核仁,核分裂象易见(图2D)。免疫组织化学染色镜检发现肿瘤细胞desmin(图2E)、myogenin(图2F)、MyoD1、CD56、CgA、Syn阳性,其中myogenin弥漫核阳性,Pan-CK、EMA、CK19、CK8/18、AFP、arginase 1、hepatocyte、CD99、S-100、melan-A、HMB45等 阴性,Ki-67增殖指数高达80%。FISH检测提示该例肿瘤未发生FOXO1基因断裂。综合以上结果,最终病理诊断为肝脏ARMS。

图2 病理检查图 A:瘤细胞成巢状、片状,破坏肝脏结构浸润性生长(HE×40);B:肿瘤细胞侵犯小叶间胆管(HE×100);C:肿瘤排列成腺泡状,腺泡间有纤细的纤维间隔(HE×100);D:瘤细胞呈圆形、卵圆形或小多边形,偶可见小核仁(HE ×400);E:瘤细胞阳性表达desmin(IHC×200);F:瘤细胞弥漫阳性表达myogenin(核阳)(IHC×200)
患者行部分肿瘤切除术后,未行化疗,因术后肿瘤迅速生长、转移,病情发展迅速,患者放弃继续维持治疗,2022年6月因肿瘤复发并出现输尿管、脊柱及全身多个部位淋巴结转移死亡。
2 讨论并文献复习
2.1 临床特点
临床上,肝脏ARMS与其他肝脏肉瘤类似,一般起病较为隐匿,早期可没有症状,患者常以腹部包块为首发表现[6]。可能会出现腹痛、厌食、呕吐、体质量减轻和疲劳等症状。在病程早期,如果出现胆道梗阻,也可能出现黄疸和胆管炎的症状[7]。病程中可有间歇性梗阻性黄疸、发热、肝大等。不会出现特定的血生化指标异常,有时会出现胆汁淤积或AFP升高的迹象[4]。本例患者有乙肝病史3年,肝功能异常,因反复腹胀、腹痛检查时发现肝脏占位病变。
2.2 影像学特点
影像学上,RMS与一般软组织肉瘤的表现相似。肿块常较大,边界不清,形态不规则,易坏死,病变范围大时,易压迫周围器官[8]。CT表现为与肌肉组织密度相近软组织肿块,增强扫描不均匀强化。MRI上T1W1多呈等或稍低信号,伴出血时呈高信号;T2W1呈不均匀稍高或高信号,信号不均与肿瘤坏死相关;DWI上呈高信号[9]。
2.3 病理学特征
ARMS有3种类型:经典型、实体型、胚胎-腺泡状混合型。经典型ARMS排列呈巢状和片状,可形成腺泡结构,腺泡间为纤维血管间隔。瘤细胞为圆形、卵圆形或小多边形的未分化细胞,核深染,核分裂象易见,胞质稀少,部分病例可见横纹肌母细胞,胞质嗜伊红色,核偏位。实体型ARMS由实性的瘤细胞巢构成,腺泡结构或纤维血管间隔不明显。胚胎-腺泡状混合型除经典的腺泡状区域外,局部区域显示胚胎性RMS的形态特点[10]。对于细胞形态不典型的病例免疫组化有助于诊断,瘤细胞表达desmin、myogenin、MyoD1、vimentin,部分病例表达CD56、Syn、CgA等神经内分泌标记,Morgenstern等[11]报道,ARMS弥漫强表达myogenin,可用于区分腺泡状和胚胎性RMS。
2.4 鉴别诊断
肝脏原发ARMS需与以下几种疾病相鉴别。⑴ 腺泡状软组织肉瘤:肿瘤排列成器官样或腺泡样结构,与ARMS不同,其瘤细胞大小及形态较一致,呈大圆形或多边形,胞质丰富,内含嗜伊红色颗粒,细胞边界清晰。且70%~80%的病例于胞质内可见PAS阳性的针状或棒状结晶。免疫组化显示大多数病例表达TFE3,部分病例瘤细胞胞质表达MyoD1,有别于ARMS的核阳性。此外,腺泡状软组织肉瘤不表达myogenin也有助于鉴别;⑵ 小细胞癌:本例ARMS弥漫表达Syn、CD56、CgA等神经内分泌标记,易误诊为小细胞癌。大多数小细胞癌起源于肺,肝脏原发的小细胞癌很罕见[12]。不论是原发还是转移,均需要鉴别,肿瘤由弥漫生长的小细胞组成,呈实性片状、条索状或小梁状结构,瘤细胞核染色质细颗粒状,核仁小或无,免疫组化除了表达CD56、Syn、CgA等神经内分泌标记外,亦表达Pan-CK、EMA等上皮标记;⑶ 骨外尤文肉瘤/原始神经外胚层瘤:瘤细胞弥漫成片或小叶状分布,小叶间为宽窄不等的纤维结缔组织间隔,其中可见Homer-Wright菊形团结构,瘤细胞弥漫强表达CD99、Fli-1、NKX2.2,偶可见desmin灶性表达,不表达MyoD1等,常可检出EWS-FLI1基因融合或EWSR1基因相关异位;⑷ 恶性淋巴瘤:本例肝门区、腹膜后及腹主动脉旁见多发淋巴结肿大,部分融合,类似淋巴瘤的影像学表现[13]。镜下由小圆细胞弥漫一致分布,但淋巴瘤一般不形成腺泡状结构,且免疫组化表达LCA、CD20、CD79a、CD3等淋巴细胞标记,不表达肌源性标志物desmin、MyoDl等,可资鉴别;⑸ 低分化或未分化肝细胞癌:瘤细胞可呈弥漫实性或片状分布,与ARMS相似,但肝癌细胞胞质较丰富,免疫组化CK(AEI/AE3)、EMA、CK8/18等上皮标记阳性。
2.5 分子遗传学
研究[14-15]显示,大约80%的ARMS存在t(1;13)(p36;q14)或t(2;13)(q35;q14)染色体易位,这会产生PAX7-FOXO1或PAX3-FOXO1基因融合。两种PAX易位都可以通过FISH测定来证明,有助于诊断ARMS。但是大约20%的ARMS不会发生PAX3/7-FOXO1基因融合。因此,阴性的结果并不一定排除ARMS的诊断[16-17]。PAX/FOXO1的表达特征似乎可用于患者风险评估,有研究数据[18]显示,ARMS伴有PAX3/FOXO1易位比PAX7/FOXO1易位的肿瘤侵袭性更高。
2.6 治疗
所有RMS患者在诊断时均具有微转移,因此必须控制原发部位后再进行化疗。非转移性疾病的标准化疗方案包括长春新碱(VCR)、放线菌素和环磷酰胺(VAC)的联合。在转移性病变中,化疗药物有异环磷酰胺、多柔比星、依托泊苷、美法仑、长春新碱等。然而,转移组的总生存期(overall survival,OS)仍然很低[16,19]。关于肝脏RMS没有具体的治疗指南,目前手术切除是最重要的治疗方法,对于术后或不能手术的患者是否需要进行化疗或放疗尚不明确,可参照RMS的化疗方案。有报道[20]认为在肝肿瘤切除后经皮下化疗泵行区域化疗(5-氟尿嘧啶)可提高疗效。此前报道[4]的1例肝脏ARMS采用异环磷酰胺和阿奇霉素进行化疗,起初疗效较好,症状得以缓解。但由于患者对化疗药物耐受性较差,病情未进展,未继续化疗,停止化疗后2个月患者肠系膜和肝脏等出现多个复发转移灶,再次进行手术切除肿瘤病灶辅以化疗,遗憾的是,肿瘤进展较快,患者在初步诊断后31个月死亡。
2.7 预后
所有类型的RMS均是高级别肉瘤,成人RMS预后较差,5年OS率为27%,而儿童RMS 5年OS率为61%[21]。成人ARMS的5年OS率为(29±10)%[22]。约超过60%的成人RMS在诊断时有局部或远处转移[23]。同时,成人RMS具有较高的转移复发率,且对治疗的耐受性较低,所以使用的治疗剂量较低[2]。此外,年龄、肿瘤大小、侵袭性、转移、区域淋巴结受累和化疗后的病理反应都是影响RMS预后的因素[22,24]。并且,特定部位(子宫和睾丸)和治疗(癌症导向手术和化疗)是有利的预后因素[24]。
综上所述,成人ARMS仍然是一种预后很差的罕见疾病,在就诊时往往出现局部转移且进展迅速。诊断时需要结合免疫组化及分子检测才能做出正确的诊断,早发现、早诊断、早治疗是提高本病疗效的最根本方法。成人ARMS的标准化治疗方法和新治疗靶点尚需大量的病例报道和进一步深入探讨、研究。
利益冲突:所有作者均声明不存在利益冲突。
