肿瘤包绕型血管在肝细胞癌中的研究进展
2023-02-17王苗苗王寅中王倩雷军强
王苗苗,王寅中,王倩,雷军强
(1.兰州大学第一临床医学院,甘肃 兰州 730000;2. 兰州大学第一医院 放射科,甘肃 兰州 730000;3.甘肃省放射影像临床医学研究中心,甘肃 兰州 730000)
据全球癌症统计,原发性肝癌位居全球癌症死亡原因的第三位[1-3]。原发性肝癌中肝细胞癌(hepatocellular carcinoma,HCC)约占85%~90%[4-5]。肝切除术是HCC的主要治疗措施[6-8]。但是,患者接受肝切除术后,HCC复发率达50%,5年内的复发率甚至超过70%[9-12]。其中复发频繁、病死率高的原因主要归因于HCC早期转移[13]。而关于肿瘤细胞转移的机制目前尚未研究透彻。HCC是一种高血管化的肿瘤,容易发生早期血源性扩散[5]。特别是肿瘤的异常新生血管增加了转移的强度[14]。经典的癌细胞转移方式为上皮-间质转化(epithelial-mesenchymal transitions,EMT)[15];而 最近有学者[13]发现一种新的不依赖EMT的转移机制—肿瘤包绕型血管(vessels encapsulating tumor clusters,VETC)。VETC模式的存在预示着HCC的转移率更高、预后更差[13]。故笔者总结VETC模式在HCC中研究现状、作用机制及临床意义,旨在为HCC的临床与基础研究提供参考,为HCC患者的个体化治疗提供参考。
1 VETC模式的概念
VETC是由中山大学团队[13]最先发现并命名的一种新的血管模式,在HCC中普遍存在,特别是在粗梁型HCC中富集。实验模型[13]表明VETC是由具有血液灌注功能的血管组成,并在HCC早期阶段由肿瘤细胞诱导。经CD34免疫组化染色可在镜下表现为窦状血管包绕肿瘤细胞簇,形成蜘蛛网状结构,其与病死率高相关性较大。
2 VETC模式在HCC中的转移机制
目前,传统的血管转移模式通常为单个癌细胞的黏附性降低和上皮极化丧失而转变为具有运动能力的间充质细胞,从原发灶分离,赋予癌细胞主动侵袭和迁移的能力,穿越基质及血管壁,随血流到达靶器官进行定植,从而形成新的转移灶,这就是所谓的EMT[16-17],此时原发肿瘤细胞作为单个细胞进行迁移。然而,与单个循环肿瘤细胞转移相比,循环肿瘤细胞簇与转移和总生存期(overall survival,OS)及无复发生存期(recurrencefree survival,RFS)更相关[18-21]。另外在EMT阴性时仍然发现转移灶的存在,这就说明存在不依赖EMT的转移模式[22]。
VETC,即窦状血管形成蜘蛛网状包绕肿瘤细胞团块,形成多个独立的小单元进行转移,同时肿瘤细胞簇由内皮细胞包裹,通过与瘤周的静脉吻合而侵入血流,有效躲避免疫识别及攻击,进行肝内或肝外定植。小鼠种植模型研究表明VETC是一种新的早期的血管转移模式,可以在HCC早期阶段由HCC细胞诱导形成。经Ki-67染色显示,VETC阳性和VETC阴性的增殖率是相似的,说明VETC模式是由具有血液灌注功能的血管组织[13]。在VETC阳性HCC患者的原发性病灶和非肿瘤部位发现被内皮包绕的肿瘤细胞团簇,而在肝外也存在内皮细胞包裹的转移性结节,相比于其他器官,肺转移更为常见[23-24]。此外,在VETC阳性HCC患者的血流中也分离出被内皮包裹的肿瘤栓子[13,23],有内皮包被的栓子增殖率可能更高,预后也更差。这表明相比EMT,VETC介导的转移模式可能更为简单和有效。因此,VETC模式可能提供了一种更依赖于血管而不是肿瘤细胞迁移和侵袭活性的转移方式,增进了对HCC异质性的进一步认识。
3 VETC形成的机制和VETC阳性HCC分子病理特征
内皮细胞在VETC阳性HCC中起着重要的作用,与肿瘤的生长及迁移密切相关。研究[25]表明内皮细胞逐渐失去窦性标志物,如stabin-1、stabin-2、CD32和细胞间黏附分子1(ICAM-1)等,进而获得连续的、无孔的内皮细胞标志物,如CD34[26]。这些都涉及HCC病理性血管形成的过程。一旦血管生成完成,HCC就更容易转移和侵袭。从营养肿瘤细胞生长的“休眠”血管转变为更具侵袭力的“活跃”血管需经多种步骤的配合,故血管模式的异质性可能在肿瘤的发展中起着重要的作用。
血管生长因子(vascular endothelial growth factor,VEGF)[13,27-28]是血管生成的总开关,而血管生成素2(angiopoietin 2,Ang-2)控制着后期的血管组装及成熟等。在VETC阳性HCC中发现Ang-2/整合素β1明显过表达,通过激活下游的酪氨酸蛋白激酶从而促进HCC和内皮细胞的迁移,提示Ang-2的活性在VETC的形成中起着重要作用。在VETC阳性组织中,不仅在内皮细胞中检测到明显的Ang-2信号,而且在多数的肿瘤细胞中也有所发现。实验结果发现,敲除Ang-2基因后,VETC模式的形成明显受到破坏,肝内及肝外部位的转移明显减少,这表明HCC细胞的Ang-2对VETC的形成至关重要,而且VETC模式是促进HCC细胞转移的重要因素。肿瘤细胞中的Ang-2水平与HCC患者生存率较低有关[29-31]。故可作为抗HCC的靶点治疗。此外,研究[32]发现miR-125b和miR-100可能在基因转录水平调节Angpt2的表达而抑制VETC的形成,从而抑制癌细胞的转移,这也为VETC的形成和抗肿瘤靶点提供了新的见解。
肿瘤微环境(tumor microenvironment,TME)在癌细胞的发生发展及迁移中发挥着不可忽视的作用。VETC阳性HCC中CD3肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs)的数量明显下降,这预示着VETC巢状血管可能通过抑制CD3免疫细胞应答从而降低宿主的免疫功能,以此躲避免疫识别及攻击[33]。研究人员[34]进一步探索了VETC与TME及免疫细胞活性之间的关系,研究结果与前者一致,并且发现VETC(-)/CD3(low)两者联合是肝移植后HCC预后的独立风险因子,而CD68单核(巨噬)细胞在VETC阳性HCC中无明显差异,这提示以CD3为标志物的淋巴细胞活性与VETC的活性相关;CD3 TILs可能是重要的抗肿瘤效应细胞,CD3水平低的VETC阳性HCC发生率更高,这说明CD3免疫细胞可能通过异常血管的形成而促进肿瘤的迁移,而TME以及CD3淋巴细胞如何参与VETC的形成及转移尚需进一步研究。在HCC的病理分型中,包括细梁型、假腺管型、粗梁型和团片型等,VETC阳性HCC是病理亚型的一种特有模式,有研究[35]表明VETC模式在粗梁型HCC中富集,VETC阳性HCC的比例可达39%[13]。临床目前根据CD34染色诊断VETC介导的HCC,VETC阳性HCC的典型病理图像为:内皮细胞包裹HCC细胞簇并形成蜘蛛网状(图1A),而VETC阴性者仅表现为条索状血管(图1B)。VETC阳性和阴性HCC的特点总结见表1。
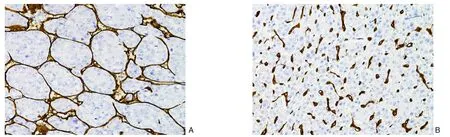
图1 HCC免疫组化染色(×100) A:VETC阳性;B:VETC阴性Figure 1 Immunohistochemical staining of HCC (×100) A: VETC-positive cases; B: VETC-negative cases

表1 VETC阳性和VETC阴性HCC的区别Table 1 Differences between VETC-positive and VETC-negative HCC
4 VETC阳性HCC的诊断预后模型
VETC对HCC预后的价值也是不容忽视的。有学者[38]开发并验证了一种模型以评估HCC的生存期,这项多中心研究采用Lasso-Cox风险回归确立了VETC、微血管浸润(MVI)、肿瘤数量和肿瘤最大直径模型(VMNS模型),结果提示VMNS模型能够很好地预测肝切除术后HCC的RFS。Lu等[39]的研究与前者一致,通过结合VETC和MVI两种血管状态预测HCC的OS、无病生存期(disease-free survival,DFS)以及复发率,结果表明VETC阳性合并MVI阳性的HCC患者的预后最差。这预示着将VETC和MVI纳入研究中可以更全面评估HCC血管的异质性。而中山大学的一项研究[40]采用计算诺莫图概率的方式预测VETC阳性HCC的预后,通过Logistic回归纳入淋巴细胞/单核细胞比、中性粒细胞、AST/ALT、ALT/淋巴细胞比率指数、AFP以及肿瘤直径等因子以建立诺莫图,通过诺莫图计算出VETC阳性HCC的概率,低概率比高概率的VETC阳性HCC的RFS和OS更长,预后更好,这项研究采用临床和影像学特征都较为简单,但却具有很强的预测功能,更能支持临床工作。有研究[28]也采用18F-FDG PET/CT从代谢活动研究VETC阳性HCC的预后,以最大标准化摄取值(SUVmax)的截止值4为界,当SUVmax>4时,患者的OS和RFS更差。
5 VETC在HCC的治疗中的价值探索
肝部分切除是HCC的主要治疗方式,而术后首次肝内复发的治疗方式如RHR或RFA还存在争议,大部分情况下RFA是首选[12]。Chen等[36]发现,在VETC阳性HCC首次复发后,选择RHR而非RFA,OS和DFS更长;相比于RFA,VETC阳性HCC选择RHR更获益,提示VETC是HCC复发后选择RHR的一个病理标志物。另外,晚期HCC通常已失去手术机会,化疗药物尤其索拉非尼是最优先考虑的一线治疗,而目前缺乏对索拉非尼治疗反应的检测标志物;Fang等[37]研究了VETC预测HCC患者接受索拉非尼治疗是否受益,结果表明索拉非尼可以明显改善VETC阳性HCC的OS和术后复发率,改善晚期患者的生存质量,而对VETC阴性的患者尚无统计学差异。
6 VETC阳性HCC中的分子影像学诊断
VETC已被确定为HCC切除术后早期复发和预后不良的指标[25,34]。在治疗前诊断VETC对患者的精准治疗和预后具有很大的意义[37]。而VETC是病理检查的一种特殊发现,故需通过活组织检查尚可确诊。而病理活检由于有创、可重复性差以及存在癌细胞播散的风险而受限。因此,影像学方法在VETC阳性HCC的确定中尤为重要。当前,有关学者已从CT、MRI影像学特征或结合影像组学以及临床特征预测HCC中VETC模式的存在。
研究[35]首次探索VETC阳性HCC在CT上的表现特征及诊断价值,结果提示肿瘤最大径>5 cm和肿瘤内坏死与VETC阳性HCC相关,同时VETC也可作为术后分析的独立预测因素。Fan等[41]研究钆塞酸二钠增强MRI(EOB-MRI)影像学表现特征对VETC的诊断价值,同时纳入临床指标,特征包括血清AST>40 U/L、非边缘弥漫性和不均一动脉期高强化、动脉期肿瘤与肝脏信号强度比(signal intensity,SI)>1.135和肝胆期SI<0.585是VETC阳性HCC的重要预测因子,建立诺莫图做定量分析,敏感度和特异度分别为83.9%和80.9%,其诊断效能明显优于CT。影像组学通过自动化高通量提取有特征的空间数据,更能客观、准确地反映病灶,因而具有很大的应用前景和诊断价值。同时,Fan等[42]探讨EOB-MRI影像组学预测VETC阳性HCC,在动脉期和肝胆期提取相关特征,其诊断敏感度达80.8%,AUC值为0.844。而在另一研究[43]中,分别在EOB-MRI肝胆期图像中手动勾画瘤周和瘤内区域以提取影像组学特征,采用不同的算法进行机器学习以达到最好的拟合模型,结果发现瘤周组学特征模型的诊断价值高于瘤内组学特征模型、临床模型和组合模型,敏感度和特异度分别高达100.00%和86.21%,AUC值高达0.972,同时瘤周组学特征模型也是VETC阳性HCC的早期复发和无进展生存(progression-free survival,PFS)的独立预测因素;在这篇文章中结合了影像组学和机器学习模型,敏感度和特异度也更高,能够提供更精准的诊断。超声作为一种经济便捷的检查方式,对HCC中VETC模型的研究也是逐渐增多。蓝春勇等[44]首次探索了超声造影在VETC阳性HCC中的诊断价值,结果提示VETC阳性HCC动脉期呈裂隙样或肌腱样充盈,而VETC阴性者呈弥漫性充盈,前者比后者充盈时间更久,这也可作为今后临床工作中对VETC阳性HCC识别的一种粗略手段。以上研究表明EOB-MRI识别VETC阳性HCC具有较高的诊断价值,尤其是影像组学、机器学习模式,能够将视觉影像信息转化为深层次的特征来进行量化研究,能够提供更精确的诊断,可将HCC在术前是否存在VETC从病理改变、实验室表现及无创影像学技术相结合进行分析,为临床个体化治疗决策提供科学依据,在今后的临床诊断中可以发挥重要的作用。
7 VETC模式在HCC中的研究局限性及前景
VETC作为一种新的血管模式,与HCC患者的预后相关性很大,故其存在非常大的研究潜能。首先,VETC形成的机制尚处于研究中,目前无统一定论,例如VETC如何定义阳性尚无标准的说法,一般定义为50%的镜下肿瘤范围,而在Renne等[25]的研究中设置55%的镜下范围作为最优截止值,结果提示VETC模式与粗梁状态、炎症浸润少、微血管浸润、AFP水平以及肿瘤最大直径>5 cm等相关,也与OS和DFS相关。研究结果提示VETC阳性HCC的预后更差,而建立影像、临床以及病理模型联合监测VETC阳性HCC,其结果也更为全面和稳健。这可作为今后研究工作的方向。其次,临床上目前确诊VETC都基于术后病理,病理是有创检查,且并非所有HCC患者都需接受手术治疗,因此开展无创诊断及预后(如超声、CT及MR等)具有很大的临床价值。最后,人工智能能够更精确地识别病变,这也是未来的一个新焦点。
8 小 结
血源性转移是HCC术后的复发及死亡的主要原因,了解肿瘤细胞转移机制对癌症患者的治疗具有根本性意义。VETC是HCC病理亚型的一种特殊的病理标志,提供了一种新的介导HCC细胞转移的血管模式,预后更差,侵袭性更强。而Ang-2在VETC的形成中发挥着重要的意义,并与HCC患者的生存率较低相关,故可作为临床治疗的靶点和科研工作的着眼点。研究发现VETC通常在HCC的早期阶段诱导形成,因此早期治疗至关重要。索拉非尼是晚期患者的一线全身治疗,VETC提示早期HCC患者可能接受解剖性肝切除术更获益,而晚期患者接受索拉非尼治疗更受益。有效的治疗取决于对病变的正确识别,VETC模式的无创性诊断是当前的研究焦点。EOB-MRI对VETC阳性HCC具有较高的诊断价值,尤其是高通量的影像组学模式,可更为精准地识别;而影像学表现联合临床病理特征可更好地监测VETC阳性HCC的预后。VETC预示着HCC的复发程度高、病死率高,同时也为临床选择治疗方式提供了一定的指示,而具体的VETC转移机制及治疗方式尚需更多研究支持,这也是今后研究工作的重要方向。
利益冲突:所有作者均声明不存在利益冲突。
