长链非编码RNA GAS8-AS1与微小RNA 135b在肝细胞癌中的表达及临床意义
2023-02-17王昀郜茜
王昀,郜茜
(青海大学附属医院 消化内科,青海 西宁 810000)
肝细胞癌(hepatocellular carcinoma,HCC)是恶性程度较高,预后较差的恶性肿瘤之一,目前肝切除术仍是患者的主要根治方法之一[1-2]。尽管近几十年来HCC的治疗取得了广泛的进展,但由于其早期诊断率低,且患者往往合并肝功能不全,只有不足30%的患者有手术切除的机会[3-4]。因此,探索有效的预后评估和治疗靶点是十分必要的。
长链非编码RNA(long non-coding RNA,lncRNA)已被证明在基因表达中起着关键的调节作用[5-7]。已有证据[8-10]表明,多种lncRNA在HCC中失调,并作为癌基因或抑癌基因参与HCC细胞生长、凋亡、迁移和侵袭。GAS8反义RNA 1(lncRNA GAS8-AS1)位于GAS8的第二个内含子中,并且是以与GAS8相反的方向转录994 nt的lncRNA[11]。据报道[12-13],它是一种新的肿瘤抑制因子,可以影响甲状腺乳头状癌和结直肠癌中的肿瘤细胞增殖。但目前为止,它在HCC中的作用受到的关注较少。
微小RNA(microRNA,miRNA)是小分子非编码RNA,参与靶基因的转录后调控[14-15]。越来越多的证据[16-18]表明,异常表达的miRNA参与调节HCC的发生发展。已有研究[19]发现,miR-135b的过表达可促进HCC细胞的侵袭和转移。但目前为止,其与HCC患者临床相关的报道较少。本课题组在前期预实验中通过生物学软件Targetscan(http ://www.targetscan.org)预测发现,lncRNA GAS8-AS1和miR-135b之间存在结合位点。因此,本研究旨在探讨lncRNA GAS8-AS1和miR-135b在HCC组织中的表达及临床意义。
1 资料与方法
1.1 病历资料
收集2017年2月—2019年2月在青海大学附属医院进行手术切除的110例HCC患者的癌组织及癌旁组织样本(>3 cm处)。根据Edmondson病理分级:I~Ⅱ级52例,Ⅲ~Ⅳ级58例;根据TNM分期:I~Ⅱ期48例,Ⅲ~Ⅳ期62例。所有组织在采集后立刻进行速冻,之后置于-80 ℃的冰箱中保存。
1.2 纳入标准和排除标准
纳入标准:⑴ 患者术前均未进行放化疗、介入、射频消融术及免疫治疗;⑵ HE染色常规病理检查均为原发性HCC,且未合并其他恶性肿瘤;⑶ 经2名病理医师确认为HCC;⑷ 有完整的临床资料,术后有随访数据。排除标准:⑴ 肝转移癌;⑵ 合并心、肾等其他重要器官功能不全;⑶ 合并有自身免疫性疾病;⑷ 临床资料及术后随访数据缺失。
1.3 试剂与仪器
RNA提取和分离试剂盒(Ambion,美国);反转录试剂盒(Takara,中国);NanoDrop 2000超微量分光光度计(Thermo,美国);荧光定量PCR检测系统(BioRad,美国)。
1.4 实时荧光定量PCR(qRT-PCR)实验
严格按操作说明书,用Trizol®试剂提取HCC组织及癌旁组织的总RNA,并通过NanoDrop 2000测定RNA的质量和浓度。用反转录试剂盒(Takara,中国)进行反转录,反应体系为:cDNA产 物2 μL,2×SYBR®Premix Ex Taq TM Ⅱ 8 μL,上下游引物各1 μL,50×ROX Reference Dye 0.4 μL,RNase-Free H2O 7.6 μL。反应条件为:95 ℃ 1 min、95 ℃ 10 s、58 ℃ 45 s、72 ℃ 30 s,共40个循环。lncRNA GAS8-AS1和miR-135b的表达水平以2-ΔΔCT表示。实验所用引物序列如表1所示。
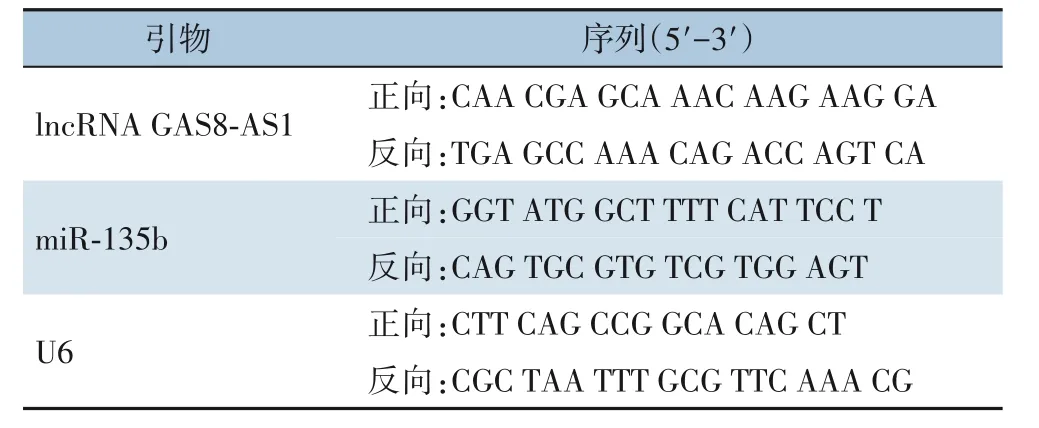
表1 研究所用引物序列Table 1 Sequence of primers used in the study
1.5 随访
术后经门诊、电话及住院等方式对患者进行随访,随访截止时间为2022年2月,随访终点为随访时间终止或患者死亡。
1.6 统计学处理
本研究经SPSS 23.0软件对数据进行统计分析,计量资料用均数±标准差(xˉ±s)表示,组间比较采用独立样本t检验;计数资料用例数(百分率)[n(%)]表示,组间比较采用χ2检验。生存分析用Kaplan-Meier法,Cox比例风险模型分析影响患者预后的危险因素。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
本研究中年龄>55岁的患者有61例(55.45%),≤55岁的患者有49例(44.55%);男性患者63例(57.27%),女性患者47例(42.73%);肿瘤直径>5 cm的患者60例(54.56%),≤5 cm的患者50例(45.44%);有乙肝病史的患者65例(59.09%),无乙肝病史的患者45例(40.91%);术前甲胎蛋白>20 ng/mL的患者57例(51.82%),≤20 ng/mL的患者53例(48.18%)(表2)。

表2 患者的一般资料[n(%)]Table 2 The general data of patients [n (%)]
2.2 lncRNA GAS8-AS1和miR-135b在HCC组织及癌旁组织中的表达情况
与癌旁组织比较,HCC组织中lncRNA GAS8-AS1的表达水平明显降低(0.47±0.03vs. 1.03±0.8,P<0.05);而miR-135b在HCC组织中的表达水平明显高于癌旁组织(3.17±0.29vs. 1.12±0.16,P<0.05)(图1)。
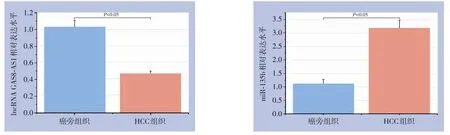
图1 HCC组织及癌旁组织中lncRNA GAS8-AS1和miR-135b的相对表达量比较Figure 1 Comparison of the relative expression levels of lncRNA GAS8-AS1 and miR-135b in HCC and adjacent tissues
2.3 lncRNA GAS8-AS1和miR-135b表达水平与患者临床病理参数的关系
本研究根据lncRNA GAS8-AS1、miR-135b表达水平的均值,将患者分为高表达组和低表达组。结果发现,lncRNA GAS8-AS1高表达组中高Edmondson分期、高TNM分期、高分化的患者比例明显低于lncRNA GAS8-AS1低表达组(均P<0.05);而miR-135b高表达组中高Edmondson分期、高TNM分期、高分化的患者比例明显高于miR-135b低表达组(均P<0.05)(表3)。
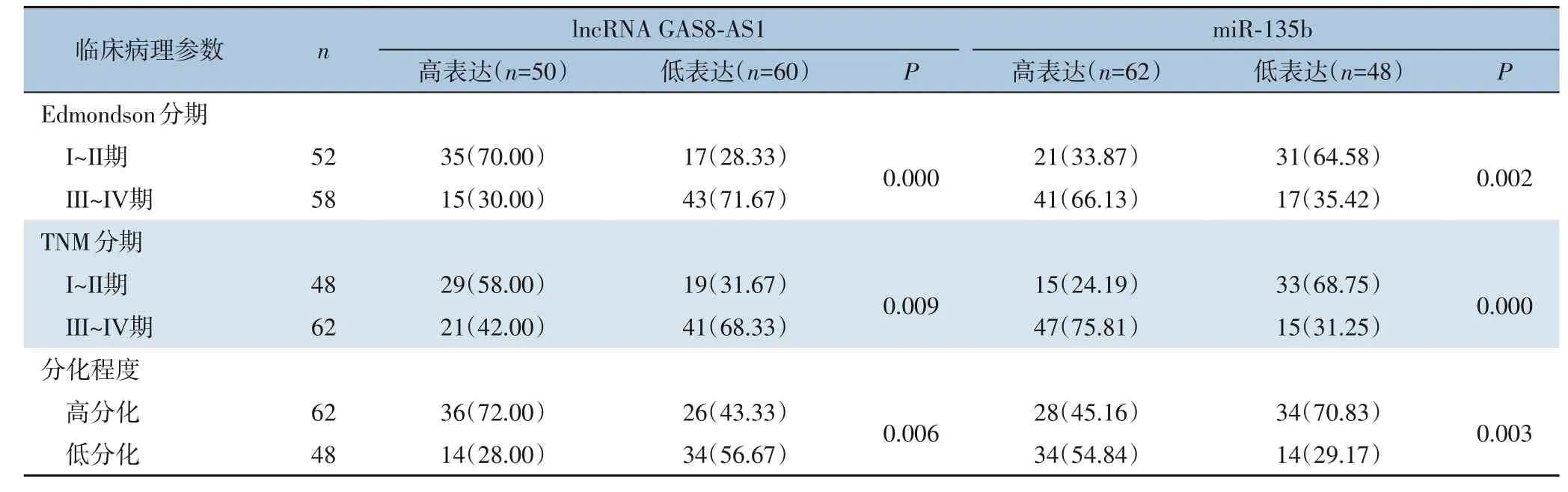
表3 lncRNA GAS8-AS1和miR-135b表达水平与HCC患者临床病理参数的关系[n(%)]Table 3 Relations of the expression levels of lncRNA GAS8-AS1 and miR-135b with the clinicopathologic variables of HCC patients [n (%)]
2.4 lncRNA GAS8-AS1和miR-135b表达水平与患者生存的关系
lncRNA GAS8-AS1高表达组3年总生存率为70.00%(35例);lncRNA GAS8-AS1低表达组3年总生存率为30.00%(15例);miR-135b高表达组3年总生存率为32.26%(20例);miR-135b高表达组3年总生存率为67.74%(42例)(图2)。

图2 lncRNA GAS8-AS1和miR-135b表达水平与HCC患者的生存的关系Figure 2 Relations of the expression levels of lncRNA GAS8-AS1 and miR-135b with the survival of HCC patients
2.5 影响HCC患者预后的多因素Cox回归分析
多因素Cox回归分析结果发现,高Edmondson分级、高TNM分期、有乙肝病史、lncRNA GAS8-AS1低表达及miR-135b高表达均为影响患者预后的独立危险因素(均P<0.05)(表4)。
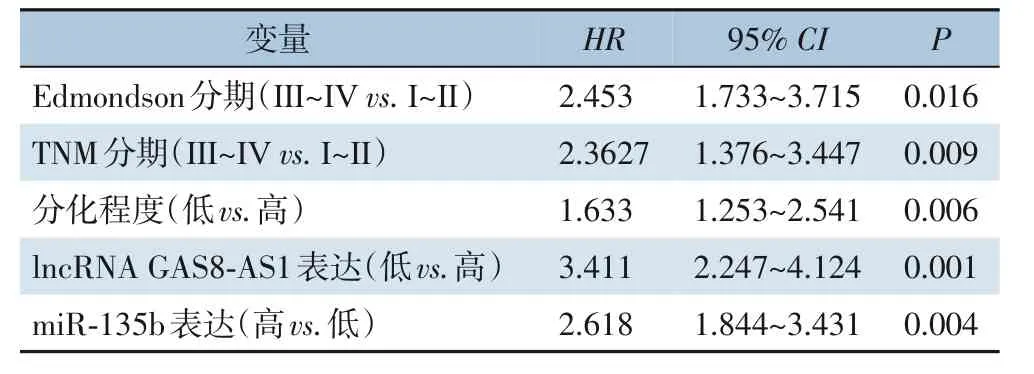
表4 影响HCC患者预后的多因素Cox回归分析Table 4 Multivariate Cox regression analysis of factors for prognosis of HCC patients
3 讨 论
肝癌是世界上第六大常见的恶性肿瘤,也是男性癌症患者死亡的第二大常见原因。HCC是其最主要的组织学亚型,占原发性肝癌的70%~85%。但目前为止,HCC患者的5年生存率很低,每年仍有超过75万例患者死亡[20-21]。虽然之前的研究发现HCC中存在许多异常表达的蛋白质编码基因,但仍需要寻找能帮助早期诊断及风险评估的新型分子标志物。
多项研究[22]已经证明,lncRNA与肿瘤的关系目前已成为癌症研究的热点之一。HCC中lncRNA TLR8-AS1可通过miR-34a抑制癌细胞的增殖、迁移和侵袭。lncRNA UCA1在HCC组织中异常上调,并与TNM分期、转移和术后生存率相关[23]。lncRNA PTENP1过表达载体可有效减缓肝癌小鼠体内肿瘤生长,抑制肿瘤内细胞增殖,诱导凋亡、自噬和抑制血管生成[24]。这些结果表明,lncRNA可能在HCC的发生和发展中发挥重要作用,具有很大的临床应用价值。
GAS8-AS1是一种新鉴定的lncRNA,对于甲状腺乳头状癌和HCC的发生可能起关键作用。在甲状腺乳头状癌中,lncRNA GAS8-AS1发生的突变被证明与肿瘤发生密切相关[25]。在HCC发生过程中,lncRNA GAS8-AS1通过MLL1/WDR5调节GAS8表达,从而抑制疾病进展[26]。但目前为止,lncRNA GAS8-AS1与HCC相关的临床研究并未见报道。本研究在HCC组织中观察到lncRNA GAS8-AS1低表达,提示lncRNA GAS8-AS1的表达水平可能与HCC的发生密切相关,这与之前的研究结果相似。在此基础上,本研究将lncRNA GAS8-AS1的表达水平与HCC患者的临床病理特征相关联,发现lncRNA GAS8-AS1水平低的HCC患者3年总生存率往往比lncRNA GAS8-AS1水平高的患者低,且lncRNA GAS8-AS1低表达是HCC患不良预后的独立指标。上述结果说明,lncRNA GAS8-AS1是HCC患者的一种新的预后生物标志物。
lncRNA已被证明可通过竞争性结合miRNA来调节肿瘤的发生发展[27-29]。Qin等[30]研究发现,lncRNA GAS8-AS1可通过竞争性结合miR-187-3p和miR-1343-3p,并分别上调ATG5和ATG7的表达,进而促进甲状腺乳头状癌细胞的自噬。本课题组在前期通过生物信息学软件Targetscan预测,发现lncRNA GAS8-AS1和miR-135b之间存在调控靶点。张彦兵等[19]发现,miR-135b可通过靶向Hippo信号通路相关基因促进HCC细胞的侵袭和转移。本研究发现,miR-135b水平高的患者3年总生存率比miR-135b水平低的患者低,且miR-135b高表达是不良预后的独立指标,这也从临床层面验证了张彦兵等[19]研究结果。上述结果同样说明,miR-135b可能是HCC的潜在预后预测因子。
综上,lncRNA GAS8-AS1在HCC组织中表达下调,而miR-135b在HCC组织中表达上调,两者间存在调控位点且均可作为HCC患者潜在的预后生物标志物。但目前为止,lncRNA GAS8-AS1和miR-135b在HCC中的作用机制尚不十分明确,今后需通过实验进一步证实。
利益冲突:所有作者均声明不存在利益冲突。
