禽腺病毒的结构及其血清4型检测方法研究进展
2023-02-16王凯莉楚肖冉司振书路建彪李玉保曹胜亮
王凯莉,刘 成,楚肖冉,司振书,路建彪,李玉保,曹胜亮
(聊城大学农学院,山东聊城 252000)
血清4型禽腺病毒(Fowl adenovirus serotype-4,FAdV-4)属于Ⅰ群禽腺病毒的C种,主要引起肝炎-心包积液综合征(Hepatitis-hydropericardium syndrome,HHS)[1]。1987年巴基斯坦安卡拉地区最早报道该病,随后在世界各地如美国、墨西哥、波兰、匈牙利、智利、日本、印度和中国都有病例报道[2],给全球家禽养殖业造成了巨大的经济损失,对其进行快速检测和诊断显得尤为重要,目前检测FAdV-4的方法主要集中在分子生物学和血清学检测。分子生物学检测方法中聚合酶链反应(polymerase chain reaction,PCR)及实时荧光定量PCR(real-time PCR)是国内外学者的研究热点,血清学诊断方法中酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)报道最多。本文就禽腺病毒的基因组结构、蛋白结构及FAdV-4的检测方法进行综述,以期为该病的快速检测和科学防控提供理论和技术支持。
1 禽腺病毒的基因组结构
禽腺病毒是一种无囊膜的双股DNA病毒,病毒粒子直径为70 nm~90 nm,呈20面体对称结构,基因组大小为45 kb左右[3]。成熟的病毒由衣壳和芯髓组成[1],其衣壳由主要结构蛋白六邻体蛋白(Ⅱ)、五邻体蛋白(Ⅲ)、纤突蛋白(Ⅳ)和次要结构蛋白(Ⅲa、Ⅵ、Ⅷ和Ⅸ)组成。其中,六邻体蛋白是含量最多的衣壳蛋白[1]。其芯髓包括病毒基因组及其相关蛋白Ⅴ、Ⅶ、mu蛋白和末端蛋白(TP)(图1)[1-3]。
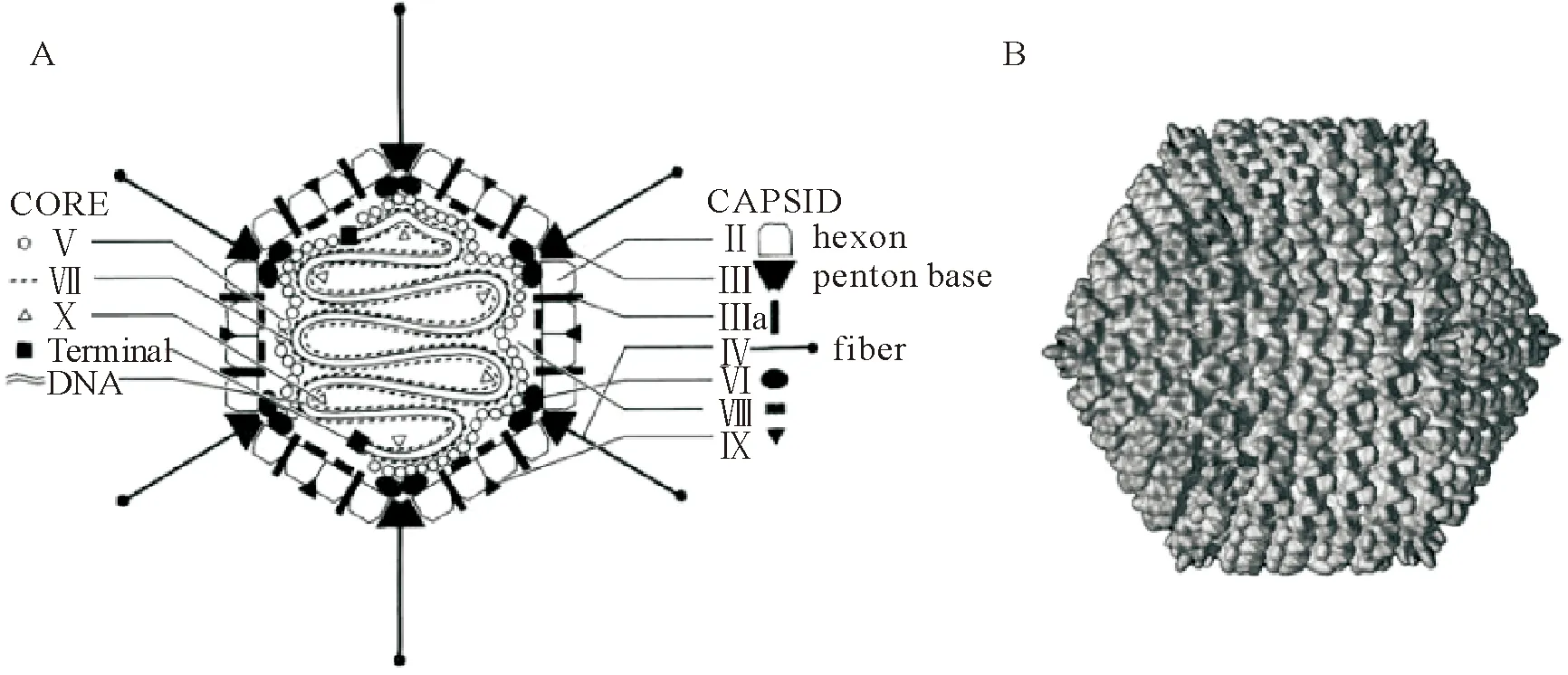
图1 (A)禽腺病毒DNA和蛋白质结构示意图;(B)腺病毒衣壳结构模式图
FAdV的基因组分为编码区和非编码区两个部分;根据病毒DNA复制的起始时间不同,编码区又分为早区(E)和晚区(L),早区分为E1-E4 4个区,晚区分为L1-L5 5个区[4]。E1和E2均分为A和B两部分,E1是病毒基因转录的起始因子;E2的主要功能是参与和调节病毒的复制;E3的产物与病毒逃避宿主的免疫机制有关,是病毒的非必需区;E4表达产物与病毒复制、晚期基因表达和宿主细胞活动中止等活动有关[5]。早期基因组的表达产物是编码诱导病毒复制的必需蛋白E1、E2和E4,以及非必需蛋白E3;晚期基因组的表达产物主要是病毒的结构蛋白(Ⅱ、Ⅲ、Ⅳ、pⅧ、pⅥ、核心蛋白、核心蛋白1、DBP、Ⅳa2、52 ku、100 ku)[4-5]。
2 禽腺病毒的蛋白结构
2.1 六邻体hexon
六邻体是一种伪六边形三聚体,位于20面体衣壳的20个面上。衣壳中有240个六邻体,根据它们所处的位置不同,将其分为H1、H2、H3和H4 4种六邻体[6]。其中60个H1与12个顶端的五邻体相关,也被称为周围六邻体;其余的六邻体在20面体的20个面上被分为“9组”又称GONs(group-of-nine),H2在双轴上,H3在三轴上,其余的为H4。六邻体蛋白是FAdV-4的主要衣壳蛋白,含有群、亚群和型特异性抗原决定簇,与致病性关系密切,是禽腺病毒分型的主要依据[6]。
2.2 五邻体penton和纤突fiber
五邻体蛋白在20面体的12个顶角,每个五邻体蛋白上有一条(Ⅱ 群、Ⅲ 群禽腺病毒)或两条(Ⅰ 群禽腺病毒)纤维突起,纤突顶端形成头节区(knob)[4]。在Ⅰ 群禽腺病毒中,除血清1型腺病毒长纤突的长度是短纤突的4倍外,其余11个血清型两条纤突的长度是相似的[4]。纤突蛋白由头节区、杆区和尾区三部分构成。头节区是纤突蛋白的功能区,也是腺病毒与细胞表面受体特异性结合的区域;杆区部分由多个重复序列构成,具有型特异性;尾区是氨基酸保守区[7]。Fiber蛋白上有禽腺病毒的重要抗原,其中Fiber2蛋白具有主要的型特异性和亚属特异性,能够识别细胞受体并与之结合,从而介导病毒感染,同时又能够刺激机体产生中和抗体,在诱导机体产生免疫反应方面有重要作用[6]。五邻体蛋白和纤突蛋白的功能彼此关联,五邻体与细胞表面的整联蛋白作用,有助于腺病毒的侵入和内化,纤突蛋白既能识别细胞膜上特异性受体引起感染,还可以阻断大分子的合成,抑制病毒增殖,具有抗原性[3-4]。
2.3 五邻体基质penton base
五邻体基质在20面体衣壳顶端占据重要位置,并通过与相邻的衣壳粒子、周围六邻体和Ⅲa相互作用,在稳定衣壳方面发挥关键作用[8]。但其是衣壳中最薄弱的部位,对热、胰蛋白酶、pH和离子强度变化敏感[9]。Penton base蛋白折叠成2个结构域,一个为单个卷状,一个为暴露在外部向上的插入域。向上的插入域含有高变环,高变环携带RGD序列,该序列在病毒粒子内化过程中发挥重要作用[10]。
2.4 其他蛋白结构
蛋白Ⅲa是腺病毒保守的基因之一,但是腺病毒在不同的物种之间有种、属差异,存在于20面体的每个非对称单元(asymmetric unit,AU),总拷贝数为60[8,11]。其参与病毒的组装和成熟,也可能在进入细胞中起作用,因为它是病毒粒子最早释放的成分,也是最不耐热的衣壳成分之一[8]。多肽Ⅵ是一种多功能的蛋白质,在腺病毒感染过程中发挥多种作用,在病毒进入细胞的过程中,其N端两亲性螺旋的改变使病毒易于进入细胞质[8]。RUX J J等认为多肽Ⅵ在衣壳内表面锚定5个六邻体并将衣壳连接到核心[12]。多肽Ⅷ位于内衣壳表面,与六邻体相关并且以每个病毒粒子120个拷贝的形式存在[8]。多肽Ⅸ是位于AdV外衣壳的唯一次要外壳蛋白,在每个病毒粒子中存在240个拷贝,作为黏合剂使每个20面体中心的九个六邻体聚合在一起[8-9]。Saban S D等[8]研究发现,蛋白质Ⅸ的保守N端结构域(氨基酸1-39)是稳定腺病毒衣壳所必需的。San M C等[13]通过研究发现IX可能在调节病毒趋向性和/或干扰免疫反应中发挥作用。Gallardo J等[11]认为蛋白质Ⅵ是腺病毒进入宿主细胞的关键因素。
3 血清4型禽腺病毒的血清学检测方法
FAdV-4的血清学检测方法包括病毒中和试验(virus neutralization test,VNT)、琼脂凝胶免疫扩散试验(agar gel immunodiffusion test,AGIDT)、ELISA和免疫荧光技术(immunofluorescence assay,IFA)。
3.1 病毒中和试验
病毒中和试验是根据病毒抗原与相应抗体结合后,失去感染能力建立的。可用于检测中和抗体的效价、鉴定病毒种型和病毒抗原分析。邹开宇等[14]分别制备了4型、8a、8b和11型禽腺病毒的单因子血清进行交叉中和试验,结果表明FAdV-4的血清除能中和其自身血清外还可中和FAdV-11。
3.2 琼脂凝胶免疫扩散试验
琼脂凝胶免疫扩散试验是可溶性抗原与相应抗体在半固体琼脂凝胶内扩散,当抗原与抗体比例适当时会出现一条白色的沉淀线,可通过肉眼观察沉淀线的有无来确定试验结果。国纪垒等[15]制备了12个血清型的抗血清进行双向琼脂扩散试验,成功对其分离的4株病毒进行了分型。
3.3 酶联免疫吸附试验
酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)是将抗原或抗体吸附于固相载体,在载体上进行染色,从而用酶标仪或肉眼观察直接判定结果,该法敏感性强、特异性高,是目前发展最快也是试剂盒应用最广的一项技术。粟元文等[16]将鸭源FAdV-4 hexon蛋白1 011 bp的基因表达的蛋白作为抗原进行包被,建立了检测FAdV-4抗体的间接ELISA方法,并对灭活疫苗免疫的鸭场和感染FAdV-4的鸭场进行检测,测得免疫合格率和感染阳性率分别为96.46%和99.46%,而未免疫和未感染FAdV-4的鸭场阳性感染率为0。马洪超[17]将FAdV-4的hexon基因表达的蛋白作为包被抗原建立检测 FAdV-4抗体的间接ELISA方法,对FAdV-4流行地区的100份血清进行检测的阳性率为25%,而琼脂扩散试验的检出率为21%。Rajasekhar R等[18]将FAdV-4六邻体免疫显性部分的737 bp克隆到pRSET载体,获得重组蛋白,建立单血清稀释ELISA和Dot-ELISA检测方法,ELISA对临床样品检测的滴度范围为(3.76±0.04)log10~(4.431±0.12)log10,Dot-ELISA的检测滴度范围为(1.445±0.02)log10~(1.968±0.08)log10灵敏度、特异性和准确性均高于琼脂凝胶免疫扩散试验(AGIDT)。万文妍[19]用FAdV-4 hexon(469-775aa)蛋白制备单克隆抗体,将其作为捕获抗体建立了双抗体夹心ELISA检测方法,最低可检测0.1 μg的病毒;并且还用FAdV-4 fiber2蛋白C端头节区作为诊断抗原建立了间接ELISA方法,对临床50份样品进行检测的结果与hexon特异性引物检测的PCR结果一致。
田开月等[20]将中国流行株FAdV-4的fiber2编码基因进行密码子优化后得到的fiber2蛋白作为包被抗原,建立了检测FAdV-4抗体的间接ELISA方法,对临床60份样品的检测结果与fiber2特异性引物的扩增结果一致。王萍[21]用FAdV-4毒株免疫小鼠,用间接ELISA方法鉴定出4株抗FAdV-4 Fiber2单克隆抗体,选用两种建立了双抗体夹心ELISA检测方法,对样品的最低检出率为12.5 ng/mL。Shao H X等[22-23]分别制备FAdV-4 fiber1和fiber2的两种单克隆抗体,将其分别作为捕获抗体和检测抗体建立夹心ELISA和检测FAdV-4的夹心ELISA,基于fiber1建立的夹心ELISA可有效检测FAdV-4/10,而检测FAdV-4的夹心ELISA的检测限度与王萍[21]建立的夹心ELISA相同。值得注意的是,邵红霞建立的基于fiber2 的夹心ELISA也与FAdV-10发生反应,因为FAdV-10和FAdV-4均属于FAdV-C种,且具有相似的fiber2蛋白,这与Feichtner F等[24]使用基于fiber2的ELISA特异性检测FAdV-4抗体时报告的结果一致。梅楠等[25]将FAdV-4 AQ强毒株的fiber-2基因截短体(112 bp-1 440 bp)表达的蛋白作为包被抗原,建立了检测FAdV-4的ELISA检测方法,对临床13份样品的检测结果与琼脂扩散试验完全吻合。
3.4 其他血清学检测方法
Feichtner F等[10]基于重组FAdV纤突蛋白建立了6种不同血清型FAdV-1、-2、-4、-8a、-8b和-11的复合荧光微球免疫分析(fluorescent microsphere immunoassay,FMIA)是一种多重血清学诊断工具,可用于在单一反应中同时检测和区分相应抗体。何子荣等[26]将FAdV-4 JSJ13毒株的整个fiber2基因表达的蛋白作为抗原建立I-ELISA检测方法,该方法的灵敏性和特异性均为100%,可用于检测鸡体内的FAdV-4抗体。万文妍[19]根据hexon基因设计特异性RPA引物,建立了RPA-LFD(重组酶聚合酶扩增-胶体金侧向流试纸条)检测方法,最低检测限度为100拷贝,敏感性是常规PCR的100倍,可用肉眼观察试验结果,适用于FAdV-4的现场诊断和流行病学调查。
3.5 间接免疫荧光法
间接免疫荧光法(indirect immunofluorescence assay,IFA)是将荧光染料与抗体连接,制成荧光抗体,当抗原与抗体结合时,用荧光显微镜观察即可对待检抗原进行定性和定位。国纪垒[15]制备了不同血清型的兔抗Ⅰ群FAV IgG,建立了Ⅰ群FAV的IFA,并对人工感染鸡的各组织器官进行检测,研究了病毒在鸡体内的分布和组织嗜性。
4 血清4型禽腺病毒的分子生物学检测方法
腺病毒分子生物学检测方法包括聚合酶链反应(polymerase chain reaction,PCR)、实时荧光定量PCR(real-time PCR)限制性片段长度多态性聚合酶链反应(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)、环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)和核酸探针技术[27]。
4.1 聚合酶链反应及实时荧光定量聚合酶链反应
PCR是检测FAdV的主要方法,有高灵敏度、简单性、选择性和快速性,腺病毒的六邻体基因由保守的基底区和高变环区组成,是检测腺病毒的主要引物设计区[20]。而实时荧光定量PCR可以通过荧光强度的变化对病毒进行定量分析。Mase M等[28]建立了一种基于凝胶的常规PCR检测方法,可用于同时检测和区分FAdV1、2、4、8a和8b。Sharif N等[29]从六邻体的外显子区域设计了3对引物,可同时检测FAdV1、FAdV-4和FAdV-11。刘琳等[30]根据FAdV-4hexon基因序列设计引物和探针,建立了TaqMan探针荧光定量PCR检测方法,最低检测量为50拷贝/μL。张云丹等[31]在FAdV-4 hexon的保守区域设计合成一对引物和TaqMan探针,建立FAdV-4 FQ-PCR检测方法,最低检出浓度为2.03拷贝/μL。罗洋洋等[32]根据FAdV-4的hexon基因设计了一对引物和TaqMan探针,对临床50份样品进行检测,结果显示其建立的TaqMan荧光定量方法和普通PCR方法完全符合,并且荧光定量方法检出的阳性样本比普通PCR方法多5份。
4.2 限制性片段长度多态性聚合酶链反应
限制性片段长度多态性聚合酶链反应(PCR-RFLP)将扩增后的PCR产物用特异性内切酶切割后,直接用凝胶电泳观察结果。Raue A等[33]在六邻体蛋白保守区构建了两对引物H1/H2和H3/H4, 高变区构建了一对引物H5/H6,H1/H2和H3/H4扩增的片段经HaeⅡ酶切后,可以区分12种FAV参考毒株,并能区分FAV和EDS病毒。Mase M等[34]基于FAdV-4和FAdV-10的fiber1基因设计引物,用AluⅠ酶通过PCR-RFLP分析将心包积水综合征FAdV-4 分离株与其他FAdV-4毒株区分开来。
4.3 环介导等温扩增法
环介导等温扩增法(loop-mediated isothermal amplification,LAMP)是在目的基因的6个区域设计4条引物,在恒温条件下即可进行反应,可以通过肉眼观察(焦磷酸镁白色沉淀)判定结果。Xie Z X等[35]首次建立了LAMP方法用于检测和鉴定 Ⅰ 群禽腺病毒株。Yuan X Y等[36]建立了一种对FAdV具有强特异性的LAMP实时浊度法,对FAdV-4具有特异性,检测下限为75拷贝/μL。
4.4 核酸探针技术
核酸探针技术是用已知的DNA片段作为探针与未知核酸进行杂交试验,根据杂交结果分析其同源性[15]。董婷婷[37]制备了地高辛标记的禽腺病毒4型核酸探针,特异性良好,且不与1、2、8和12型的病毒发生交叉反应,最低检出量为1 pg,可用于临床诊断。
4.5 其他分子生物学检测方法
现在发表最多的检测腺病毒的方法是PCR,此外还有PCR与其他方法结合建立的检测方法。Steer P R等[38]对六邻体基因的3个区域进行分析后,建立PCR 和高分辨率熔融(HRM)曲线分析的方法,其中Hexon L1 PCR产物的HRM曲线分析可区分所有FAdV血清型。Ganesh K等[39]通过PCR结合Southern杂交成功地从印度的噬血细胞综合征(hemophagocytic syndrome,HPS)病例中检测到FAdV-4。王利丽等[40]根据FAdV-4的penton基因设计引物,建立了检测4型腺病毒的纳米PCR方法(Nano PCR),对FAdV-4的最低核酸检出限度为54拷贝/μL,特异性较强,可用于临床感染的检测。
5 小结
HHS自发现以来给全球养禽业造成了巨大的经济损失,为了加强对该病的防控,使用快速有效的流行病学调查及检测方法尤为重要。检测FAdV-4的方法主要有血清学检测方法和分子生物学检测方法。PCR检测是目前用的最多,也是国内外学者研究最多的方法,大多数PCR检测方法的引物设计是在hexon基因,也有在penton基因设计引物成功检测4型禽腺病毒的报道[33]。由于real-time PCR可对病毒进行定量,近年来也有real-time PCR对FAdV-4进行定量的报道,其他与PCR相结合的检测方法如PCR-RFLP,可将PCR产物用酶切之后直接进行凝胶电泳观察,根据产生的基因片段的大小进行分型。LAMP灵敏度高、反应时间短、设备要求简单,也受到了众多学者的关注。ELISA具有操作简单、快速、特异性强等优点,常被用作血清流行病学调查的主要方法。近年来国内外学者建立的ELISA检测方法,大多都是基于禽腺病毒的衣壳蛋白,尤其是fiber蛋白,这与fiber蛋白能识别细胞受体并刺激机体产生中和抗体介导免疫反应的特性有关。同时,由于ELISA方法简便、快速等优势,已成为临床检测禽腺病毒感染的一种重要检测方法。
