猪德尔塔冠状病毒CHN/20GXNN-1/2020分离鉴定及遗传进化分析
2023-02-16速雪丽秦毅斌韦祖樟黄伟坚欧阳康
速雪丽,秦毅斌,陆 颖,杜 琛,赵 武,何 颖,陈 樱,韦祖樟,黄伟坚,欧阳康*
(1.广西大学动物科学技术学院/广西高校动物疫病预防与控制重点实验室,广西南宁 530005;2.广西壮族自治区兽医研究所,广西南宁 530005;3.广西壮族自治区兽用生物制品工程研究中心,广西南宁 530005;4.广西畜禽繁育与疾病防控重点实验室,广西南宁 530005)
猪德尔塔冠状病毒(Porcine deltacoronavirus,PDCoV)是一种新兴的猪肠道病毒,其感染哺乳仔猪后的临床症状与其他腹泻类病毒相似,主要表现为腹泻、呕吐、脱水和死亡[1-2]。PDCoV是冠状病毒科(Coronaviridae)、δ冠状病毒属(Deltacoronavirus)的成员,基因组大小约25.4 kb[3]。除了3′端的poly(A)尾外,主要编码4种结构蛋白,即纤突(spike,S)蛋白、小膜(envelope,E)蛋白、膜(membrane,M)蛋白和核衣壳(nucleocapsid,N)蛋白,以及3种非结构蛋白NS6、NS7和NS7a[2]。其中,S蛋白含有1 159个或1 160个氨基酸残基,主要参与宿主细胞吸附和融合[4],同时诱导机体产生中和抗体,具有高度的免疫原性[5]。PDCoV最早于2012年被香港大学的Woo P C等[6]在临床样品中发现,但直到2014年在美国暴发后才开始受到关注[7]。随后,PDCoV不仅在韩国、加拿大、日本、越南和泰国等地相继暴发,中国内陆也多次报道了PDCoV疫情[8-9]。PDCoV可以有效感染不同来源的动物细胞[10],但只在猪肾小管上皮细胞(LLC-PK细胞)和猪睾丸细胞(ST细胞)上具有良好的病毒感染和连续传代效果,当培养基补充适宜浓度的外源胰蛋白酶时,PDCoV增殖能力显著增强[9,11-21]。此外,PDCoV还可以感染牛犊、雏鸡、雏鸟等动物并使其发生腹泻,PDCoV表现出了跨物种传播的能力[13]。近年来,广西地区不断出现PDCoV疫情,新生仔猪的感染率较高,但对PDCoV的相关研究较少。本研究对广西地区20份PDCoV阳性样品进行细胞传代培养,通过细胞病变效应(cytopathic effect,CPE)、RT-PCR/RT-qPCR鉴定、间接免疫荧光试验(indirect immunofluorescent assay,IFA)、TCID50测定及S基因进行克隆测序分析等方法将分离病毒鉴定为PDCoV,为进一步开展PDCoV生物学特性研究、致病性研究和疫苗研制奠定了基础。
1 材料与方法
1.1 材料
1.1.1 细胞、病毒及抗体 LLC-PK细胞和PDCoV毒株CHN/GX/1468B/2017,由广西壮族自治区兽医研究所提供并保存于广西大学动物传染病与分子免疫学实验室。PDCoV-N蛋白多克隆抗体按常规方法制备,并由广西大学动物传染病与分子免疫学实验室保存。
1.1.2 主要试剂 DMEM(高糖)培养基、胎牛血清,康宁生命科学(吴江)有限公司产品;磷酸盐缓冲液(DPBS),博士德公司产品;AxyPrepTM Body Fluid Viral DNA/RNA Miniprep Mix,AxyPrep公司产品;2.5 mg/mL胰酶,Sigma公司产品;双抗(青霉素-链霉素混合液),BI公司产品;DNA标准DL 2 000、pMD18-T载体、dNTP mix,宝日医生物(北京)有限公司产品;2×TaqMaster Mix,诺唯赞生物科技股份有限公司产品;胶回收试剂盒和质粒小量抽提试剂盒,Omega公司产品;大肠埃希氏菌DH5α感受态细胞,广西南宁康维生物科技有限公司产品;ProteinFind Goat anti-Rabbit IgG(H+L),上海百赛生物技术股份有限公司产品。
1.1.3 主要仪器 PCR仪,ProFlex公司产品;LightCycler 96实时荧光定量PCR仪,Roche公司产品;微量移液枪,Eppendorf公司产品;生物安全柜,海尔公司产品;数显恒温水浴锅,HH-2公司产品;二氧化碳培养箱,Thermo Fisher Scientific公司产品;超净工作台,AIR TECH公司产品等。
1.1.4 引物 PDCoV的检测引物参考Zhou X等[14],即PDCoV-MF(5′-GGCAAATTATTGTTTTCATTGCGATCATATGGGCGC-3′)和PDCoV-MR(5′-CTTATACAGGCGAGCGTCACCGGCCTTTGAAG-3′);S基因的扩增引物均参考Sun W等[8],S全基因分为S1和S2进行扩增;即PDCoV-S1F(5′-ATGCAGAGAGCTCTATTGATTATGAC-3′)和PDCoV-S1R(5′-AACTTGCAAGTACTCCGTCTGAACG-3′),PDCoV-S2F(5′-ATTTTCTCTTTCCGTTCAGACGGAG-3′)和PDCoV-S2R(5′-CTACCATTCCTTAAACTTAAAGGACG-3′)。PEDV、TGEV、PRoV检测引物参考先前研究[15]。参考PDCoV毒株CH/GX/1468B/2017(MN025260)N基因设计荧光定量PCR检测引物,即qPCR-NF(5′-AACCTCATGTTGCCAAACGC-3′)和qPCR-NR(5′-GCGTTGAAGGGGTCAACTCT-3′),目的片段大小为112 bp。引物均由杰李生物(上海)技术有限公司合成。
1.2 方法
1.2.1 临床样品 从广西多个集约化养猪场收集了腹泻仔猪的肠道内容物20份,经RT-PCR检测,肠内容物均为PDCoV阳性。用含200 mL/L甘油和1 000 U/mL青链霉素的已灭菌PBS对肠内容物进行5倍稀释,振荡混匀,然后在4 ℃、3 000 r/min下离心5 min,并用0.22 μm无菌过滤器过滤上清液并储存于-80 ℃。
1.2.2 病毒分离与传代 铺满90% LLC-PK细胞单层的6孔培养板接种500 μL过滤后的接种物,在37 ℃下吸附2 h后,弃液,然后补充含5 μg/mL胰蛋白酶的维持培养基。细胞在37 ℃下连续培养,直到观察到CPE。当CPE大于80%时,在-80 ℃反复冻融后收集病毒上清液并储存以备后续传代。按照上述方法将病毒连续盲传20代。
1.2.3 RT-PCR/RT-qPCR检测 分别提取第1、5、10、15、20代病毒的总RNA并反转录为cDNA。用PDCoV、PEDV、TGEV、PRoV的检测引物对第10代病毒进行PCR检测,PCR反应体系为12.5 μL,参考文献[14,16]的方法,对分离病毒进行初步鉴定。用PDCoV荧光定量PCR检测引物分别测定第1、5、10、15、20代病毒的病毒载量,荧光定量PCR反应体系为12.5 μL,反应程序为:95 ℃ 30 s;95 ℃ 10 s,55 ℃ 20 s,共40个循环;95 ℃ 15 s,65 ℃ 60 s,95 ℃ 15 s熔解;37 ℃ 30 s冷却。
1.2.4 IFA试验 将第10代病毒以MOI=0.1接种LLC-PK细胞,当开始出现明显CPE时先用预冷的甲醇在-20 ℃固定15 min,然后用10 mg/mL BSA在37 ℃下封闭1 h,再与稀释50倍的PDCoV N蛋白多克隆抗体在4 ℃作用12 h,最后与稀释500倍的山羊抗兔IgG在37 ℃避光作用1 h,最后在倒置荧光显微镜下观察结果。
1.2.5 病毒滴度测定 根据Zhao Y等[9]描述的方法,分别对第1、5、10、15、20代病毒进行TCID50测定。当96孔培养板的单层LLC-PK细胞铺满至100%后,用含5 μg/mL胰蛋白酶的培养基将病毒稀释为10-1~10-10共11个稀释梯度,每个稀释梯度接种8个孔,每孔接种100 μL,并设置阴性对照。然后在37 ℃下连续培养并每日观察CPE。当观察到第4天时,按照Reed&Muench[9]的方法计算病毒TCID50。
1.2.6 S基因的扩增及序列分析 对第10代病毒的S1基因、S2基因进行基因克隆,方法参照文献[8],将成功构建的pMD18-T-S1、pMD18-T-S2重组质粒送至深圳华大基因生物公司进行序列测定。将获得的S基因全序列分别与GenBank 110株国内外参考毒株进行序列比较和遗传进化分析,其中88株参考毒株参考先前研究[15],剩余参考毒株为近5年国内外流行毒株(表1)。使用DNA Star Lasergene Version 7中的MegAlign软件的“W”算法对序列进行同源性分析,用MEGA6.0软件中的“M”算法对序列进行序列比对,再使用“Neighbor-joining”方法以Bootstrap值为1 000个重复的方法构建遗传进化树,最后使用进化树美化软件iTOL(https://itol.embl.de/)制图。

表1 参考毒株信息
2 结果
2.1 病毒分离结果
第2代病毒接种LLC-PK细胞60 h后开始出现CPE,第4代病毒接种LLC-PK细胞36 h内可观察到细胞变圆、聚集并最终脱落的典型CPE(图1B);正常LLC-PK细胞状态良好(图1A)。结果表明,本研究从疑似PDCoV样品中成功分离得到1株病毒,并将其命名为CHN/20GXNN-1/2020。
2.2 分离毒株RT-PCR鉴定结果
对10代病毒分别用PDCoV、PEDV、TGEV、PoRV的引物进行RT-PCR鉴定。结果显示,在检测的肠道病毒中只有PDCoV为阳性,其PCR产物条带大小与阳性对照基本一致,符合预期结果,而PEDV、TGEV、PoRV这3种常见的肠道病毒均为阴性(图2)。该结果初步表明,本研究分离的病毒为PDCoV。

A.阴性对照;B.CHN/20GXNN-1/2020接种LLC-PK细胞36 h的细胞病变

M.DNA 标准DL 2 000;1.阳性对照;2.第10代毒株;3.PEDV;4.TGEV;5.PoRV;6.阴性对照
2.3 分离毒株间接免疫荧光鉴定
第10代病毒样品接种LLC-PK细胞24 h后可以观察到明显CPE,IFA试验结果显示,在产生CPE的部位可明显观察到针对PDCoV N蛋白的特异性荧光(图3A),而阴性对照无特异性荧光(图3C),结果表明分离病毒为PDCoV。
2.4 病毒滴度测定
为进一步研究PDCoV在LLC-PK细胞中的生长特点,每5代进行一次TCID50和RT-qPCR测定,持续到第20代(表2)。结果显示,PDCoV毒株CHN/20GXNN-1/2020可以在LLC-PK细胞上产生稳定病变,第5代与第1代相比,病毒滴度增加了约8 000倍,病毒载量增加了约20倍。在后续的传代培养中病毒滴度略有增加,病毒载量呈2倍~5倍的增加并保持相对稳定。结果表明,PDCoV毒株CHN/20GXNN-1/2020在LLC-PK细胞中可以增殖,该细胞系适用于PDCoV分离和增殖。

A、B.PDCoV毒株CHN/20GXNN-1/2020接种LLC-PK细胞;C、D.阴性对照
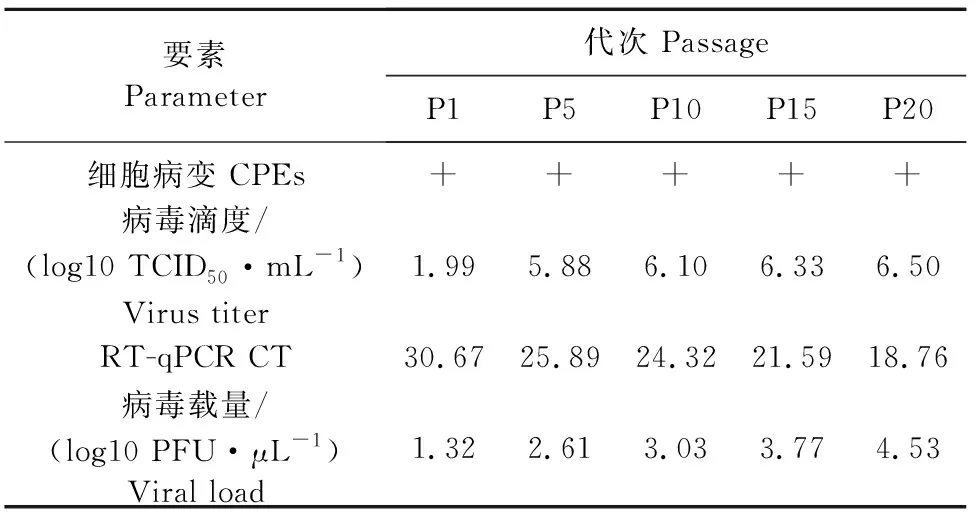
表2 CHN/20GXNN-1/2020毒株低代次到高代次的复制情况
2.5 分离毒株S基因扩增
取第10代病毒进行S1和S2基因的扩增。结果显示, S1基因(图4A)和S2基因(图4B)PCR产物条带大小均与预期的条带大小相符。最终获得S基因全长序列3 480 bp(登录号:OL441343),进一步将分离毒株鉴定为PDCoV。
将PDCoV毒株CHN/20GXNN-1/2020的S基因与最早报道的香港PDCoV毒株CHN/HKU15-44/2009毒株进行序列对比分析发现,S基因存在3 bp的缺失(153 bp-155 bp),这与多数中国参考毒株相似。此外,S基因氨基酸存在23处突变,其中H46Y、D228G、I432V、T550I和T1 036P这5处氨基酸突变是PDCoV毒株CHN/20GXNN-1/2020独有的突变位点。同源性分析结果显示,S基因核苷酸和氨基酸同源性分别为96.4%~98.6%和95.7%~99.0%,同源性最高的是CHN/SC/2015毒株。结果表明,与国内外PDCoV流行毒株相比,PDCoV毒株CHN/20GXNN-1/2020与中国多数PDCoV流行毒株的同源性更高。

A.S1基因;B.S2基因;M.DNA 标准DL 2 000;第10代样品

表3 PDCoV毒株CHN/20GXNN-1/2020与参考毒株的同源性
2.6 分离毒株S基因遗传进化树分析
基于PDCoV毒株CHN/20GXNN-1/2020 S基因的全长序列构建遗传进化树(图5)。S基因遗传进化树显示,PDCoV毒株CHN/20GXNN-1/2020与四川PDCoV毒株、PDCoV毒株CHN/HN-17/2017和PDCoV毒株CHN/HG/2017等在同一分支,这些毒株的S基因在153 bp~155 bp都存在3 bp的缺失。结果表明,与东南亚、美国、日本和韩国的PDCoV流行毒株相比,PDCoV毒株CHN/20GXNN-1/2020与中国绝大多数PDCoV流行毒株有更密切的亲缘关系。

●代表本研究分离毒株
3 讨论
冠状病毒(Coronaviruses,CoVs)可以分为4个属(α、β、γ和δ),宿主范围比较广泛,包括人、禽和哺乳动物,可导致宿主发生急性或慢性呼吸道、肠道和中枢神经系统等相关疾病,致病率和死亡率较高[17]。PDCoV作为δ冠状病毒属主要成员,可感染禽类和哺乳动物,其感染哺乳仔猪后的主要临床特征表现为腹泻、呕吐和脱水等,与其他猪肠道冠状病毒的临床症状极为相似,无法在临床上进行区分,给养猪业带来巨大的经济损失[18-19]。此外,PDCoV常与其他腹泻类病原发生混合感染,导致仔猪的致病率和死亡率增加。目前,对该病尚无疫苗产品,需要对其进行进一步研究。
目前,实验室利用LLC-PK细胞、PK-15细胞及ST细胞成功分离出了PDCoV[16,20-23],但病毒分离成功率非常低。病毒分离一般会被细胞种类、样品的类型、样品中的其他物质及培养基额外添加物等因素所影响[24]。经研究发现,样品质量是PDCoV成功分离的关键因素,如可能包含未知病毒其他病原体、病毒含量极少或样品保存不当等,这些都是限制分离毒株重要因素[12,25]。外源性胰蛋白酶可以增强S蛋白的蛋白水解裂解作用以促进病毒进入宿主细胞,因此,添加胰蛋白酶可以促进冠状病毒感染细胞[26],在病毒分离过程中添加适宜浓度的胰蛋白酶可以有效提高PDCoV分离的成功率[27]。在本研究中,通过添加5 μg/mL胰蛋白酶中对疑似PDCoV的临床腹泻样品进行病毒分离,最终成功分离鉴定出1株新的PDCoV,该毒株病毒滴度及病毒载量在传代培养中可逐渐的增高。
冠状病毒S蛋白的突变影响冠状病毒致病机制和宿主嗜性[28]。本研究所获得的PDCoV毒株CHN/20GXNN-1/2020 S基因序列分析显示存在3 bp(153 bp-155 bp)缺失,而我们前期获得的广西分离PDCoV毒株CHN/GX/1468B/2017 S基因却不存在这种缺失[15],这表明在广西地区至少流行两种类型的PDCoV毒株。目前,这种S基因缺失现象一般在中国分离毒株中较为多见,但在美国、日本、韩国或东南亚的分离毒株中却很少出现,这可能与PDCoV毒株的流行区域特点密切相关,但这需要更多的分子流行病学数据进行论证。S基因的差异可能导致PDCoV毒株毒力的差异,但这种特定的缺失是否有利于病毒的复制和增强病毒毒力还难以定论。PDCoV的中和抗体区域主要位于S蛋白上,S蛋白中主要中和抗体的区域为CTD区域(aa 278-616),目前已经鉴定过的中和抗体区域为COE区域(aa499-638)[17,26]。PDCoV毒株CHN/20GXNN-1/2020 S基因氨基酸有4处突变位于CTD区域,这些突变可能影响该区域中和抗体的功能,但还有待进一步研究。S基因的遗传进化树显示,PDCoV毒株CHN/20GXNN-1/2020主要与四川PDCoV流行毒株、PDCoV毒株CHN/HN-17/2017和PDCoV毒株CHN/HG/2017等中国毒株处于同一进化分支,与东南亚、美国、日韩毒株处于不同的进化枝,表明病毒的流行在地域上存在差异性。这种差异与PDCoV结构基因在进化和传播过程发生的突变密切相关,从而导致这些毒株的亲缘关系发生变化。此外,PDCoV毒株CHN/20GXNN-1/2020与广西地区多数流行毒株亲缘关系较远,说明广西地区的流行毒株有不同的来源,这与广西所处的地理位置有关。本研究确认了广西猪群存在PDCoV感染并成功分离出1株新的PDCoV,为进一步开展PDCoV生物学特性研究、致病性研究和疫苗研制奠定了良好基础。
