双黄连可溶性粉对S180荷瘤小鼠腹腔巨噬细胞C3b和Fc受体的影响
2023-02-16陈冠铭杨丽姿庞定国王正书
陈冠铭,杨丽姿,庞定国,王正书,刘 群*
(1.西南民族大学畜牧兽医学院,四川成都 610041;2.四川大学华西公共卫生学院,四川成都 610041)
单核-吞噬细胞系统成员分布广泛,参与机体特异性免疫和非特异性免疫[1]。巨噬细胞表面具有大量受体,其中C3b受体(CR1)和Fc受体(FcR)在巨噬细胞识别、结合、吞噬抗原的过程中发挥重要作用。C3b受体能与C3补体裂解片段(C3b)特异性结合并介导细胞识别、摄取C3b包被的颗粒和免疫复合物[2-3]。Fc受体能与IgG、IgE、IgA、IgM等抗体的Fc片段特异性结合[4-5]。中药对巨噬细胞表面的C3b受体和Fc受体活性具有调节作用,如五味消毒饮作为一种清热解毒方剂,用于多种疾病的治疗,针对小鼠腹腔巨噬细胞可以提升C3b 受体活性[6];军用固体运动饮料富含黄芪、人参和红景天等中药提取物,可明显增加C3b受体活性[7]。双黄连可溶性粉(金银花∶连翘∶黄芩=1∶2∶1)具有疏风解表、清热解毒的功效,广泛应用于外感风热所致的感冒(症见发热、咳嗽、咽痛),兽医临床上用于脏腑气分实热证、湿热证和热毒证的治疗,由于病原体的清除与免疫系统关系密切,推测双黄连可溶性粉可能参与了免疫调节过程[9-10]。本研究以S180载瘤小鼠为研究对象,腹腔巨噬细胞C3b、Fc受体活性为检测指标,采用EA、YC-花环试验,结合巨噬细胞吞噬鸡红细胞,探讨双黄连可溶性粉对小鼠腹腔巨噬细胞C3b、Fc受体活性的影响,旨在为 双黄连可溶性粉的使用探索更广泛的用途,现将研究结果报告如下。
1 材料与方法
1.1 材料
1.1.1 药物 双黄连可溶性粉,由江西仲襄本草生物有限公司提供(批号:1900301)。
1.1.2 实验动物 SPF昆明小鼠,雌性,6周龄~8周龄,24 g~26 g,成都达硕实验动物有限公司提供(scxk(川)2015-030)。
1.1.3 瘤细胞 S180腹水瘤细胞,由中国医学科学院基础医学研究所基础医学细胞中心提供。
1.1.4 主要试剂 黄芪多糖、酵母菌干粉,西南民族大学临床实验室提供;环磷酰胺,山西普德药业股份有限公司产品;20 mL/L戊二醛、丙酮、甲醇,成都市科隆化学品有限公司产品;瑞特氏染色液,北京索莱宝科技有限公司产品;HE染色液,上海源叶生物科技有限公司产品; DMEM完全培养基,赛默飞世尔生物化学制品(北京)有限公司产品;PBS、Hanks液,武汉博士德生物工程有限公司产品;100 mL/L新鲜羊红细胞悬液、鸡红细胞悬液,南京森贝伽生物科技有限公司产品;兔抗羊红细胞抗体,北京博尔西科技有限公司产品。
1.1.5 主要仪器 压力蒸汽灭菌器(HVE-50),德国HIRAYMA公司产品;数显恒温水浴锅(HWS24),上海一恒科学仪器有限公司产品;恒温培养箱(BD-115),德国BINDER公司产品;微量移液枪,德国Heidolph公司产品。
1.2 方法
1.2.1 双黄连可溶性粉口服液制备 按照生药浓度,用蒸馏水将双黄连可溶性粉配制成200%、100%、50%的口服液,4 ℃保存备用。
1.2.2 S180荷瘤小鼠分组及处理 S180腹水瘤细胞悬液,瘤细胞复苏、传代,经预试验确定最佳接种浓度1×107cells/mL,0.2 mL/只(肉瘤生长良好并能保证整个试验过程中(14 d)瘤体不破裂导致死亡),接种5 d~7 d后,挑选腋下米粒大小瘤体的小鼠,随机分为荷瘤小鼠组、双黄连高剂量组、双黄连中剂量组、双黄连低剂量组、黄芪多糖组、环磷酰胺组,另设空白对照组(非荷瘤小鼠),每组24只。各组处理如下:
荷瘤小鼠组,每日灌胃生理盐水0.2 mL/只;双黄连高剂量组,每日灌胃200%双黄连口服液0.2 mL/只;双黄连中剂量组,每日灌胃100%双黄连口服液0.2 mL/只;双黄连低剂量组,每日灌胃50%双黄连口服液0.2 mL/只;黄芪多糖组,每日灌胃浓度200 mg/kg的黄芪多糖0.2 mL/只;环磷酰胺组,每日灌胃浓度20 mg/kg的环磷酰胺0.2 mL/只;空白对照组,每日灌胃生理盐水0.2 mL/只。
连续灌胃14 d。在第4(4 d)、7(7 d)、14(14 d)次灌胃后24 h,每组随机抽取8只小鼠,腹腔注射5 mL无血清DMEM培养液并轻揉腹部2 min,剖腹收集腹腔巨噬细胞进行C3b、Fc受体活性检测和吞噬试验。
1.2.3 Fc受体检测 采用EA花环试验检测小鼠腹腔巨噬细胞Fc受体活性。单层巨噬细胞载玻片(腹腔巨噬细胞悬液0.5 mL)+EA悬液0.4 mL(100 mL/L新鲜羊红细胞悬液+等量兔抗羊红细胞抗体(1∶1 000稀释)),37 ℃温育1 h,冲洗以除去非黏附的巨噬细胞和杂质,瑞特氏染色,镜检,计数200个巨噬细胞,计算EA花环形成率。
1.2.4 C3b受体检测 采用YC花环试验检测小鼠腹腔巨噬细胞C3b受体活性。单层巨噬细胞载玻片(腹腔巨噬细胞悬液0.5 mL)+YC悬液0.4 mL(小鼠血清(1∶20比例稀释)+酵母菌5 mg/mL),37 ℃温育1 h,冲洗以除去非黏附的巨噬细胞和酵母菌颗粒,H-E染色,镜检,计数200个巨噬细胞,计算YC花环形成率。
1.2.5 吞噬活性检测 采用巨噬细胞吞噬鸡红细胞试验检测小鼠腹腔巨噬细胞吞噬活性。单层巨噬细胞载玻片(腹腔巨噬细胞悬液0.5 mL)+鸡红细胞悬液0.4 mL(1.25×107/mL),37 ℃温育30 min,冲洗以除去非黏附的巨噬细胞和红细胞,瑞特氏染色,镜检,计数200个巨噬细胞,计算吞噬百分率和吞噬指数。
2 结果
2.1 镜检结果
巨噬细胞EA花环、YC花环见图1和图2。

紫色:巨噬细胞;粉红色:致敏绵羊红细胞

不规则:巨噬细胞;长杆状:致敏性酵母菌
2.2 Fc受体活性
各组小鼠在不同检测时间点的EA花环率见表1和表2。
表1显示,各检测时间点(4、7、14 d)荷瘤小鼠组的EA花环率与空白组比较差异不显著(P>0.05);黄芪多糖组的EA花环率极显著高于空白组和荷瘤小鼠组(P<0.01);环磷酰胺组的EA花环率与空白组和荷瘤小鼠组相当(P>0.05);3个受试剂量药物组的EA花环率均极显著高于空白组、荷瘤小鼠组和环磷酰胺组(P<0.01),并与黄芪多糖组相当(P>0.05),3个受试剂量药物组间虽然差异不显著,但随着剂量浓度的增加,EA花环率的绝对平均值呈上升趋势。
表2显示,随着给药次数的增加(4 d~14 d),3个受试剂量药物组和黄芪多糖组的EA花环率呈上升趋势,其中低剂量组在给药14 d之后,花环率显著高于4 d给药时(P<0.05)。结果表明,接种S180瘤细胞,荷瘤小鼠腹腔巨噬细胞Fc受体活性不受影响;免疫抑制剂环磷酰胺对小鼠腹腔巨噬细胞Fc受体活性无影响;连续给予4 d~14 d不同剂量的双黄连口服液(生药浓度50%~200%),荷瘤小鼠腹腔巨噬细胞Fc受体活性增强,作用与黄芪多糖相当。
2.3 C3b受体活性
各组小鼠在不同检测时间点的YC花环率见表3和表4。表3显示,各检测时间点(4、7、14 d)荷瘤小鼠组的YC花环率与空白组比较无显著差异(P>0.05);黄芪多糖组的YC花环率显著高于空白组和荷瘤小鼠组(P<0.01);环磷酰胺组的YC花环率明显低于空白组和荷瘤小鼠组(P<0.05);3个受试剂量药物组的YC花环率均极显著高于空白组、荷瘤小鼠组和环磷酰胺组(P<0.01)并与黄芪多糖组相当(P>0.05),但组间差异不显著。
表4显示,随着给药次数的增加(4 d~14 d),3个受试剂量药物组和黄芪多糖组的YC花环率变化不大,差异不显著。结果表明,接种S180瘤细胞,荷瘤小鼠腹腔巨噬细胞C3b受体活性不受影响;免疫抑制剂环磷酰胺具有降低小鼠腹腔巨噬细胞C3b受体活性的作用;连续给予4 d~14 d不同剂量的双黄连口服液(生药浓度50%~200%),荷瘤小鼠腹腔巨噬细胞C3b受体活性增强,作用与黄芪多糖相当。

表1 EA-花环率组间比较
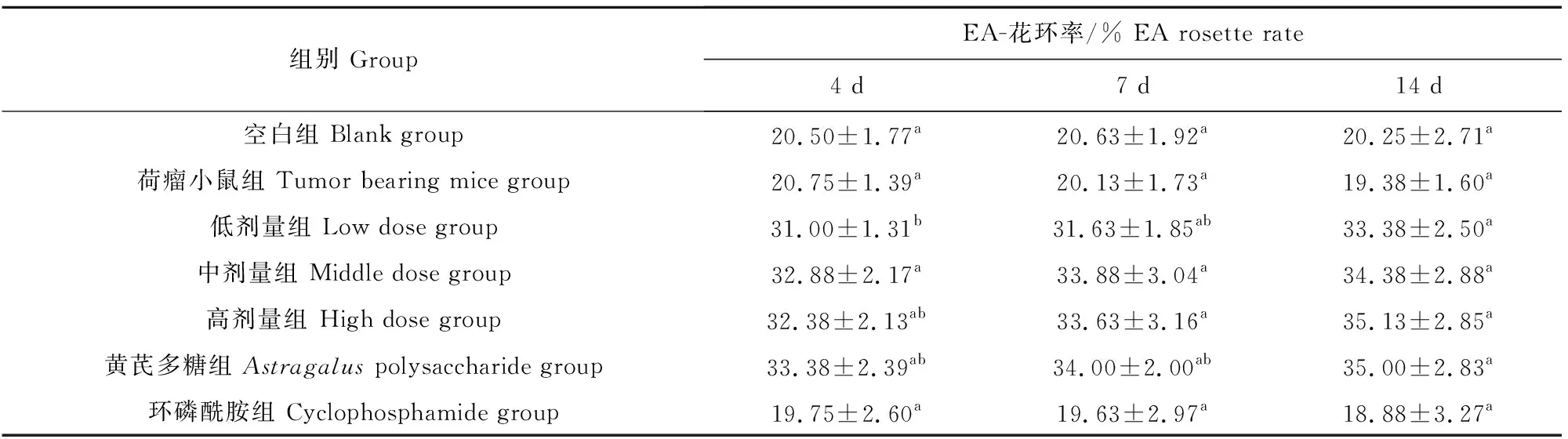
表2 EA-花环率组内比较

表3 YC-花环率组间比较

表4 YC-花环率组内比较
综合EA、YC花环试验结果,接种S180瘤细胞,荷瘤小鼠腹腔巨噬细胞Fc、C3b受体活性不受影响;免疫抑制剂环磷酰胺具有降低C3b受体活性的作用(对Fc受体活性没有影响);黄芪多糖对Fc、C3b受体活性具有增强作用;连续给予4 d~14 d不同剂量的双黄连口服液(生药浓度50%~200%),荷瘤小鼠腹腔巨噬细胞Fc、C3b受体活性增强。
2.4 吞噬活性
各组小鼠在不同时间点巨噬细胞吞噬活性(吞噬百分率、吞噬指数)见表5和表6。
表5显示,各检测时间点(4、7、14 d)荷瘤小鼠组腹腔巨噬细胞吞噬鸡红细胞的吞噬百分率与空白组比较无显著差异(P>0.05);黄芪多糖组的吞噬百分率高于空白组和荷瘤小鼠组(4 d、P<0.01,7 d、P<0.05,14 d、P>0.05);环磷酰胺组的吞噬百分率与空白组和荷瘤小鼠组相当(P>0.05);3个受试剂量药物组中,低剂量组的吞噬百分率高于空白组、荷瘤小鼠组和环磷酰胺组(4 d、P<0.01,7 d、P<0.05,14 d、P>0.05),中剂量组的吞噬百分率高于空白组、荷瘤小鼠组和环磷酰胺组(4 d、P<0.01,7 d、P<0.01,14 d、P<0.01),高剂量组的吞噬百分率高于空白组、荷瘤小鼠组和环磷酰胺组(4 d、P<0.01,7 d、P<0.01,14 d、P>0.05),中、高剂量组在连续给药7 d~14 d的吞噬百分率高于黄芪多糖组(P<0.05)。
各检测时间点(4、7、14 d)荷瘤小鼠组腹腔巨噬细胞吞噬鸡红细胞的吞噬指数与空白组比较无显著差异(P>0.05);黄芪多糖组的吞噬指数极显著高于空白组和荷瘤小鼠组(P<0.01);环磷酰胺组的吞噬指数与空白组和荷瘤小鼠组相当(P>0.05);3个受试剂量药物组中,低剂量药物组的吞噬指数,在4、7 d两个时间点高于空白组、荷瘤小鼠组和环磷酰胺组(P<0.01、P<0.05),中剂量组吞噬指数在4、7、14 d这3个时间点高于空白组、荷瘤小鼠组和环磷酰胺组(P<0.01、P<0.01、P<0.01),高剂量组吞噬指数在4、7、14 d这3个时间点高于空白组、荷瘤小鼠组和环磷酰胺组(P<0.01、P<0.01、P<0.05),中、高剂量组的吞噬指数在连续给药7 d~14 d高于黄芪多糖组(P<0.01、P<0.05)。
表6显示,随着给药次数的增加(4 d~14 d),3个受试剂量药物组吞噬百分率的呈上升下降趋势,7 d高于4 d和14 d,其余各组变化不大,差异不显著。结果表明,接种S180瘤细胞,荷瘤小鼠腹腔巨噬细胞吞噬活性不受影响;免疫抑制剂环磷酰胺对小鼠腹腔巨噬细胞吞噬活性无显著影响;连续给予4 d~14 d不同剂量的双黄连口服液(生药浓度50%~200%),荷瘤小鼠腹腔巨噬细胞吞噬活性增强,作用优于或与黄芪多糖相当。
随着给药次数的增加(4 d~14 d),荷瘤小鼠组、黄芪多糖组的吞噬指数呈下降趋势,环磷酰胺组的吞噬指数变化不大,3个受试剂量药物组吞噬指数呈上升下降趋势,7 d高于4 d和14 d。结果表明,接种S180瘤细胞,荷瘤小鼠腹腔巨噬细胞吞噬能力不受影响;免疫抑制剂环磷酰胺对小鼠腹腔巨噬细胞吞噬能力无显著影响;连续给予4 d~14 d不同剂量的双黄连口服液(生药浓度50%~200%),荷瘤小鼠腹腔巨噬细胞吞噬能力增强,作用与黄芪多糖相当。
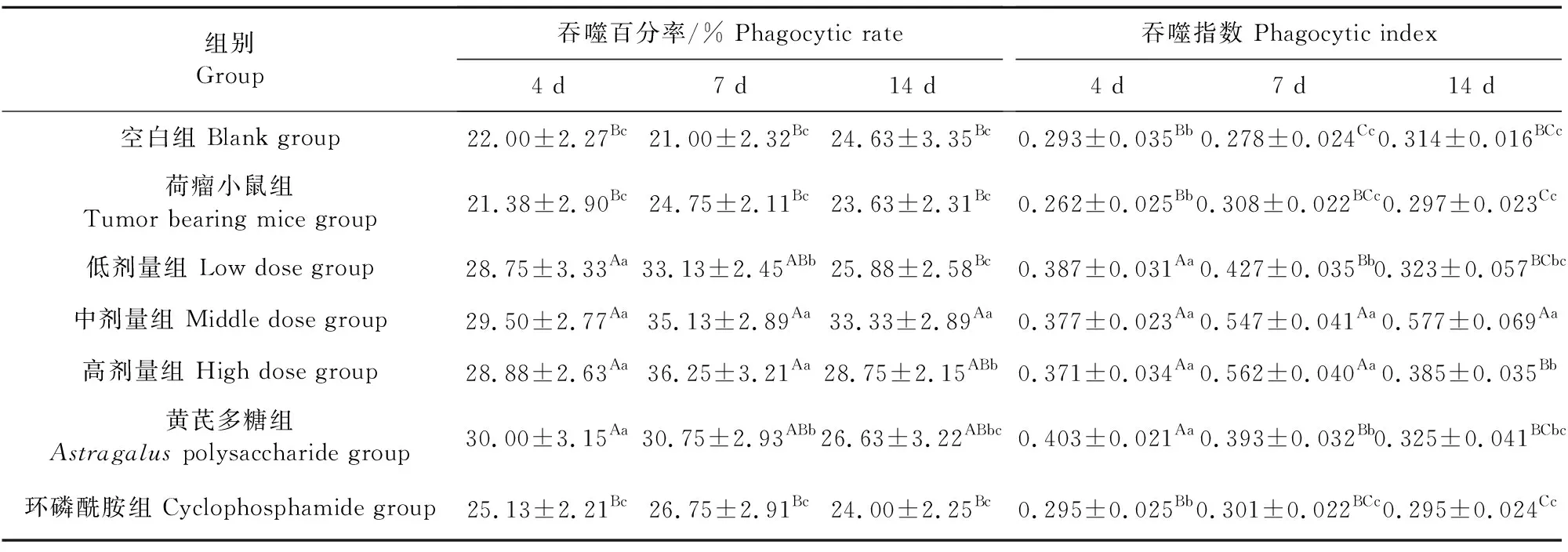
表5 吞噬百分率和吞噬指数组间比较

表6 吞噬百分率和吞噬指数组内比较
综合吞噬百分率和吞噬指数,接种S180瘤细胞,荷瘤小鼠腹腔巨噬细胞吞噬活性和吞噬能力不受影响;免疫抑制剂环磷酰胺对巨噬细胞吞噬活性和吞噬能力无显著影响;连续给予4 d~14 d不同剂量的双黄连口服液(生药浓度50%~200%),荷瘤小鼠腹腔巨噬细胞吞噬活性和吞噬能力增强,作用优于或相当于黄芪多糖。
3 讨论
巨噬细胞作为免疫系统的重要成员,在组织中起着重要免疫作用,不仅具有抗感染、抗炎症和抗肿瘤等免疫功能,还能在组织稳态中调节淋巴管、血管的生成[11]。巨噬细胞C3b、Fc受体参与巨噬细胞发挥功能,其活性高低代表巨噬细胞功能状态(吞噬、分泌等功能),C3b、Fc受体对巨噬细胞功能具有调节作用,辅助巨噬细胞吞噬,促进对与免疫球蛋白和补体蛋白相结合的颗粒的摄取,在溶酶体中被消化和破坏[12-13]。C3b受体能与补体免疫复合物(IC)结合,在清除循环IC中发挥重要作用。这种受体对于防止IC的积累是至关重要的,IC的积累会导致炎症病理。在一定条件下也能促进C3b调理过的颗粒被巨噬细胞吞噬[14]。Fc受体的主要功能是介导巨噬细胞吞噬活动中的特异性吞噬,当Fc受体与抗体的Fc片段结合后,能激活抗体依赖性细胞介导的细胞毒性作用;当巨噬细胞Fc受体失衡时会导致多种自身免疫性疾病,如免疫性血小板减少症 (ITP)、系统性红斑狼疮[15-18]等。C3b、Fc受体的结构不同,C3b受体与配体结合需要二价阳离子的参与,其生物学活性会受到胰蛋白酶的破坏,需要巨噬细胞活化后才可以介导细胞吞噬,而Fc受体则不会被影响,不需要二价阳离子的参与就能与配体结合并能介导其吞噬作用[2]。关于巨噬细胞C3b、Fc受体活性检测方法,目前主要采用EA-花环、YC-花环试验,所谓EA-花环试验是将巨噬细胞Fc受体与相应抗体致敏的红细胞(EA)混合,当5个及以上的EA吸附在巨噬细胞上时会形成以巨噬细胞为中心,周围为红细胞的类似花环的形状,花环率的高低代表Fc受体的活性;所谓YC-花环试验是将巨噬细胞C3b受体与补体致敏的酵母菌(YC)混合,酵母菌被吸附在巨噬细胞上形成以巨噬细胞为中心,周围为酵母菌的类似花环的形状,花环率的大小代表C3b受体的活性[5]。
本研究以S180载瘤小鼠为模式动物,腹腔巨噬细胞为研究对象,C3b、Fc受体活性为检测指标,EA花环、YC花环试验为研究手段,结合巨噬细胞吞噬鸡红细胞,探讨双黄连可溶性粉对巨噬细胞免疫功能的影响,结果表明,小鼠接种S180瘤细胞,荷瘤小鼠腹腔巨噬细胞Fc、C3b受体活性不受影响,免疫抑制剂环磷酰胺具有降低C3b受体活性的作用(对Fc受体活性没有影响),连续给予4 d~14 d不同剂量的双黄连可溶性粉,荷瘤小鼠腹腔巨噬细胞Fc、C3b受体活性增强,吞噬能力增强,作用优于或相当于黄芪多糖,研究结果为双黄连可溶性粉临床使用的研究提供科学依据。
