枸杞内生真菌NQ8GⅡ4定殖促生作用研究
2023-02-15闫思远陈思杰顾沛雯
李 金,闫思远,陈思杰,顾沛雯
(宁夏大学 农学院,银川 750021)
植物内生真菌是指生活史的全部或某一阶段定殖于植物体内,但对宿主植物不造成明显病害症状的一类真菌[1]。有益内生真菌的定殖能够促进宿主植物生长,增强宿主抗逆抗病能力,而内生真菌发挥促生和防病作用的前提是与植物建立良好共生关系[2-3]。目前,用于检测内生真菌在植物体内定殖的方法有基因标记法[4]、抗生素标记法[5]、同位素示踪法[6]、核酸探针法[7]和免疫学等方法[8]。报告基因技术的发展为研究内生真菌在植物中定殖和互作关系提供了极大的便利。绿色荧光蛋白(Green fluorescence protein,GFP)易于检测、对细胞无毒害、表达稳定,在多种生物细胞中均可表达,使其成为广泛应用的分子标记之一[9]。丁婷等[10]利用GFP标记,观察发现杜仲内生真菌DZJ07-6可在小麦根和茎组织的细胞间隙和细胞内大量定殖;陈楠等[11]利用GFP标记的碱蓬内生真菌JP4-1转化子侵染水稻幼苗,并在荧光显微镜下示踪JP4-1菌株及其侵染特性。
枸杞内生真菌NQ8GⅡ4(专利号:CN202010357046.4)分离自‘宁杞8号’健康枸杞的根部,经鉴定为轮状镰刀菌(Fusariumnematophilum)。胡丽杰等[12]研究表明,NQ8GⅡ4菌株对枸杞胶孢炭疽菌(Colletotrichumgloeosporioide)的抑制率高达93.43%,生防菌菌丝能缠绕并穿透胶孢炭疽菌菌丝,使菌丝膨胀崩解。NQ8GⅡ4菌株的发酵滤液对红枣、葡萄等果品的致腐病原真菌具有明显的抑菌作用,能大大降低红枣贮存期间的腐烂速率,延长货架期15d左右[13]。闫思远等[14]研究发现,NQ8GⅡ4菌株仅能定殖于枸杞根部,并成功构建NQ8GⅡ4菌株的遗传转化体系,获得1株与野生型性状一致的GFP标记转化子NQ8GⅡ4-GFP菌株。为明确NQ8GⅡ4菌株的定殖和促生作用,本试验采用生物学方法测定野生型NQ8GⅡ4菌株的促生潜力,研究NQ8GⅡ4-GFP菌株在不同植物根部的定殖情况及对其枸杞的促生作用,以期为该生防菌株作为微生物肥料的开发及应用提供依据。
1 材料与方法
1.1 供试植物
供试种子分别为‘宁杞5号’枸杞(宁夏农林科学院枸杞研究所)、‘绿秀5号’西葫芦(上海汇阳种业有限公司)、‘宁春4号’小麦(宁夏科丰种业有限公司)、‘加州王’芹菜(宁夏科泰种业有限公司)、‘大速生’生菜(青丰种业有限公司)和‘白砂糖’番茄(寿光金鹏种业有限公司),上述种子经消毒(75%酒精,30 s; 1% NaClO,5 min)后栽种到装有已消毒营养土和蛭石(二者等体积混合)的72孔穴盘(54 cm×28 cm×4.5 cm)内,于光照培养箱(RQX-250,上海恒宇公司)中26 ℃、12 h光照/12 h黑暗交替培养培育至3~5片真叶,备用。
1.2 菌 种
野生型NQ8GⅡ4菌株,由胡丽杰[15]从健康枸杞根部分离获得;GFP标记菌株NQ8GⅡ4-GFP由闫思远等[16]通过PEG介导的原生质转化获得,菌种均保存于宁夏大学农学院植物病理学实验室。
1.3 野生型菌株促生活性测定
1.3.1 菌株产赤霉素活性 将NQ8GⅡ4菌株接种于PDB液体培养基,摇菌5 d后利用福林法[17]初步鉴定NQ8GⅡ4产赤霉素能力。定量测定:参考刘文芳[18]的方法建立标准曲线y= 0.924 8x+0.031 3 (R2=0.995),式中y为680 nm处的比色值,x为赤霉素含量(μg),将 NQ8GⅡ4孢子液比色后测定A680 nm,通过与标准曲线比对计算出NQ8GⅡ4菌株产赤霉素的浓度。
1.3.2 菌株产铁载体能力 定性分析:参考汪少林[19]的方法,吸取50 μL的NQ8GⅡ4菌株去铁查氏培养滤液与等体积的CAS检测液混匀,以混合液变为(橙)红色为标准判断是否具有产铁载体活性。定量测定:将NQ8GⅡ4菌株的菌液接种至去铁查氏培养基中摇床培养7 d,将菌液上清液与等体积CAS检测液混合后测定630 nm波长下的比色值(As),用同样的方法测定空白去铁查氏培养液比色值(Ar),以As/Ar分级标准[20]表示产铁载体能力。
1.3.3 菌株解磷、产蛋白酶和纤维素酶定性分析 选择培养基的配制参照文献[21-23],将NQ8GⅡ4菌株接种到改良PVK无机磷培养基、蒙金娜有机培养基、蛋白酶培养基和羧甲基纤维素钠培养基上,28 ℃培养5 d后,通过观察透明圈的大小,判断解磷、产蛋白酶能力。羧甲基纤维素钠培养基则经刚果红染色后,观察降解圈的形成情况判断产纤维素酶活性。
1.4 GFP标记菌株在植物根部的定殖
1.4.1 接种 NQ8GⅡ4-GFP菌株孢子液的制备参考张誉荠等[24]的方法,血球计数板调整浓度为107CFU/mL。选取长势一致的枸杞、番茄、小麦、芹菜、西葫芦和生菜苗,每株幼苗分4次沿根围浇灌200 mL的NQ8GⅡ4-GFP菌液,以无菌水为对照处理,每处理设置6个重复,参照“1.1”条件培养50 d后用于定殖研究。
1.4.2 激光扫描共聚焦显微镜观察 随机取处理后的各植物根段若干,洗净后徒手切片,制成水玻片,利用激光扫描共聚焦显微镜(SP5,德国莱卡公司)在蓝光(488 nm)下观察菌株在植物中的定殖,以无菌水处理的植物为空白对照。
1.4.3 定殖率测定 参考李晓慧等[25]的方法,使用PDA检测法测定NQ8GⅡ4-GFP标记菌株在各植物根部的定殖率,PDA检测培养基中添加50 mg/L Amp和30 mg/L HmB,用于筛选NQ8GⅡ4-GFP标记菌株。样品材料进行表面消毒(方法同“1.1”),每个培养皿均匀摆放9块根样,28 ℃培养,7 d后观察并记录植物根段上菌体生长情况,定殖率=出现目标菌落的根段数量/ 根段总数×100%,每个处理重复3次。
1.5 NQ8GⅡ4-GFP菌株对枸杞的促生作用
按照“1.4.1”的方法配制107CFU/mL的NQ8GⅡ4-GFP孢子液,稀释成106、105、104和103CFU/mL。枸杞苗栽培培养方法同“1.1”,待枸杞苗长至3片真叶后进行灌根处理,每株幼苗分3次沿根围浇灌150 mL的孢子液,以等体积无菌水处理作为对照,每个处理设置9个重复。浇灌30 d后,测量不同接种浓度下枸杞苗株高、根长、叶数、叶面积(长×宽)、根鲜质量和干质量等生长指标,并测量最佳接种浓度下枸杞苗叶片的叶绿素、可溶性糖、可溶性蛋白含量和根系活力等生理指标,每个处理重复6次。叶绿素、可溶性糖含量和根系活力用相关试剂盒测定,可溶性蛋白含量参照蔡庆生[26]的方法,采用考马斯亮蓝法测定。
1.6 数据处理
使用SPSS 23.0对试验数据进行分析,采用单因素方差分析(one-way ANOVA)和事后LSD检验比较不同处理之间的显著性差异(α= 0.05)。两两比较采用t检验,以P<0.01为差异显著。
2 结果与分析
2.1 野生型NQ8GⅡ4菌株的促生活性
产赤霉素定性试验表明,在加入福林试剂后,野生型NQ8GⅡ4菌株的发酵液呈浅绿色(图1- A6),与空白对照的黄色(图1-A1)对比明显,表明NQ8GⅡ4菌株具有产赤霉素的能力。进一步定量分析表明,NQ8GⅡ4菌株培养5 d的发酵滤液中赤霉素含量可达16.6 μg/mL。产铁载体定性分析显示(图1-B),NQ8GⅡ4菌株培养滤液与CAS检测液反应呈橙红色,而空白对照则呈现蓝色,表明NQ8GⅡ4菌株具有分泌铁载体能力。铁载体定量检测As/Ar值为0.7,根据分级标准判定其产铁载体能力为中等。NQ8GⅡ4菌株均可在测定解磷(无机磷和有机磷)、产蛋白酶和产纤维素酶的4种选择培养基上生长,在无机磷PVK培养基上未观察到透明圈(图2-A),而在蒙金娜有机培养基、蛋白酶培养基能够观察到明显的透明圈(图2-B~2-C),在羧甲基纤维素钠培养基可见较明显降解圈(图2-D),上述现象说明NQ8GⅡ4菌株具有一定解有机磷、产蛋白酶和纤维素酶的能力,对植物可能有促生活性。

A.赤霉素福林法比色,1~5分别为0 mg、0.04 mg、0.08 mg、0.16 mg、0.32 mg的赤霉素标准比色液,6为NQ8GⅡ4发酵滤液比色;B.铁载体定性检测;CK.空白对照

A.无机磷PVK培养基;B.蒙金娜有机培养基;C.蛋白酶培养基;D.羧甲基纤维素钠培养基;箭头所指为透明圈(降解圈)
2.2 GFP菌株在植物根部的定殖观察
通过激光共聚焦荧光显微观察,在接种后的50 d,NQ8GⅡ4-GFP标记菌株能够成功定殖于枸杞、番茄、和小麦3种植物根部(图3-A~3-F),而在芹菜、生菜和西葫芦根部均未发现定殖。标记菌株的菌丝通过穿透根侧表皮细胞进入植物根内,随后菌丝逐渐向根内生长,沿根纵向上下延伸。经NQ8GⅡ4-GFP标记菌处理的枸杞、番茄和小麦根部观察均可见绿色荧光,但不同植物的荧光强度有差异。其中宿主植物枸杞根系中标记菌株菌丝荧光强度最强,非宿主植物番茄根系中标记菌株菌丝荧光强度次之,小麦根系中菌丝荧光最弱(图3-D~3-F)。NQ8GⅡ4-GFP菌株菌丝主要定殖于枸杞、番茄和小麦根部皮层组织细胞及细胞连接处,部分侵入维管束组织,并且能明显看到菌丝团,菌丝圈等内生真菌根结构。

A~C.枸杞、番茄和小麦根部明场视野;D~F.枸杞、番茄和小麦根部荧光视野。红色箭头所指为菌丝圈,黑色箭头为菌丝团;标尺为50 μm
2.3 GFP菌株在植物根部的定殖情况
PDA法检测发现,仅枸杞、番茄和小麦的根段长出GFP标记的NQ8GⅡ4菌落,而芹菜、生菜和西葫芦的根段均未见目标菌落,这说明NQ8GⅡ4-GFP标记菌株能在枸杞、番茄和小麦根部定殖,而不能在芹菜、生菜和西葫芦根部定殖,这与激光扫描共聚焦荧光观察的结果一致。定殖分析显示(表1),在宿主植物枸杞根部中的定殖率最高,为93.90%,在非宿主植物番茄根部定殖率次之,为91.84%,在小麦根部中定殖率最低,仅为21.43%,且菌株在枸杞和番茄的定殖率显著地高于小麦。

表1 NQ8GⅡ4-GFP菌株在不同植物中的定殖情况Table 1 Colonization rate of NQ8GⅡ4-GFP strain in different plants
2.4 GFP菌株对枸杞的促生作用
接种NQ8GⅡ4-GFP菌株30 d后,随着接种浓度的增加,NQ8GⅡ4-GFP菌株处理组的生长指标与对照组相比较呈先升高后下降的趋势(图4,表2)。接种浓度为106CFU/mL时,枸杞苗的株高、根长、叶数和叶面积分别是对照组的1.51、1.54、1.5和2.18倍,根鲜质量和干质量是对照组的3.16和2.62倍,具有显著的促生作用。接种浓度为105CFU/mL时株高、叶面积、根鲜质量和干质量分别是对照处理的1.23、1.92、2.28和 2.09倍,也具有一定的促生作用。

1~6分别为0(CK)、107、106、105、104、103 CFU/mL处理组

表2 NQ8GⅡ4-GFP菌株不同接种浓度对枸杞苗生长指标的影响Table 2 Effect of NQ8GⅡ4-GFP strain with different concentrations on growth of Chinese wolfberry seedlings
接种106CFU/mL的NQ8GⅡ4-GFP菌株孢子液后,枸杞苗的叶绿素、可溶性糖、可溶性蛋白质含量和根系活力等生理指标均显著的高于对照组(图5)。叶绿素a、叶绿素b和总叶绿素含量分别是对照组的1.13、2.32和1.39倍;可溶性糖、可溶性蛋白含量和根系活力分别是对照的1.97、3.25和1.41倍。说明接种106CFU/mL的NQ8GⅡ4-GFP菌株孢子液后对枸杞生理指标具有促进作用。
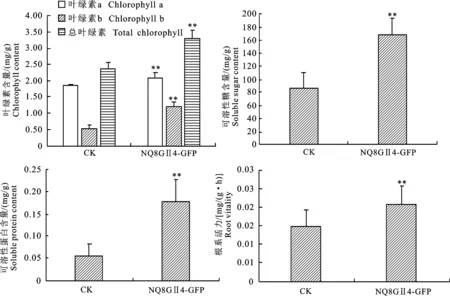
CK表示未接种空白对照。图中数据为“平均数±标准误”。**表示经t检验法比较差异极显著(P<0.01)
3 讨 论
有益内生真菌在宿主植物中的成功定殖,是发挥其促生抗病作用的重要条件[27]。GFP作为一种重要的分子标记,在微生物与宿主之间的互作、环境微生物动态监测等诸多方面展现良好的应用前景[28-29]。赵兴丽等[30]利用GFP标记的钩状木霉ACCC31649-GF21,研究该菌株在辣椒组织中的定殖及扩散规律。Sun等[31]利用GFP标记的稻镰状瓶霉Falciphoraoryzae证明了在拟南芥根部的定殖能力,为后续将拟南芥作为研究促生机制的模型提供了理论支撑。本研究证明GFP标记的NQ8GⅡ4菌株能够在宿主枸杞和非宿主番茄、小麦根部中定殖,可通过菌丝定殖于根部皮层组织细胞或细胞间隙,部分到达维管束组织。同时研究还发现,NQ8GⅡ4-GFP菌株可能更倾向于定殖茄科植物,在枸杞和番茄中的定殖率显著大于小麦,但这一结果还需要进一步扩大宿主植物的定殖范围来证实。
目前,国内外有关枸杞内生真菌的文献报道多为内生真菌多样性和抑菌活性研究,而关于枸杞内生真菌促生效果的研究报道较少。本研究促生活性测定显示NQ8GⅡ4菌株自身具有较强的产赤酶素能力,第5天时菌液中的赤霉素浓度可达 16.6 μg/mL,同时NQ8GⅡ4菌株还具有一定解磷、产铁载体、分泌蛋白酶和纤维素酶的能力,这表明NQ8GⅡ4菌株可通过产植物生长激素和促进宿主植物根系营养元素吸收等机制促进植物生长。盆栽试验显示,接种适宜浓度的NQ8GⅡ4-GFP孢子液后对枸杞苗的生长指标和生理指标等方面均具有显著促进作用,这可能与NQ8GⅡ4菌株自身具有促生活性相关。
有研究认为,有益菌在一定接种浓度范围内可以促进植物生长,过低的接种浓度,对植物促生作用不显著[32]。例如,贾瑞敏等[33]将生防菌QLP12、SL01和Fo47接种甘蓝后发现,菌粉浓度为1.00×107CFU/g时,SL01和QLP12菌株对甘蓝苗鲜质量、株高表现出显著的抑制作用,施用浓度为1.25×106~5.00×106CFU/g时,3株菌株对甘蓝表现出促生作用。李哲[34]发现当FZBA2-gfp菌液浓度为3.65×106CFU/mL时,对小麦的发芽率、根长、苗长以及鲜质量具有显著的促生作用,当浓度过低(3.65×105CFU/mL)促生效果不明显。本研究结果表明NQ8GⅡ4-GFP孢子液浓度为105~106CFU/mL时,对枸杞有显著的促生效果,这也与上述报道的结论类似。在内生真菌与植物共生互作中,内生真菌可作为诱导子激发宿主植物抗逆性或促进生长,但激发的强度与内生真菌的施用浓度、方式和时间等密切相关[35]。本研究讨论了浓度因素对促生作用的影响,施用方式和时间是否影响促生效果也值得进一步探究。
