艾司洛尔联合右美托咪定对重型颅脑创伤术后颅内压波动和脑脊液生物标志物的影响*
2023-02-15张荣业刘朋鑫张林光陈丽颖张荣静
张荣业,董 涛,刘朋鑫,张林光,陈丽颖,张荣静
(河北省秦皇岛市第一医院,河北 秦皇岛 066000)
重型颅脑创伤(sTBI)是指格拉斯哥昏迷量表(GCS)评分为3~8 分,死亡率高,病残率高[1]。患者颅脑损伤后,各种机制引发颅内压升高,经额颞顶去大骨瓣手术,并清除坏死组织、颅内血肿能有效降低死亡率和改善神经预后[2],但仍有许多患者遭受继发性损伤,包括缺血缺氧性损伤、脑水肿、颅内压升高、脑积水,升高了脑功能障碍和神经系统疾病发病率[3]。因此,sTBI 患者的脑监护和保护至关重要。右美托咪定是一种选择性α2肾上腺素受体激动剂,通常用于临床麻醉和重症监护中的抗焦虑、镇静和镇痛,对sTBI 患者具有脑保护作用[4]。艾司洛尔为脑保护剂,可有效降低sTBI 患者的死亡率,联合常规治疗有利于神经功能的恢复,改善预后[5]。两药联用在sTBI 患者围术期的治疗中具有一定效果,但仍有待研究[6]。本研究中回顾性分析了术后联用艾司洛尔和右美托咪对sTBI 患者颅内压波动和脑脊液生物标志物水平的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合《重型颅脑创伤治疗指南(第四版)》诊断标准[7];颅脑外伤史;脑部CT 诊断明确;入院时GCS 评分为3~8 分;术后复查CT 无需再次手术;术后立即监测颅内压(ICP)、有创动脉压等监测;开颅后24 h 内转入ICU;定期完成脑电图检测、脑脊液取样。本研究方案获医院医学伦理委员会批准(批件号为QHD2019-003),患者家属签署知情同意书。
排除标准:收缩压(SBP)< 90 mmHg(1 mmHg =0.133 kPa);对治疗药物过敏;对本研究中所用药物存在禁忌证;严重肝肾功能不全;术后24 h 内死亡;病情变化调整治疗方案。
病例选择与分组:选取我院2020年1月至2021年6月收治的sTBI 患者138 例,按治疗用药的不同分为A 组(78 例)和B 组(60 例)。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。

表1 两组患者一般资料比较Tab.1 Comparison of the patients” general data between the two groups
1.2 方法
围术期按《重型颅脑创伤治疗指南(第四版)》[7]进行监测评估,两组患者均在符合手术适应证后行去骨瓣减压术,术中清除血肿和坏死脑组织,经额部皮质穿刺侧脑室额角,置入带脑室引流的颅内压传感器。术后送入ICU,持续引流脑脊液,除给予患者药物脑保护治疗外,根据患者情况给予营养支持、预防感染和深静脉血栓癫痫及通气治疗。
A组患者予右美托咪定注射液(湖南科伦制药有限公司,国药准字H20183150,规格为每支1 mL∶100 µg)1 µg/(kg·h)持续静脉泵入10 min,进入镇静状态后,予0.2~0.7 µg /(kg·h)泵入,每日 2 次,疗程为 7 d。B组患者予右美托咪定+艾司洛尔注射液(齐鲁制药有限公司,国药准字H19991059,规格为每支10 mL∶0.1 g)以1 mg/ kg 的剂量于30 s 内完成静脉注射,后续予0.15 mg/(kg·min)持续静脉泵入,每日2次,疗程为7 d。
1.3 观察指标
颅内压:利用F10 型一次性使用脑室外引流装置(天津市塑料研究有限公司,国械注准20183661698)测量治疗前后的颅内压、颅内压波动值、平均颅内压波幅(MWA)。平卧时成人颅内压持续超过15 mmHg,即为颅内高压,颅内压越高,预后越差[1]。
脑灌注压(CPP):利用PM-8000 Express 型生命体征病人监护仪(深圳市迈瑞生物医疗电子股份有限公司,国食药监械<准>字2009 第3210690 号)记录平均动脉压(MAP),计算CPP。CPP = MAP - ICP。CPP 决定脑血流量,为脑流入血流和流出血流的压力差。CPP <50 mmHg致脑缺血,控制目标为60~70 mmHg[8]。
脑电图:利用AE-2020A 型脑电图机(广州美伦安迪电子科技有限公司,粤械注准20182071132)记录治疗前和治疗第7 天的脑电图。根据脑电图诊断标准[9],分为正常、轻度异常、中度异常和重度异常脑电图。
生物标志物:利用神经元特异性烯醇化酶(NSE)定量测定试剂盒(上海透景生命科技股份有限公司,国械注准20153401807)以化学发光法测定NSE 的水平,利用脑活性肽100β 蛋白(S100β)检测试剂盒(南京美宁康诚生物科技有限公司,苏械注准20182401533)以荧光层析法测定S100β的水平,采用高效液相色谱法定量检测脑脊液谷氨酸(Glu)。NSE 和S100β 水平越高,表明脑损伤越严重[10]。Glu 水平越高,表明脑兴奋性毒性越强[11]。
预后:采用GCS 评估治疗前后的创伤严重程度,3~8 分为sTBI,评分越低,表明创伤程度越严重。出院后6 个月随访,采用格拉斯哥预后量表(GOS)评估患者的预后,分5 级,评分为5 分为恢复良好,1 分为死亡。评分越低,表明预后越差[12]。
不良反应:统计治疗期间低血压、心动过缓、谵妄等发生情况。
1.4 统计学处理
2 结果
2.1 颅内压
经重复测量方差分析,P< 0.01 不符合球形检验。给药分组与时间在颅内压和颅内压波动值上均存在交互作用(P< 0.01);给药分组与评估时间在颅内压、颅内压波动值、MWA 上主效应显著(P<0.01)。治疗后第1,3,7天,A组和B组颅内压和MWA均较治疗前显著下降(P< 0.05);B 组在用药后各个时间点的颅内压和MWA 均显著低于A 组(P< 0.05);在颅内压检测各个时间段内,B组颅内压波动值均显著低于A组(P<0.05)。详见表2。
表2 两组患者治疗前后颅内压指数比较(,mmHg)Tab.2 Comparison of intracranial pressure indexes between the two groups before and after treatment(,mmHg)
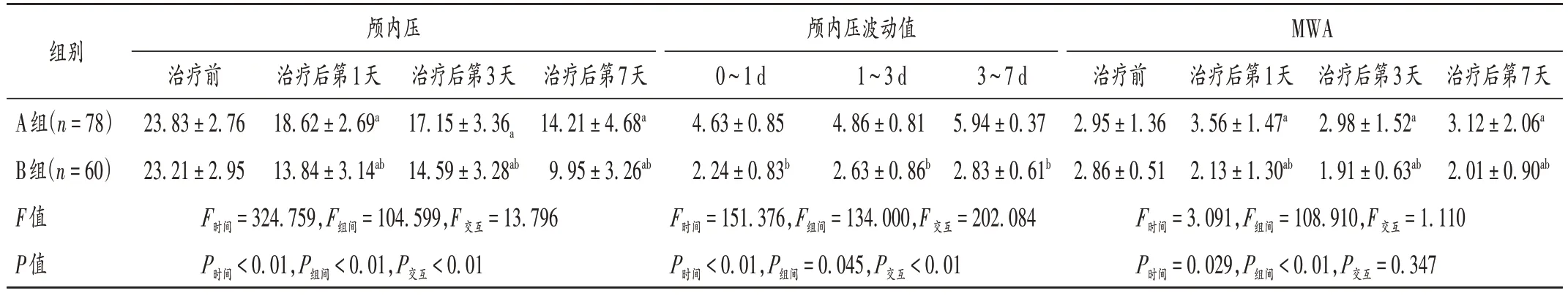
表2 两组患者治疗前后颅内压指数比较(,mmHg)Tab.2 Comparison of intracranial pressure indexes between the two groups before and after treatment(,mmHg)
注:与本组治疗前比较,aP < 0.05;与A组同时点比较,bP < 0.05。表3至表6同。Note:Compared with those before treatment,aP < 0.05;Compared with those in the group A at the same time point,bP < 0.05(for Tab.2-6).
组别颅内压波动值0~1 d 4.63±0.85 2.24±0.83b F时间 =151.376,F组间 =134.000,F交互 =202.084 P时间 <0.01,P组间 =0.045,P交互 <0.01颅内压治疗前23.83±2.76 23.21±2.95 F时间 =324.759,F组间 =104.599,F交互 =13.796 P时间 <0.01,P组间 <0.01,P交互 <0.01治疗后第1天18.62±2.69a 13.84±3.14ab治疗后第3天17.15±3.36a 14.59±3.28ab治疗后第7天14.21±4.68a 9.95±3.26ab MWA治疗前2.95±1.36 2.86±0.51 F时间 =3.091,F组间 =108.910,F交互 =1.110 P时间 =0.029,P组间 <0.01,P交互 =0.347 1~3 d 4.86±0.81 2.63±0.86b 3~7 d 5.94±0.37 2.83±0.61b A组(n=78)B组(n=60)F值P值治疗后第1天3.56±1.47a 2.13±1.30ab治疗后第3天2.98±1.52a 1.91±0.63ab治疗后第7天3.12±2.06a 2.01±0.90ab
2.2 脑灌注压
经重复测量方差分析,P=0.175符合球形检验。给药方案与时间在CPP 上存在交互作用(P<0.01);给药方案与评估时间在CPP 上主效应显著(P<0.01)。治疗后第1,3,7天,A组和B组均较治疗前显著升高(P<0.05);且B 组在用药后各时间点的CPP 均显著高于A 组(P<0.05)。B 组在用药后各时间点的CPP 均值均在目标范围内。详见表3。
表3 两组患者治疗前后CPP比较(,mmHg)Tab.3 Comparison of CPP between the two groups before and after treatment(,mmHg)

表3 两组患者治疗前后CPP比较(,mmHg)Tab.3 Comparison of CPP between the two groups before and after treatment(,mmHg)
组别A组(n=78)B组(n=60)F值P值治疗前47.16±10.62 49.51±11.21 F时间 =44.478,F组间 =22.222,F交互 =6.415 P时间 <0.01,P组间 <0.01,P交互 <0.01治疗后第1天51.75±13.15a 61.50±7.86ab治疗后第3天62.47±13.99a 65.77±6.59ab治疗后第7天57.18±18.9a 63.12±6.81ab
2.3 脑电图
治疗前,两组患者脑电图多数为中、重度异常,差异无统计学意义(P<0.05)。A 组、B 组用药前后均有显著差异(Z=2.473,3.477,P=0.014,<0.001);治疗后第7天,两组脑电图以轻、中度异常为主,但组间无显著差异(P>0.05)。详见表4。

表4 两组患者脑电图比较[例(%)]Tab.4 Comparison of EEG between the two groups[case(%)]
2.4 生物标志物
经重复测量方差分析,P< 0.01 不符合球形检验。给药方案与时间对脑脊液中的NSE,S100β,Glu 存在交互作用(P<0.05);给药分组与评估时间在脑脊液中的NSE,S100β,Glu 显主效应(P< 0.01)。治疗后第1,3,7 天,A 组和 B 组脑脊液中的NSE,S100β,Glu 均较治疗前显著下降(P<0.05);B 组NSE,S100β,Glu 均显著低于A组(P<0.05)。详见表5。
表5 两组患者治疗前后脑脊液生物标志物水平比较()Tab.5 Comparison of biomarker levels in the cerebrospinal fluid between the two groups before and after treatment()

表5 两组患者治疗前后脑脊液生物标志物水平比较()Tab.5 Comparison of biomarker levels in the cerebrospinal fluid between the two groups before and after treatment()
组别Glu(µmol /L)治疗前12.45±6.55 12.32±7.74 F时间 =158.862,F组间 =30.967,F交互 =2.763 P时间 <0.01,P组间 <0.01,P交互 =0.045 NSE(µg/L)治疗前51.27±14.66 51.25±13.99 F时间 =355.059,F组间 =4.338,F交互 =6.376 P时间 <0.01,P组间 =0.039,P交互 <0.01治疗后第1天47.68±14.13a 42.25±8.48ab治疗后第3天34.16±9.72a 28.93±8.38ab治疗后第7天19.57±7.83a 16.21±6.92ab S100β(µg/L)治疗前2.87±0.17 2.79±0.18 F时间 =4 095.849,F组间 =345.947,F交互 =51.452 P时间 <0.01,P组间 = <0.01,P交互 <0.01治疗后第1天2.25±0.09a 2.06±0.13ab治疗后第3天1.96±0.16a 1.47±0.15ab治疗后第7天1.22±0.09a 1.11±0.09ab A组(n=78)B组(n=60)F值P值治疗后第1天10.32±4.56a 8.26±5.55ab治疗后第3天6.32±3.18a 3.12±2.15ab治疗后第7天4.87±2.05a 1.99±1.29ab
2.5 预后评分
治疗前,两组患者GCS评分差异不显著(P>0.05);治疗后第14 天,两组患者GCS 评分均显著升高(P< 0.05),且B 组显著高于A 组(P<0.05),B 组GOS评分显著高于A组(P<0.05)。出院后6个月,两组患者的GCS和GOS评分均无显著差异(P>0.05)。详见表6。
表6 两组患者GCS和GOS评分比较(,分)Tab.6 Comparison of GCS and GOS scores between the two groups(,point)

表6 两组患者GCS和GOS评分比较(,分)Tab.6 Comparison of GCS and GOS scores between the two groups(,point)
GCS组别出院后6个月3.96±1.39 4.22±1.33 1.110 0.269治疗前5.62±1.56 5.58±1.32 0.159 0.873 A组(n=78)B组(n=60)t值P值治疗后第14天6.12±1.42a 7.77±1.23a 7.166<0.01出院后6个月9.74±2.34a 10.56±2.58a 1.952 0.053 GOS治疗后第14天3.38±1.37 4.17±1.34 3.390<0.01
2.6 不良反应
两组不良反应发生率比较,差异不显著(P>0.05)。详见表7。

表7 两组患者不良反应发生情况比较[例(%)]Tab.7 Comparison of the incidence of adverse reactions between the two groups[case(%)]
3 讨论
sTBI 除物理打击造成的脑组织坏死、颅内血肿外,还会继发引起脑缺血缺氧、兴奋性毒性作用、颅内高压等病理生理反应,可能导致患者神经功能障碍和预后不良。研究表明,右美托咪定的神经保护功能与多种机制有关,包括神经递质调节、炎性反应、氧化应激、凋亡途径和其他细胞信号通路[13]。本研究中分析sTBI 患者术后联合应用艾司洛尔和右美托咪定的疗效。
颅内高压是脑损伤患者死亡和残疾的常见原因,维持正常的颅内压和CPP 以防止继发性脑损伤是治疗的重点。本研究中单用右美托咪定的患者颅内压、颅内压波动值、MWA 均较治疗前显著降低;CPP比治疗前显著升高,而联合用药的效果更好;两组患者脑电异常较治疗前显著减轻,但治疗后无显著差异。颅内压波动值和MWA 可反映患者颅内代偿储备容积及脑组织顺应性[14]。CPP 反映脑血流量,可评估脑血管调节功能[15]。推测联合用药的作用机制可能是,右美托咪定通过激活神经突触后膜α2受体来抑制疼痛信号的上调,发挥镇静、镇痛作用,抑制术后躁动增加的胸前内压力,降低癫痫异常发电的高氧代谢率。艾司洛尔通过阻断β1受体与右美托咪定协同降低脑内儿茶酚胺水平,抑制血管收缩和颅内压升高;同时扩张外周血管,改善心脏顺应性和胸外受压产生的每搏量,控制MAP 和CPP,保持血流动力学稳定,降低颅内压。右美托咪定为临床上明确能降低颅内压的镇静药[13]。虽然艾司洛尔的脑保护机制仍不明确,但其能降低sTBI 患者的死亡率和减轻不良预后,且建议无禁忌证的TBI 患者使用β 阻滞剂[16],与本研究结论相符。
本研究中,治疗后第1,3,7天,A组和B组脑脊液中NSE,S100β,Glu 水平均较治疗前显著下降(P<0.05);且 B 组上述时间点的 NSE,S100β,Glu 均显著低于A 组(P<0.05)。NSE是神经元的标志酶,S100β是神经胶质细胞的标志蛋白,两者异常升高反映神经细胞损伤严重和预后不良[17]。Glu 可作用脑细胞表面谷氨酸受体,激发细胞损伤或死亡,正常情况下,主要通过神经元和神经胶质细胞高亲和摄取系统主动重摄取,在谷氨酸转运蛋白作用下迅速灭活。脑脊液Glu 升高,提示脑内Glu 大量释放或重摄取作用受阻,导致兴奋毒性[18]。右美托咪定通过与神经元的α2受体结合,调节受体对谷氨酸的敏感性和减少释放,抑制电压依赖性钙通道及活化蛋白酶,减少Glu 重摄取。通过增强谷氨酸转运蛋白表达,谷氨酸转运蛋白通过神经元和神经胶质细胞的再摄取从突触间隙和额外的突触位点中去除Glu[19]。β1受体阻滞剂促进神经元Na+,K+- ATP 酶重吸收细胞外 K+[20],膜超极化,抑制突触前 Glu 的释放。本研究结果显示,两药可能通过减少神经细胞损坏,减轻Glu重摄取受阻,同时通过细胞离子通道减少Glu 的释放、活化的蛋白激酶而减少Glu。随Glu 的减少降低兴奋毒性,保护脑神经。
本研究中,两组患者不良反应发生率无显著差异。治疗后第14 天,两组患者的GCS 和GOS 评分均显著升高(P< 0.05),且B 组显著高于 A 组,(P< 0.05)。出院后6 个月,两组患者的GCS 和GOS 评分均无显著差异(P> 0.05)。表明联合用药能改善短期预后,比单用药效果更佳,且不增加不良反应,但长期预后改善效果相当。原因可能与上述药物能调整颅内压、CPP、脑电异常、脑生物标志物释放机制有关。
综上所述,艾司洛尔联合右美托咪定可有效降低sTBI 术后患者的颅内压及其波动,改善脑组织顺应性和脑血管调节功能,降低脑脊液NSE,S100β,Glu 水平,保护脑神经,改善短期预后,且安全性较好。
