低氧调控p53RFP基因启动子活性的初步研究
2023-02-15裴静娴王月刚
裴静娴 莫 沛 王月刚
1 广州医科大学附属第二医院心血管内科(广州 510260) 2 南方医科大学南方医院心血管内科(广州 510515)
低氧是心血管疾病发病过程中一个常见的病理生理因素,特别是在心肌梗死、心力衰竭发病过程中发挥重要的作用[1]。HIF-1α 作为调节细胞对低氧适应性反应的重要转录因子,通过与低氧反应元件(hypoxia responsive element,HRE)核心DNA序列5′-RCGTG- 3′结合激活基因转录[2],从而调节多种下游靶基因的表达,参与了红细胞生成、铁代谢、葡萄糖代谢、血管生成、细胞增殖与凋亡等多种生理病理过程[3- 4]。
p53RFP是调控细胞增殖和凋亡的一个重要基因[5],最初被鉴定为受p53调控的基因,其产物具有E3泛素连接酶活性,通过泛素化降解细胞周期调控因子p21WAF1/CIP1 参与细胞增殖和凋亡。生物信息学分析显示p53RFP启动子区域存在多个低氧反应元件,而p53RFP基因表达是否受低氧的调控尚未见相关报道。因此,本研究拟观察低氧对p53RFP基因表达及p53RFP启动子活性的影响,并探索HIF-1α潜在的结合位点HRE在低氧调控p53RFP基因启动子活性中的作用。
1 材料与方法
1.1 试剂与细胞
HEK293细胞、E.coli DH5α 由本课题组保存,pGL3-p53RFP 载体由本课题组前期构建;pRL-SV40、双荧光素酶检测试剂盒购自Promega公司;定向突变试剂盒购于Stratagene公司;Lipofectamine 2000、TRIzol、质粒中提试剂盒均购于Invitrogen公司;质粒小提取试剂盒购自Biomiga公司;逆转录试剂盒购自Takara公司;荧光定量PCR试剂盒购自 Roche公司;ECL发光试剂盒、 PVDF膜购自Millipore公司;兔抗HIF-1α多克隆抗体购自Abcom公司;小鼠抗p53RFP单克隆抗体购自Abnova公司;小鼠抗β-actin 单克隆抗体、羊抗鼠辣根过氧化物酶标记二抗、羊抗兔辣根过氧化物酶标记二抗均购自Santa Cruz公司。
1.2 方法
1.2.1 低氧对HEK293细胞p53RFP mRNA及蛋白表达的影响 将HEK293细胞消化为单细胞悬液、计数,以4×105细胞总数接种于60 mm细胞培养皿,置于常规细胞培养箱(37 ℃,5% CO2,21% O2)培养24小时,细胞换新鲜培养基。将细胞置入低氧培养箱(37 ℃,1% O2,5% CO2,94% N2)分别培养0、3、6、12小时,TRIzol法提取细胞总RNA,细胞裂解液提取细胞总蛋白。
1.2.1.1 实时荧光定量PCR检测mRNA表达 以RNA为模板逆转录合成cDNA,应用荧光定量PCR试剂盒,以β-actin基因为内对照,行 Real-time PCR,反应条件:95 ℃ 10 min;95℃ 10 s,60 ℃ 30 s,共40个循环。引物序列如下:p53RFP 上游5′CATCTGGACCCCTACCGAACA 3′,下游5′ACACGAGCAGAATTTCAGGTG3′;β-actin 上游5′CAAATGCTTCTAGGCGGA CTATG 3′,下游5′TGCGCAAGTTAG GTTTTGTCA 3′。
1.2.1.2 Western blot 检测蛋白表达 将蛋白加入SDS加样缓冲液,100 ℃加热5 min,取20 μg总蛋白上样,行SDS-PAGE电泳,电转移至PVDF膜,依次5%脱脂牛奶封闭2~3 h, 一抗(HIF-1α稀释比例为1:700;p53RFP稀释比例为1:500;β-actin稀释比例为1:1000)孵育过夜,TBST 洗 膜10 min×3次,二抗(稀释比例为1:10000)室温孵育1 h,TBST 洗膜10 min×3次,ECL发光。
1.2.2 构建突变型p53RFP启动子荧光素酶报告基因载体 p53RFP启动子区域-1118/-1115 、-636/-633存在2个低氧反应元件特征序列,我们将可能的HRE核心序列5′-RCGTG- 3′分别突变成RTACA,构建p53RFP启动子HRE单突变型(pGL3-p53RFPM)或双突变型荧光素酶报告基因载体(pGL3-p53RFPM2)。以野生型p53RFP启动子1230bp截短片段的荧光素酶报告基因载体(pGL3-p53RFP)为模板,设计针对 -1118/-1115 区域HRE 突变引物,引物序列如下:上游引物5′GGTGCCTGTTGGTACACACAGATCCTTTCC 3′;下游引物:5′GGAAAGGATCTGTGTGTACCAACAGG-CACC3′,按照定点突变试剂盒操作说明,PCR扩增突变DNA。PCR结束后,向扩增产物中加入2 μL Dpn I,37 ℃水浴5分钟,切掉未突变的超螺旋双链DNA。将Dpn I处理的DNA转化超级感受态细胞,转化产物涂Amp+LB培养板,37 ℃培养14~16 h。挑取单克隆,接种至LB液体培养基,小提质粒,送华大基因公司测序。
以-1118/-1115 区域HRE 突变成功的p53RFP 启动子荧光素酶报告基因载体(pGL3-p53RFPM)为模板,设计针对- 636/- 633 HRE位点的突变引物,引物序列如下:上游引物5′CAGTTGTCTGCCATACAGGAAGGCAGGTC3′;下游引物5′GACCTG CCTTCCTGTATGGCAGACAACTG3′,构建HRE双突变型启动子报告基因(pGL3-p53RFPM2)。
1.2.3 双荧光素酶报告基因检测系统检测低氧对p53RFP基因启动子活性的影响 按照Lipofectamine 2000操作说明,将250 ng野生型及突变型p53RFP启动子荧光素酶报告载体分别转染48孔细胞培养板的HEK293细胞,共转染25 ng pRL-SV40作为内参,以pGL3-Basic转染组作为阴性对照。分别置于常规细胞培养箱及低氧培养箱培养。转染24小时后收集细胞,应用双荧光素酶检测试剂盒,经化学法发光仪检测萤火虫及海蜃光子数,以萤火虫光子数与海蜃光子数的比值作为相对荧光素酶活性。
1.3 统计学分析
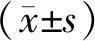
2 结 果
2.1 低氧对HEK293细胞p53RFP及HIF-1α基因表达的影响
实时荧光定量PCR检测低氧对HEK293细胞p53RFP mRNA表达的影响,结果显示:低氧处理不同时间点p53RFP mRNA 表达水平均显著增加(F=96.493,P<0.001),与低氧0 h组相比,低氧培养3 h、6 h、12 h的p53RFP mRNA表达水平均显著升高,差异有统计学意义(P分别为0.01,<0.001,<0.001),见图1A。
Western blot 检测低氧对HEK293细胞p53RFP及HIF-1α蛋白表达的影响,结果显示:与常氧组相比,低氧组不同时间点p53RFP及HIF-1α蛋白表达水平均明显上调,且呈时间依赖性递增趋势,见图1B。
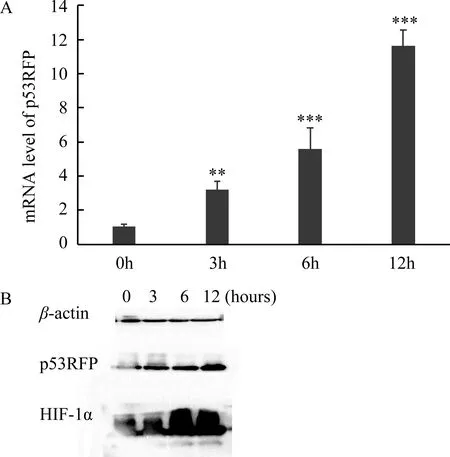
图1 低氧对p53RFP 基因表达表达的影响条带旁边标注蛋白大小注:A,荧光定量PCR检测低氧处理不同时间p53RFP mRNA表达水平的变化,与0小时相比, **P<0.01, ***P<0.001;B,Western blot 检测低氧处理不同时间p53RFP及HIF-1α蛋白表达水平的变化
2.2 突变型p53RFP基因启动子荧光素酶报告基因载体构建
基因测序结果经NCBI 基因序列对比,结果显示pGL3-p53RFPM 单突变载体启动子区域-1118/-1115 HRE核心序列5′-RCGTG- 3′突变成RTACA,pGL3-p53RFPM双突变载体启动子区域-1118/-1115 、-636/-633 HRE核心序列5′-RCGTG- 3′均突变成RTACA,证明HRE单突变型(pGL3-p53RFPM)及双突变型(pGL3-p53RFPM2)荧光素酶报告基因载体构建成功。载体示意图见图2,测序结果见图3。
图2 p53RFP基因启动子荧光素酶报告载体示意图
2.3 低氧对p53RFP基因启动子转录活性的影响
双荧光素酶检测结果显示:与常氧组野生型p53RFP启动子活性相比,低氧组野生型p53RFP基因启动子活性显著增加(t=-19.504,P<0.001),尽管低氧仍能增加pGL3-p53RFPM及pGL3-p53RFPM2 启动子活性,但低氧条件下,HRE单突变或双突变均较野生型p53RFP启动子活性显著下降(F=160.891,P<0.001)。

图3 突变型p53RFP基因启动子荧光素酶报告基因载体测序结果 注:A:pGL3-p53RFPM 测序结果,-1118/-1115 HRE(CGTG)突变为TACA(下划线处); B、C: pGL3-p53RFPM2测序结果,-1118/-1115 及- 636/- 633HRE(CGTG)均突变为TACA(下划线处)
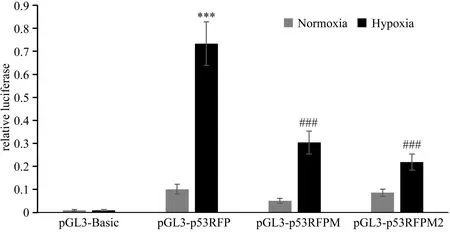
图4 低氧对野生型及突变型p53RFP启动子活性的影响注:与常氧组pGL3-p53RFP启动子活性比较, ***P<0.001;与低氧组pGL3-p53RFP启动子活性比较, ###P <0.001
3 讨 论
低氧是机体最常见的病理生理过程,大多数情况下,短暂的缺氧和HIF-1α低氧信号通路的激活是有益的。然而,在某些慢性损伤、慢性缺氧及病理修复的情况下,低氧途径的激活可能导致组织纤维化及器官功能损伤[6]。大量研究表明低氧通过介导HIF-1α的稳定表达在急性心肌缺血中减轻梗死面积、保护心功能。但也有证据表明在慢性缺血中HIF-1α的长期激活可促进心肌重构和心功能恶化。动物实验显示HIF-1α的持续激活可能参与了缺血性心肌病的发病过程,同样在慢性缺血性心肌病患者的尸检组织中也检测到了心肌HIF-1α蛋白的高表达[10]。同样,低氧也是心脏肥厚的病理特征,有研究表明HIF-1α参与了压力超负荷诱导的心肌肥厚[11]。此外,Lei等构建了心肌细胞特异性 VHL基因缺失小鼠,结果显示VHL基因缺失小鼠严重心衰的发生与HIF-1α的持续表达直接相关[12]。因此, HIF-1α在急性心肌缺血中既发挥了心脏保护作用,也可能参与了心梗后续心衰的发生发展过程。然而,HIF-1α通过激活哪些信号通路参与了缺血性心肌病的发病过程目前尚不明确。
p53RFP是受p53家族成员调控的一个基因,具有E3泛素连接酶活性。研究表明p53RFP 通过泛素化降解Bax、p21、p63,在调控细胞凋亡、细胞周期中发挥重要作用。我们的研究显示低氧可促进p53RFP mRNA及蛋白表达增加,其mRNA表达上调更加显著,提示低氧对p53RFP基因表达的调控可能主要发生在转录水平。同时,低氧条件下,HIF-1α与p53RFP蛋白表达趋势均呈时间依赖性。生物信息学分析显示p53RFP基因启动子区域存在多个低氧反应元件。因此,我们推测低氧可能通过HIF-1α介导了p53RFP基因转录激活。
为此,本研究在野生型p53RFP双荧光素酶报告载体的基础上[15],构建了低氧反应元件突变型的p53RFP双荧光素酶报告载体。我们通过双荧光素酶报告基因检测了低氧对野生型及突变型p53RFP启动子活性的影响,结果显示低氧可显著增加野生型p53RFP基因启动子活性,HRE单突变或双突变后,p53RFP启动子活性显著下降。以上研究结果表明低氧可能通过启动子区域的低氧反应元件调控p53RFP基因表达,p53RFP启动子区域位点的-1118/-1115、- 636/- 633 位点的低氧反应元件可能是HIF-1α潜在的结合位点,提示p53RFP可能是HIF-1α直接调控的一个靶基因。因此,我们推测p53RFP作为调控细胞增殖和凋亡的一个重要基因,可能参与了低氧诱导的细胞损伤过程。
综上所述,本研究首次表明低氧可能通过HIF-1α介导了对p53RFP基因的转录调控。野生型及突变型p53RFP双荧光素酶报告基因载体的成功构建,为下一步深入研究低氧调控p53RFP的分子机制及生物学效应奠定了基础。
