纳米材料在肾脏中的应用与清除机制
2023-02-15祁禹鸣徐铭泽杜步婕
祁禹鸣 徐铭泽 杜步婕
华南理工大学附属第二医院,广州市第一人民医院(广州 510180)
近年来,纳米技术蓬勃发展,纳米材料在生物医学中的应用越来越受到广泛关注,尤其在新冠大流行下,mRNA纳米疫苗的问世及其广泛的临床应用[1],更加奠定了纳米技术在未来精准纳米医学发展中的重要地位。纳米材料因其独特的理化性质及生物学效应[2],在疾病诊断、细胞追踪、分子成像、药物/基因递送等领域[3- 4]显现出巨大的应用潜力。为加快纳米材料的最终临床转化,清楚了解纳米材料如何从体内代谢和清除是纳米材料生物医学应用,特别是纳米材料的安全性效应中最重要的基础科学问题之一。
肾脏,作为人体重要的清除器官,可将纳米材料从血液清除到尿液来降低其在体内的滞留[5]。近年来,肾可清除纳米材料,如量子点[6]、二氧化硅纳米颗粒[7]、金纳米颗粒[8]在肾脏内的互作机制及其界面作用被广泛关注和研究。研究发现,纳米材料的理化性质,如尺寸、形状、电荷、密度、亲/疏水性和刚性[9]等决定了纳米材料的肾脏清除效率及其作用机制。例如,因肾小球的滤过阈值为~6 nm[6],低于6 nm的纳米材料才能有效地被肾脏清除,而大于6 nm的纳米材料易被肝脏内丰富存在的网状内皮系统所捕获。
随着纳米材料在肾脏内作用机制的深入研究及其可肾清除纳米材料在国际上的发展,纳米材料用于肾病的早期精准诊断与治疗正逐步成为研究热点。例如,美国德克萨斯大学达拉斯分校郑杰(Jie Zheng)教授在国际上最早提出肾脏可清除型近红外发光金纳米探针,利用荧光和光声成像等多模态成像手段,实现了肾损伤的早期检测[10-11]。近年来,新加坡南洋理工大学浦侃裔(Kanyi Pu)教授在国际上报道了肾脏微环境响应型且高效肾清除探针,利用光学成像手段实现了临床前药物诱导的急性肾衰竭的早期检测[12-13]。
基于纳米材料在肾脏中的清除机制与应用等研究热点,本文系统介绍了肾脏结构、纳米材料在肾脏中的传输机制、理化性质对其肾脏清除效率的影响以及纳米材料在肾脏疾病诊疗中的应用。此综述有望为精准纳米医学的发展以及纳米材料未来的临床转化起到促进作用。
1 肾脏的结构与功能
肾脏是构成泌尿系统的核心器官,其承担着过滤血液、生成尿液、维持电解质平衡以及内分泌等重要的生理功能[14-15];由于肾脏的特殊生理结构与功能,不同类型的纳米材料在肾脏中的代谢机制也有所不同。肾脏的解剖结构及微观结构见图1。
1.1 肾脏的解剖结构
在解剖学角度,肾脏的外形呈一侧内凹的扁圆蚕豆形,长度约10~12 cm,宽约5~7 cm,厚约2~3 cm,位于脊柱两侧腹膜后间隙,并且由于肝脏的存在,右肾的位置往往略低于左肾[16]。肾脏可分为三个结构区域,分别是肾皮质、肾髓质以及肾盂;腹主动脉向左右各分一支形成肾动脉,血液经肾动脉进入肾脏,经入球小动脉进入肾小球滤过,滤过后的血液经由出球小动脉汇总至肾静脉排出肾脏(图1A)[17-18]。血液经过肾脏的过滤后,代谢废物以尿液的形式从肾盂进入膀胱,从而排出体外。
1.2 肾脏的微观结构与功能
肾单位是肾脏结构与功能的基本单位,由肾小体及肾小管组成,每个肾脏含有约100万个肾单位。肾单位可分为近皮质肾单位及近髓质肾单位,分布于肾皮质及肾髓质中[19]。肾单位由入球小动脉、肾小球、鲍氏囊、近曲小管、远曲小管、皮质集合管、亨利氏环、肾小管周围毛细血管及出球小动脉等几部分组成(图1B),肾单位的主要功能是利用肾小球的滤过作用,将血液中的代谢废物滤过进入肾小管,肾小管重新吸收有用物质,并将剩余的部分以尿液的形式分泌出去[20- 22]。因此,肾脏损伤及疾病主要影响的就是肾单位的功能。
肾脏过滤血液的功能主要是依靠肾小球滤过膜(glomerular filtration membrane , GFM)实现的,肾小球滤过膜由内皮细胞、肾小球基底膜和足细胞组成(图1C)[23- 24]。肾小球滤膜可渗透水、小分子物质和低分子量的蛋白质,但在很大程度上截留了超过60~70 kDa的血浆蛋白的滤过,因此,当肾小球滤膜功能出现异常时,就会体现为肾小球滤过率的变化[25- 26]。
当纳米材料进入血液循环后,不可避免的会流经肾脏,因此纳米材料在肾脏中的传输机制极大程度上影响了纳米材料在体内的代谢过程,由于肾单位的特殊结构,纳米材料可以在肾小球或肾小管中呈现出不同的传输过程,下文将详细介绍纳米材料在肾脏中的三种传输机制。

图1 肾脏的解剖结构及肾小体微观结构注:A,肾脏的解剖结构:血液经腹主动脉分支后形成两支肾动脉,经肾皮质及肾髓质过滤后由肾静脉流出,代谢废物以尿液的形式经肾盂流入输尿管并进入膀胱储存;B,肾小体的结构:血液经入球小动脉进入肾小球,水、无机盐、小分子蛋白质及代谢废物经肾小球滤过后进入鲍氏囊,一部分小分子物质在肾小管重吸收进入肾小管周围毛细血管,原尿经肾小管重吸收浓缩后最终流向皮质集合管;C,肾小球滤过膜结构:肾小球滤过膜为三层结构,分别为内皮细胞、肾小球基底膜以及足细胞,内皮细胞层具有70~90 nm的的孔隙。肾小球基底膜的孔隙大小为2~8 nm,足细胞位于肾小球基底膜另一侧,面向鲍曼空间,细胞间隙为4~11 nm。
2 纳米材料在肾脏中的清除机制
众所周知,尿液作为肾脏最主要的废物排泄途径,其经由三种机制:肾小球滤过、肾小管的重吸收以及肾小管的分泌所生成的[5]。血液由肾小体的入球小动脉输送到肾小球,肾小球腔内的血压升高导致血液中的液体、溶质和废物过滤进鲍曼空间,然后进入近端小管,近端小管管腔表面被密集的微绒毛覆盖,最后进入远端小管,远端小管不含微绒毛。滤过发生在肾小球,重吸收与分泌发生在近端小管和管周毛细血管之间。在给药并进入血液循环后,纳米材料可以与尿液一起通过肾脏排出体外。对生物体来说,肾尿代谢方式是有利的,它可以最大程度避免与其他器官的相互作用将纳米材料以尿液的形式代谢出体外,可以有效降低纳米药物的毒副作用[27]。纳米材料被肾脏清除与传输机会同样遵循三种机制:肾小球滤过、肾小管重吸收和肾小管分泌(图2)。

图2 纳米材料在肾脏中的三种传输机制示意图注:A,纳米材料经肾小球滤过后进入鲍氏囊,特定纳米材料可以在肾小管近端小管发生重吸收进入肾小管周围毛细血管,未被肾小球滤过的特定纳米材料可以通过肾小管周围毛细血管进入到近端肾小管,从而分泌到尿液中;B,纳米材料的肾小球滤过是被动运输过程,与纳米材料的尺寸、电荷等物理化学性质相关;纳米材料的肾小管重吸收;C,和肾小管分泌;D,是主动运输的过程,发生在近端小管和管周毛细血管之间。
2.1 肾小球滤过
在三种肾清除机制中,肾小球滤过扮演着至关重要的角色。肾小球滤过屏障(glomerular filtration barrier,GFB)位于肾小球毛细血管腔和鲍曼空间之间,由内皮细胞糖萼、内皮细胞、肾小球基底膜(glomerular basement membrane, GBM)和足细胞组成。肾小球血管中的间质由系膜细胞和系膜基质组成,它们也参与肾小球滤过。内皮糖萼位于内皮细胞表面,由糖胺聚糖(例如,硫酸肝素、透明质酸和硫酸软骨素)和相关的蛋白聚糖组成,排列在血管腔内,有着保护血管和防止蛋白质泄露的作用。内皮层有70~90 nm的开窗。GBM具有2~8 nm大小的孔隙,主要由IV型胶原、层粘连蛋白和蛋白多糖组成。足细胞单层排列,间隙为4~11 nm,位于GBM的另一侧,面对鲍曼空间,足细胞被厚约200 nm的糖萼覆盖。这四层结构决定了肾脏的6 nm的肾脏滤过阈值(kidney filtration threshold, KFT)[6]和电荷选择性滤过的性质。因此纳米材料的大小、电荷、形状、密度都是影响它们与GFM相互作用的重要因素,决定性地影响了它们的肾清除效率。
2.1.1 尺寸效应 因为肾脏滤过阈值,纳米材料在肾脏中的清除效率呈现尺寸效应。依据纳米材料是否可以通过肾脏滤过阈值,可以分为:可肾清除纳米材料与不可肾清除纳米材料。从纳米材料大小的角度来看,由于GFM的存在,水合粒径(hydrodynamic diameter, HD)大于6 nm的纳米材料不易跨过肾小球滤过膜难以被肾清除,例如,HD为12.1 nm的磺化三苯基膦配体的金纳米颗粒(TPPMS-GNP)则几乎不能被肾尿代谢(在雌性Wistar-Kyoto大鼠体内ID仅为0.07%)[28]。当纳米材料的尺寸低于6 nm时,它们可以有效地跨过肾小球滤过膜而进入尿液中。例如,2.4 nm的谷胱甘肽涂层的金纳米颗粒(GS-AuNPs)在雄性BALB/c小鼠体内24小时的可肾清除率为52.5 % 注射量 (injection dose,ID)[10]。因此,尺寸小于6 nm且可以通过尿液进行清除的纳米材料被定义为可肾清除纳米材料 (renal clearable nanomaterials, RCNMs)。RCNMs的尺寸在2~6 nm之间时,它们的肾脏清除效率呈现明显的尺寸效应:随着材料尺寸的减小,其肾清除效率逐渐增加。例如,可肾清除的二氧化硅纳米颗粒的尺寸从6 nm下降至3.3 nm时,其24小时内肾脏清除效率从55 %ID增加到67.5 %ID[7]。当纳米材料的尺寸降低到 1~2 nm之间时,此范围的纳米材料的肾脏清除效率的尺寸效应并不明显。然而,当进一步将纳米材料的尺寸降低到1 nm以下时,Du等人[8]却发现与传统认知不同的尺寸效应:越小的金纳米团簇,肾脏清除效率越低。这一现象背后的机制为:1 nm以下,较小的金团米团簇与肾小球内皮细胞表面的内皮萼作用越强。此发现说明肾小球不再是一个“尺寸截留”狭缝,而是一个原子级精确的“带通”屏障(图3A)。
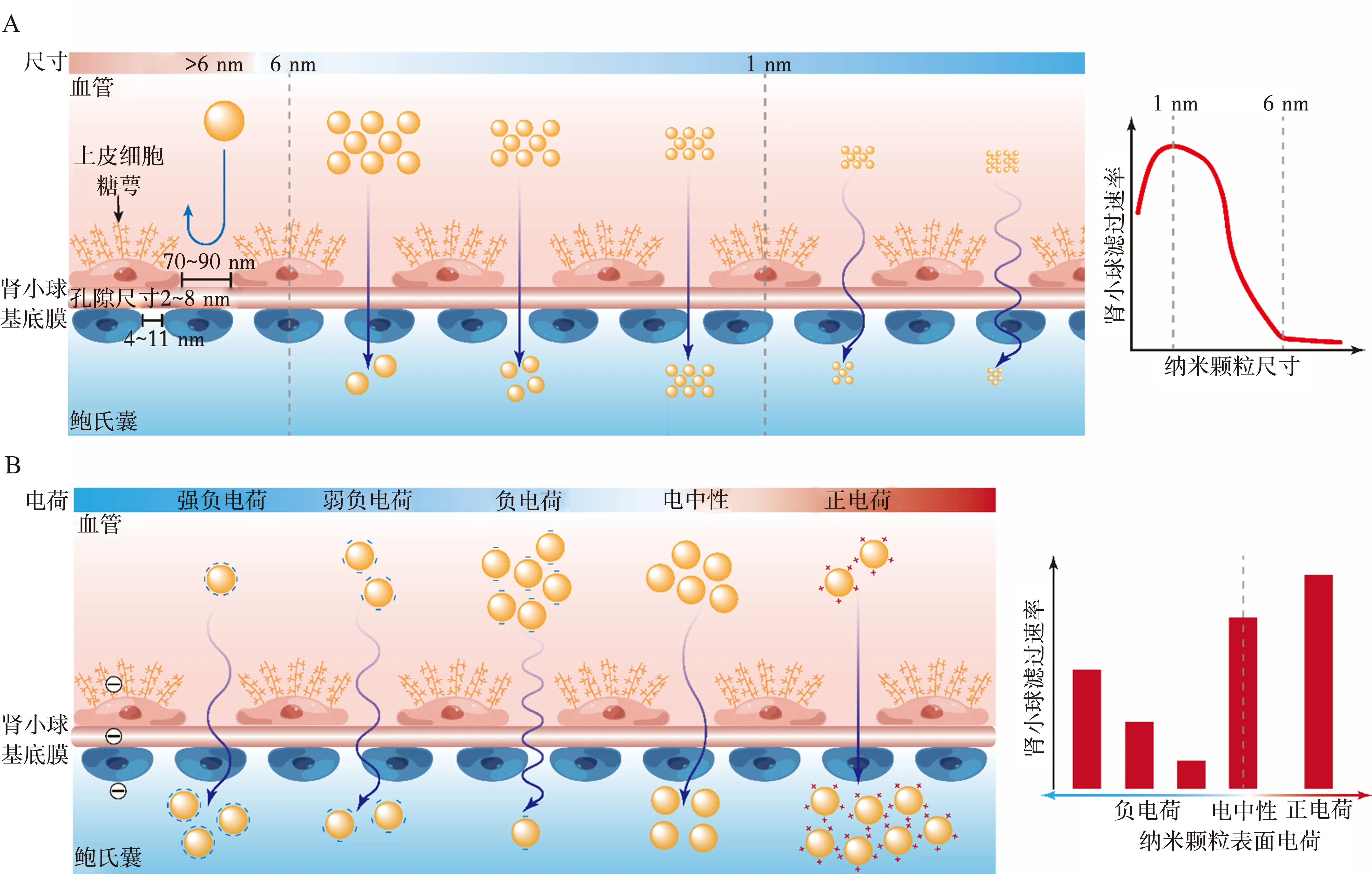
图3 纳米材料在肾小球滤过中的尺寸效应与电荷效应注:A,纳米材料在肾小球滤过中的“带通”尺寸效应。纳米材料>6 nm时很难被肾小球滤过,1~6 nm时可以轻松被肾小球滤过,<1 nm时与上皮细胞糖萼作用增强,肾小球滤过能力明显变差;B,纳米材料在肾小球滤过的电荷效应。带正电荷的纳米材料更容易通过GBM,电中性次之,对于呈负点的纳米颗粒,随着电负性的增加,纳米材料更容易被肾小球滤过。
2.1.2 电荷效应 除纳米材料尺寸外,其表面电荷也是影响其是否能被肾小球滤过的重要因素。由于内皮糖萼中存在硫酸乙酰肝素蛋白聚糖,以及肾小球毛细血管壁和足细胞糖萼带负电荷的特点,使GFM也表现出对纳米材料的电荷选择性。当纳米材料的尺寸大小相近时,带正电的纳米材料比带负电的纳米材料更容易从肾脏中清除(图3B)。例如,Liang等人[29]设计并合成了具有不同表面电荷的CdTe/CdS量子点(quantum dots, QDs),其尺寸均在2~6 nm之间,结果显示肾脏清除效率的规律为带正电的QDs>电中性的QDs>带负电的QDs。值得注意的是,当HD略大于肾过滤阈值(KFT,6 nm)时,带正电的纳米材料有利于电荷的相互作用也可以通过肾过滤屏障,而具有相同直径的带负电荷就很难通过[30]。当纳米材料表面均带负电荷时,表面Zeta电位绝对值越大,肾脏清除效率越高。例如,Zheng课题组合成了三种尺寸相同但电荷不同的带负电荷的金纳米粒子:谷胱甘肽涂层的金纳米粒子(GS-AuNPs,HD=3.0 nm, ζ=-50 mV, pH=7.4)[31],甘氨酸-半胱氨酸涂层的金纳米颗粒(Gly-CysAuNPs,HD=3.1 nm,ζ=-27.3 mV,pH=7.4)[32]和谷胱甘肽-半胱氨酸涂层的金纳米颗粒(GC-AuNPs,HD=2.9 nm,ζ=-22 mV , pH=7.4)。GS-AuNPs、Gly-CysAuNPs 和 GC-AuNPs在注射后1小时的肾脏清除效率分别为28%ID、15.3%ID和10%ID,此结果证明了当纳米材料带负电时其表面电荷对肾脏清除效率呈反依赖性(图3B)。
2.1.3 其他影响因素 除上述两种决定因素外,纳米材料的形状和密度也影响着其是否能通过GFM。例如,长度为200~300 nm、分子质量约为350~500 kDa的碳纳米管可以被肾小球过滤,根据尺寸效应可知,200~300 nm的碳纳米管本不易通过GFM,但由于GBM的狭缝呈矩形形状,碳纳米管可以沿着其长轴定向滤过,因此其横截面的直径是影响其清除的主要因素[33]。此外,纳米材料的核心密度也对肾清除能力有一定的影响,Tang等[34]设计合成了大小为3 nm的表面均为谷胱甘肽配体的金、银以及金银合金纳米颗粒,其核心密度分别为[金:19.3×(g/cm3),银:10.5×(g/cm3)以及金银合金:11.4和15.9×(g/cm3)],其静脉注射2 h后的肾脏清除效率为金:29.19%ID,金银合金[15.9×(g/cm3)]:31.22%ID,金银合金[11.4×(g/cm-3)]:36.90%ID,银:45.87%ID。通过实验可以证明纳米材料的核心密度越小,越容易被肾小球过滤。
2.2 肾小管重吸收
在通过肾小球滤过后,纳米材料被转运到近端肾小管、肾髓质、肾盂和输尿管中,其中,近端肾小管对于纳米材料的清除也发挥出不同寻常的作用。与充当物理屏障(大小和电荷屏障)的 GFM 相比,近端小管作为化学屏障通过内吞的机制吸收纳米材料。经肾小球滤过后,纳米材料集中在近端肾小管中,导致肾小管细胞通过内吞作用将其内化[35]。例如,葡聚糖为基础的纳米材料和HD=5 nm的聚酰胺树状大分子纳米粒子,会被近端小管的上皮细胞内吞[36]。GS-AuNPs在通过GBM之后,能够被覆盖在近端小管腔表面的微绒毛捕获,此时如果微绒毛所捕获的GS-AuNPs一旦达到饱和,该纳米材料就会被清除到尿液中[37]。值得注意的是,不可肾脏清除的纳米材料是很难通过GBM到达近端肾小管从而实现重吸收的过程。
2.3 肾小管分泌
除上述两种途径外,肾小管分泌的外排机制对于纳米材料在肾脏中的清除也至关重要。肾小管分泌旨在清除循环内源性溶质(如氢离子、NH3和钾离子)以及代谢产物(如肌酐和对氨基马尿酸),从而减轻机体肾脏负担并维持机体稳态[38]。不同于肾小球滤过的是,肾小管分泌是一个主动的细胞运输过程,其往往涉及肾小管细胞表面的运进蛋白和外排蛋白的参与。其中可被肾小管分泌而外排出体外的物质主要是“有机阴离子转运体(organic anion transporter,OAT)结合的大分子”[39]。例如,Du等人对吲哚菁绿(indocyanine green,ICG)进行小分子的聚乙二醇修饰设计并合成了有机纳米探针ICG-PEG45,该探针能够通过肾小管基底外侧与OAT结合从而经肾小管分泌途径排出体外。值得一提的是,当肾小球滤过受损时则会影响肾脏的清除能力[40],而肾小管分泌在肾小球疾病下依旧有良好的清除能力,此外,Daniel A. Heller教授等人设计并合成了一种介观尺度的纳米材料MNPs,该材料HD=400 nm,其由于肾单位的压降和毛细血管的大吸收压力可被肾小管管周毛细血管的内皮细胞内吞。利用这一特性,MNPs实现了在近端肾小管长达七天的特异性累积,为治疗影响肾脏近端小管的疾病研究提供了重要的研究基础[41],为开发相关类型的肾脏疾病诊疗药物提供了更多可能性[42]。
3 可肾清除纳米材料在肾脏疾病诊疗中的应用
近年来,越来越多的纳米材料被应用于疾病的监测和治疗时的光学成像,然而,许多用于光学成像的纳米探针常常被网状内皮系统清除,这将导致纳米探针在肝脏和脾脏中积聚,从而对器官造成毒性损伤。相比之下,RCNMs有着更高的生物安全性,更符合临床医学转化的标准。基于这些优点,RCNMs在各种疾病的诊疗中崭露出更加科学高效的应用价值[13]。
3.1 RCNMs在肾损伤中的检测
肾脏损伤仍然是药物开发和临床护理中的一个主要问题。肾损伤分为急性(7天内)或慢性(≥3个月)。其中,急性肾损伤(acute kidney disease,AKI)在住院患者中有着高发病率(20%)和死亡率(34%)[43],早期识别AKI能够及时干预治疗从而保护肾功能,预防肾衰竭[44]。然而,临床诊断方法依赖于对生物标记物的测量,如血肌酐和血尿素氮,以及尿量和肾脏血液灌注,但这些指标都具有滞后性,在肾损伤早期并不敏感,只能在晚期检测肾功能不全的患者中才能有效体现出差异。因此,越来越多的RCNMs作为外源探针用于肾损伤的早期检测与诊断。基于肾病检测原理,目前肾脏影像探针可以大致分为两类:传输动力学型和响应型光学探针。
3.1.1 传输动力学型RCNMs在肾脏疾病中的应用 传输动力学型的RCNMs主要是针对其体内分布和药代动力学特点所设计合成。当肾脏疾病发生时,因肾脏功能结构的改变导致其清除半衰期和器官分布的特点与正常机体表现出不同,从而达到对肾损伤疾病的检测。单侧肾梗阻(unilateral ureteral obstruction, UUO)由于肾的代偿性,早期一般无明显症状,病理指标也过于滞后,其早期诊断一直是临床治疗的一大难点,针对此问题,2016年Yu等人[45](图4A),用谷胱甘肽涂层的近红外发光的金纳米颗粒(GS-AuNPs)实现了对UUO小鼠病变肾脏的特异性荧光成像,其在由UUO引起的肾小管轻度萎缩前期就能够对比出显著的代谢差异,为UUO的早期诊断填补空白。次年,Xu[46]等人通过X-ray成像方式(图4C),监测了GS-AuNPs在UUO小鼠从肾皮质和肾髓质转运到肾盂的过程,并发现该过程在UUO小鼠体内明显减慢,这是由于肾髓质的扩张和萎缩导致的,而GS-AuNPs转运到肾皮质的过程则无明显动力学差异,且与临床X-ray成像常用的碘对比剂相比,用量更少,肾保留时间更长,成像更清晰。该发现不仅加深了我们对正常和受损肾脏中RCNMs转运的基本理解,而且进一步拓宽了RCNMs在解剖层面的肾功能评估。
此外,在肾损伤检测中,传输动力学型的RCNMs常用作对肾小球滤过率(glomerular filtration rate, GFR)的监测。GFR是指每单位时间肾小球滤过的血浆体积,是测量整体肾功能的标准方法。健康成人的GFR值范围为90~120 mL·min-1·1.73m2,肾损伤患者的GFR低于60 mL·min-1·1.73m2。在临床上,通常采用内源性过滤标记物(如肌酐或胱抑素C)来估计GFR或检测外源性标记物清除率来测量GFR[47],这些方法均存在着电离辐射,且需多次对血液和尿液采样,这会给患者带来额外的健康风险且检测效率较低。因此越来越多的RCNMs根据其自身独特的传输动力学差异应用于GFR的定量检测,例如,Huang等人[48]将卟啉与可肾清除基团PEG结合合成了mTCPP,使其只经肾小球滤过而无肾小管的重吸收和分泌,从而定量检测AKI小鼠的GFR(图4B),然而,这种具有短波长发射(400~650 nm)的 RCNMs 穿透深度较低(6 mm),需要采血配合才能精准的定量GFR。为了克服光学成像的有限穿透深度并实现临床应用,Jiang等人[11]将谷胱甘肽涂层的纳米簇Au25SG18应用于肾脏中的实时光声成像(图4D),Au25SG18不但有着高时间分辨率(~1s),还可以清晰地观察到Au25SG18从主动脉→肾实质→肾盂的传输过程,以此来达到精确量化正常肾脏和病变肾脏的单肾GFR的目的。
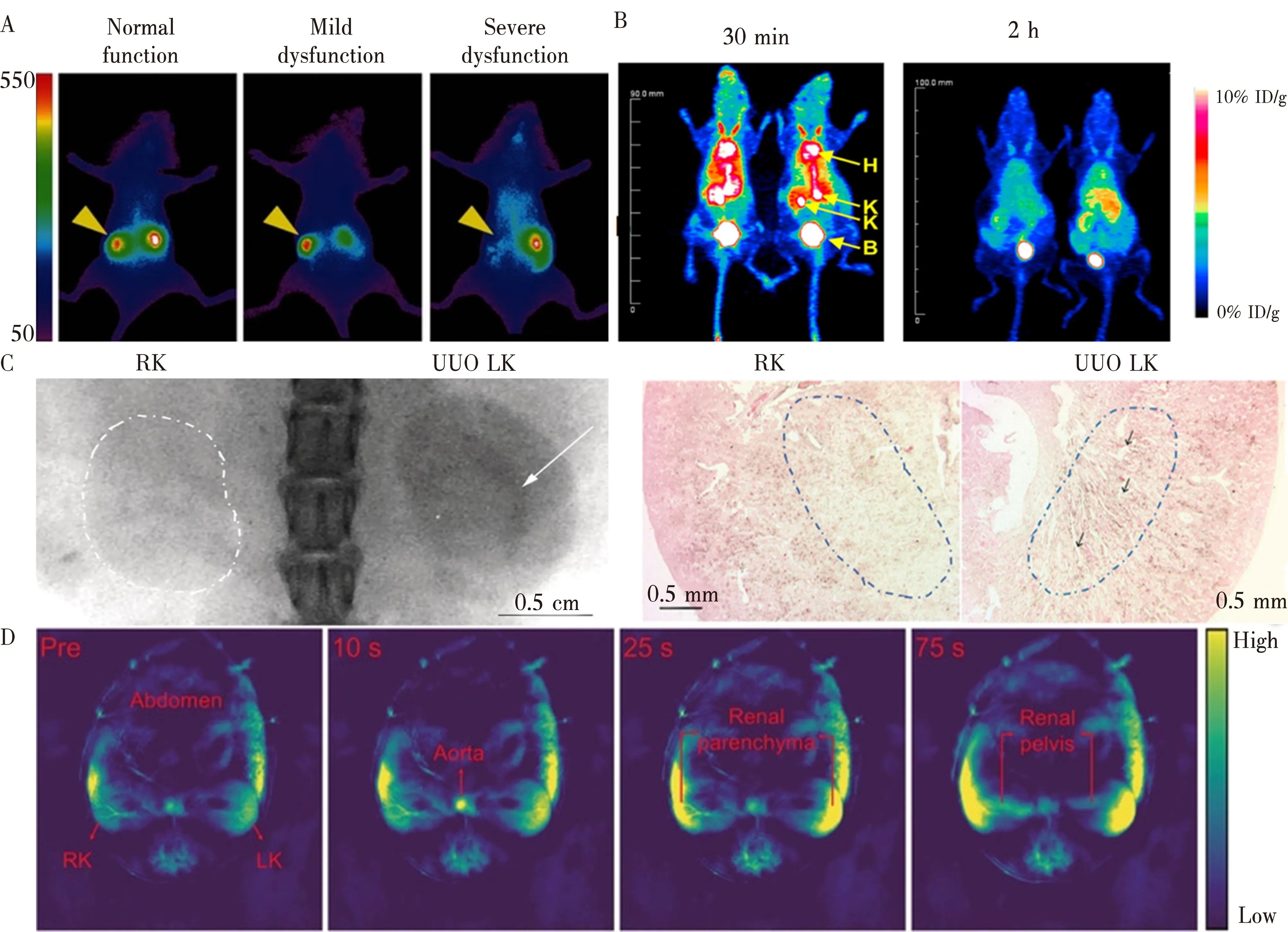
图4 传输动力学型的RCNMs的活体光学成像示意图注:A,GS-AuNPs在UUO小鼠病变早期和病变晚期的活体荧光成像示意图。B,mTCPP在顺铂诱导的急性肾损伤小鼠模型中尾静脉注射30 min和2 h的活体荧光成像示意图。C,为GS-AuNPs在UUO小鼠X-ray成像和肾脏苏木精-伊红染色的示意图。D,Au25SG18在小鼠肾脏部位~1 s~75 s的光声成像示意图。
3.1.2 响应型RCNMs在肾脏疾病中的应用 GFR 是肾功能的延迟指标,因为只有当肾脏在组织学水平上受到不可逆转的损伤时,GFR 才会显著衰减[49]。正常肾脏中约 100 万个肾单位,因此在可测量 GFR 大幅下降之前可能发生多处损伤,这时,针对肾损伤相关的生物标志物而特异性识别的响应型RCNMs就显得尤为重要。该类型RCNMs大多以有机荧光探针为母核,为其修饰能与各生物标志物响应的靶向官能团,通过化学反应或电子转移从而实现对生物标志物的检测,并发生一系列光学变化以应用于活体成像。2019 年,Pu等人将可肾清除基团 (2-羟丙基)-β-环糊精和荧光骨架半花青拼接,开发了一系列检测肾病的探针 MRP1,MRP2 和 MRP3,三种探针缀合不同的响应基团,分别靶向超氧阴离子、NAG 和 Caspase- 3,原位报告了AKI发生机制:氧化应激→溶酶体损伤→细胞凋亡→GFR下降,见图5。后续Pu等人基于该荧光骨架,针对其他氧化应激标志物如过氧亚硝酸根,开发了探针MRP5和MPR6[50]。此外,肾损伤过程中会导致肾小管微绒毛的缺失,从而引起GGT的泄露,Pu等人还开发了MPR4[51]针对其进行检测。上述所有MPR系列RCNMs均在AKI的早期诊断中表现出优于血肌酐和血尿素氮的检测,同时其它们可以作为尿液光学分析的外源示踪剂,证明了它们在 AKI 早期诊断方面的临床前景。
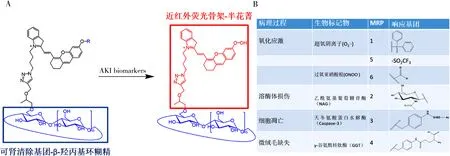
图5 MRP系列RCNMs的结构式以及各病理过程所对应响应基团示意图注:A,MRP系列RCNMs的各组成部分功能以及传感机制示意图;B,急性肾损伤发生时所引发的各病变过程以及其对应上调的生物标记物和各生物标记物的响应官能团。
3.2 RCNMs在肾癌中的检测
到目前为止,癌症依然是全世界最棘手的疾病,是人类主要的死亡原因[52],高精度的成像基础对于介导癌症的精准诊疗有着重要的意义。与通过肝胆通路清除的纳米材料(HD>6 nm)相比,可肾清除的纳米材料可增强体内清除速率并减少非特异性组织积累,从而提高肿瘤靶向效率和肿瘤部位的信号强度[53]。例如,Du等人对ICG进行小分子的聚乙二醇修饰设计并合成了有机纳米探针ICG-PEG45。该探针能够通过肾小管基底外侧与OAT结合从而经肾小管分泌途径排出体外,同时,利用正常和癌变肾细胞之间外排转运蛋白(P-糖蛋白)表达水平的差异,使ICG-PEG45能够选择性地积聚在肾癌组织中。从而利用可肾清除速率的不同完成了对肾细胞癌的靶向监测,为肾脏清除机理和肾脏清除之间的关系填补空白,给纳米材料在肾脏和其他疾病的诊疗中提供了有力的参考价值[54]。
3.3 纳米材料在肾病治疗中的应用
除上述诊断应用以外,纳米材料在肾脏疾病的治疗中也有着重要的作用。例如,肾缺血再灌注 (ischemia reperfusion , IR) 损伤是各种临床环境中不可避免的并发症,包括肾移植和大血管手术,在没有有效治疗的情况下有巨大的临床手术风险。肾脏 IR 损伤的主要原因是大量产生活性氧,包括过氧化氢 (H2O2),它们启动炎症信号通路,导致肾小管上皮细胞凋亡,最近Dongwon Lee等人[55]开发了岩藻糖涂层的聚纳米材料 Fu-PVU73,其受炎症部位H2O2的响应而释放H2O2清除剂香草醇和熊去氧胆酸,同时Fu-PVU73具备靶向肾小管上皮细胞凋亡时所上调的P-选择素的能力,实现了其在IR肾脏中的特异性累积并通过阻止大量活性氧产生和抑制 TNF-α和 IL-1β的表达发挥出明显的肾细胞保护作用,为肾脏IR损伤和各种活性氧相关炎症性疾病的治疗提供了有效的参考价值。
总结与展望
本文着重介绍了肾脏的结构与功能、纳米材料在肾脏中的三种传输机制、纳米材料理化性质对其肾内作用机制的影响以及可肾清除纳米材料在肾脏疾病早期检测和诊断中的应用。随着纳米材料在生物医学中的广泛研究与应用,因为肾脏可以将“脱靶”纳米材料快速清除到体外以降低潜在的毒副作用,所以纳米材料与肾脏的互作机制在国际上逐步被展开研究,然而,纳米材料的理化性质(如表面性质、电荷等)对纳米材料在肾脏内分子清除机制的影响仍不全面,需要进一步系统并深入的研究与理解。例如,目前大多数纳米材料是通过肾小球滤过完成的清除,但是能够通过肾小管分泌机制进行清除的纳米材料的研究和报道尚少,因此,如何调控纳米材料的理化性质,使其在肾脏内的清除机制可进行精准转换和调控,是接下来需要深入研究的方向。目前用于肾脏成像与肾病检测的纳米材料也仍主要是通过肾小球的滤过,通过肾小管清除的纳米材料应用于肾脏损伤检测的性能则有待进一步研究。此外,目前可肾清除纳米材料的应用多集中于肾脏疾病检测方面,应用于肾脏疾病治疗的相关报道较为罕见,因此,可肾清除纳米材料应用于肾脏疾病治疗方面值得深入研究。
