艾拉莫德通过TLR4/NF-κB通路抑制骨关节炎软骨细胞模型凋亡及炎症反应*
2023-02-15文振华姚芳玲
邓 丽,文振华,田 锋,姚芳玲
株洲市中心医院风湿免疫科,湖南株洲 412000
骨关节炎(OA)是一类以关节软骨退行性改变以及继发性骨质增生、骨赘形成为特征的慢性骨关节疾病,主要的临床症状是关节疼痛和活动受限,严重者会发展为关节畸形。目前,OA主要的保守治疗方法是使用非甾体类药物进行抗炎和镇痛,尚缺乏逆转关节软骨损害的特异性手段[1-2]。艾拉莫德是一种新型的抗风湿小分子药物,具有抑制炎症、调节免疫的生物学功能,临床上用于类风湿关节炎的治疗能够有效抑制关节滑膜中炎症反应及细胞凋亡的激活[3]。在OA的发病过程中,关节软骨细胞炎症反应及细胞凋亡的异常激活是造成软骨退行性改变重要的生物学因素[4],国内一项基础研究报道艾拉莫德对白细胞介素(IL)-1β诱导的关节软骨细胞基质水解具有改善作用[5],但该药物是否直接改善OA发病过程中关节软骨细胞的炎症反应及细胞凋亡尚不清楚。因此,本研究将以IL-1β刺激关节软骨细胞的方式建立OA细胞模型,具体观察艾拉莫德对OA细胞模型凋亡及炎症反应的调控作用及分子机制,旨在为发现OA治疗的新药物提供实验依据。
1 材料与方法
1.1细胞株 小鼠软骨细胞株ATDC5购自美国ATCC公司。
1.2仪器与试剂 细胞培养箱购自英国Herocell公司,多功能酶标仪购自美国ABI公司,显微镜为日本奥林巴斯公司产品,凝胶电泳仪及成像仪均为上海天能公司产品。达尔伯克改良伊格尔培养基(DMEM)及胎牛血清均购自美国Gibco公司,艾拉莫德片购自海南先声药业有限公司,CCK8细胞增殖检测试剂盒购自美国MCE公司,IL-1β购自美国Sigma公司,pcDNA质粒、pcDNA-TLR4质粒购自上海生工公司,TUNEL细胞凋亡试剂盒购自上海碧云天公司,细胞因子的酶联免疫吸附法(ELISA)试剂盒购自上海西唐公司,兔抗小鼠裂解型caspase-3(Cleaved caspase-3)、Toll样受体4(TLR4)、核因子-κB(NF-κB)p-p65、β-actin特异性一抗及山羊抗兔辣根过氧化物酶二抗购自美国Abcam公司。
1.3方法
1.3.1细胞培养 ATDC5细胞在含有10%胎牛血清的培养基中贴壁培养,每2 d更换1次培养基,当细胞密度生长至80%~90%时进行胰蛋白酶消化并按照1∶3的比例传代继续培养。
1.3.2细胞分组 传代的ATDC5细胞接种在培养板内进行分组,对照组用不含药物的培养基处理,模型组用含有10 ng/mL IL-1β的培养基处理,不同浓度艾拉莫德组用含有10 ng/mL IL-1β及不同浓度(0.6、1.2、1.8 mg/L)艾拉莫德处理;pcDNA对照组转染pcDNA质粒,pcDNA模型组在含有10 ng/mL IL-1β的培养基中转染pcDNA质粒,pcDNA+1.8 mg/L艾拉莫德组在含有10 ng/mL IL-1β及1.8 mg/L艾拉莫德的培养基中转染pcDNA质粒,pcDNA-TLR4+1.8 mg/L艾拉莫德组在含有10 ng/mL IL-1β及1.8 mg/L艾拉莫德的培养基中转染pcDNA-TLR4质粒。转染均采用脂质体法。每组做4个复孔,均连续给药或转染48 h。
1.3.3CCK8法检测细胞增殖活力 收集细胞,采用CCK8法进行细胞增殖的检测,每孔加入10 μL试剂盒检测液,继续培养2 h后在酶标仪上检测A490,并以A490表示细胞增殖活力。
1.3.4TUNEL法检测细胞凋亡 收集细胞,用4%多聚甲醛固定后进行TUNEL法检测,先加入TUNEL染液进行染色,漂洗后加入DAPI染液进行染色,最后用抗荧光猝灭封片液封片后在显微镜下随机观察5个高倍视野,对TUNEL阳性细胞和DAPI阳性细胞进行计数,计算细胞凋亡率=TUNEL阳性细胞数/DAPI阳性细胞数×100%。
1.3.5ELISA检测细胞因子水平 收集细胞培养基,采用ELISA试剂盒检测肿瘤坏死因子-α(TNF-α)、IL-6、IL-8的水平。操作严格按照试剂盒说明书进行。
1.3.6免疫印迹法检测蛋白表达水平 收集细胞,加入裂解液、裂解细胞、提取蛋白,检测蛋白浓度后将含有20 μg蛋白的样本加入聚丙烯酰胺凝胶,进行垂直电泳及水平电转膜;取电转后的硝酸纤维素膜,5%脱脂牛奶室温封闭1 h后Cleaved caspase-3、TLR4、NF-κB p-p65特异性一抗4 ℃孵育过夜;次日孵育二抗后在凝胶成像仪中进行ECL显影,得到蛋白条带并扫描灰度值,以β-actin为内参,计算Cleaved caspase-3、TLR4、NF-κB p-p65的表达水平。

2 结 果
2.1艾拉莫德对OA软骨细胞模型凋亡水平的影响 与对照组比较,模型组A490降低、凋亡率增加(P<0.05);与模型组比较,不同浓度艾拉莫德组A490升高、凋亡率降低(P<0.05)且艾拉莫德调节增殖活力凋亡的作用呈浓度依赖。TUNEL染色见图1,A490及凋亡率的比较见表1。

表1 对照组、模型组、不同浓度艾拉莫德组A490及凋亡率的比较
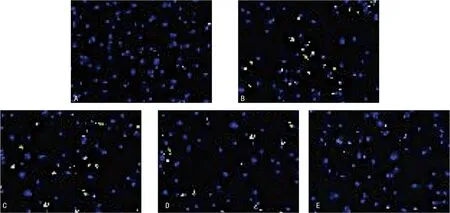
注:A为对照组;B为模型组:C为0.6 mg/L艾拉莫德组;D为1.2 mg/L艾拉莫德组;E为1.8 mg/L艾拉莫德组。
2.2艾拉莫德对OA软骨细胞模型凋亡基因表达的影响 与对照组比较,模型组Cleaved caspase-3的表达水平增加(P<0.05);与模型组比较,不同浓度艾拉莫德组Cleaved caspase-3的表达水平降低(P<0.05)且艾拉莫德调节Cleaved caspase-3表达的作用呈浓度依赖,见图2。

注:A为对照组;B为模型组;C为0.6 mg/L艾拉莫德组;D为1.2 mg/L艾拉莫德组;E为1.8 mg/L艾拉莫德组。与对照组比较,*P<0.05;与模型组比较,#P<0.05。
2.3艾拉莫德对OA软骨细胞模型炎症反应的影响 与对照组比较,OA模型组TNF-α、IL-6、IL-8水平增加(P<0.05);与OA组比较,不同浓度艾拉莫德组组TNF-α、IL-6、IL-8水平降低(P<0.05)且艾拉莫德调节组TNF-α、IL-6、IL-8水平的作用呈浓度依赖。见表2。

表2 对照组、模型组、不同浓度艾拉莫德组TNF-α、IL-6、IL-8水平比较
2.4艾拉莫德对OA软骨细胞模型TLR4、NF-κB p-p65表达的影响 与对照组比较,模型组TLR4、NF-κB p-p65的表达水平增加(P<0.05);与OA组比较,不同浓度艾拉莫德组TLR4、NF-κB p-p65的表达水平降低(P<0.05)且艾拉莫德调节TLR4、NF-κB p-p65表达的作用呈浓度依赖。见图3。
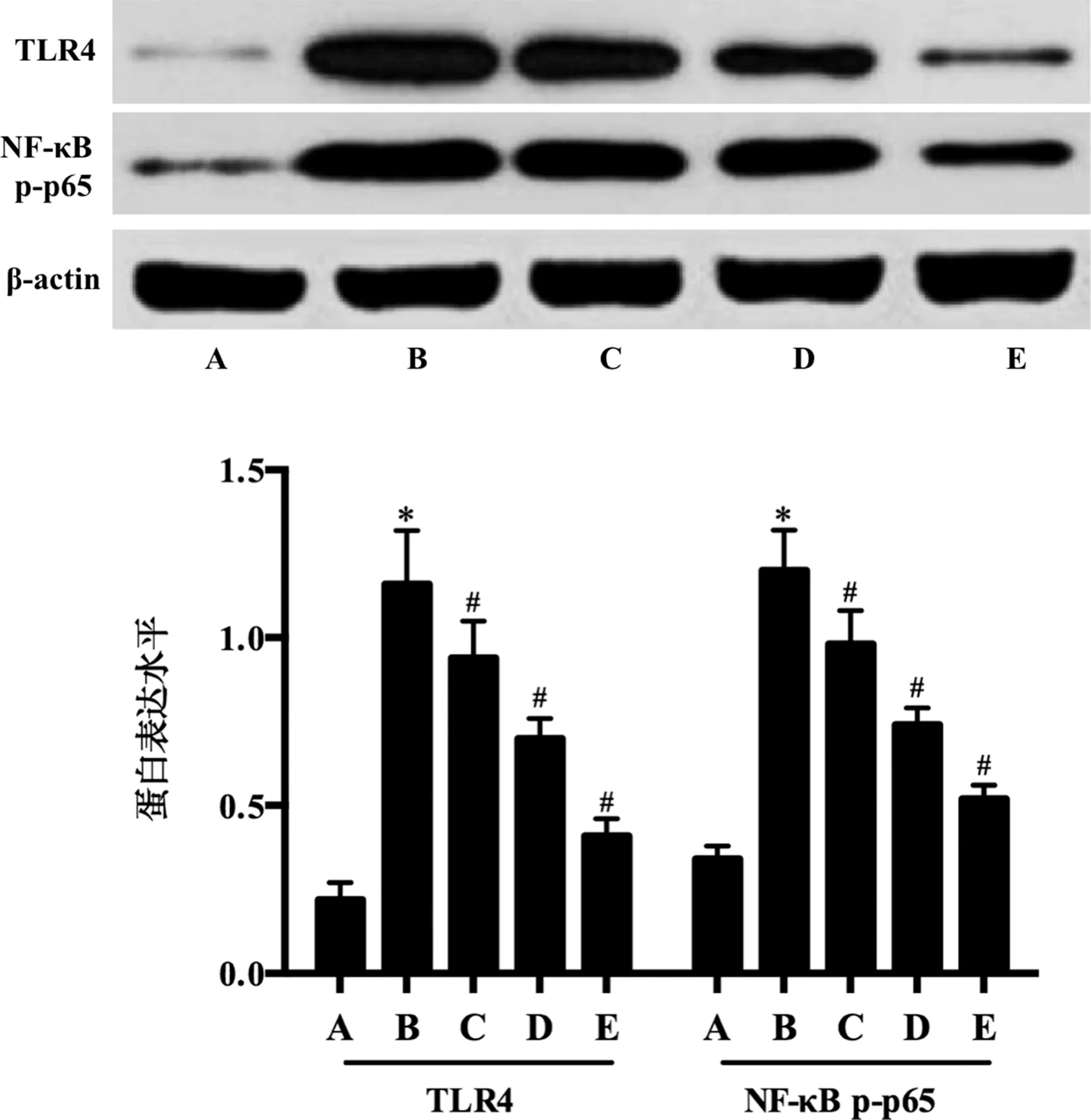
注:A为对照组;B为模型组;C为0.6 mg/L艾拉莫德组;D为1.2 mg/L艾拉莫德组;E为1.8 mg/L艾拉莫德组;与对照组比较,*P<0.05;与模型组比较,#P<0.05。
2.5过表达TLR4对艾拉莫德抑制OA软骨细胞模型TLR4、NF-κB p-p65表达的影响 与pcDNA对照组比较,pcDNA模型组中TLR4、NF-κB p-p65的表达水平增加(P<0.05);与pcDNA模型组比较,pcDNA+1.8 mg/L艾拉莫德组中TLR4、NF-κB p-p65的表达水平降低(P<0.05);与pcDNA+1.8 mg/L艾拉莫德组比较,pcDNA-TLR4+1.8 mg/L艾拉莫德组中TLR4、NF-κB p-p65的表达水平增加(P<0.05)。见图4。

注:A为pcDNA对照组;B为pcDNA模型组;C为pcDNA+1.8 mg/L艾拉莫德组;D为pcDNA-TLR4+1.8 mg/L艾拉莫德组;与pcDNA对照组比较,*P<0.05;与pcDNA模型组比较,#P<0.05;与pcDNA+1.8 mg/L艾拉莫德组比较,△P<0.05。
2.6过表达TLR4对艾拉莫德降低OA软骨细胞模型凋亡水平的影响 与pcDNA对照组比较,pcDNA模型组A490降低、凋亡率增加(P<0.05);与pcDNA模型组比较,pcDNA+1.8 mg/L艾拉莫德组增殖活力A490增加、凋亡率降低(P<0.05);与pcDNA+1.8 mg/L艾拉莫德组比较,pcDNA-TLR4+1.8 mg/L艾拉莫德组增殖活力A490降低、凋亡率增加(P<0.05)。TUNEL染色见图5,A490及凋亡率的比较见表3。

注:A为pcDNA对照组;B为pcDNA模型组;C为pcDNA+1.8 mg/L艾拉莫德组;D为pcDNA-TLR4+1.8 mg/L艾拉莫德组。

表3 各组细胞A490及凋亡率的比较
2.7过表达TLR4对艾拉莫德抑制OA软骨细胞模型凋亡基因表达的影响 与pcDNA对照组比较,pcDNA模型组中cleaved caspase-3的表达水平增加(P<0.05);与pcDNA模型组比较,pcDNA+1.8 mg/L艾拉莫德组中cleaved caspase-3的表达水平降低(P<0.05);与pcDNA+1.8 mg/L艾拉莫德组比较,pcDNA-TLR4+1.8 mg/L艾拉莫德组中cleaved caspase-3的表达水平增加(P<0.05)。见图6。

注:A为pcDNA对照组;B为pcDNA模型组;C为pcDNA+1.8 mg/L艾拉莫德组;D为pcDNA-TLR4+1.8 mg/L艾拉莫德组。与pcDNA对照组比较,*P<0.05;与pcDNA模型组比较,#P<0.05;与pcDNA+1.8 mg/L艾拉莫德组比较,△P<0.05。
2.8过表达TLR4对艾拉莫德抑制OA软骨细胞模型炎症反应的影响 与pcDNA对照组比较,pcDNA模型组TNF-α、IL-6、IL-8的水平增加(P<0.05);与pcDNA模型组比较,pcDNA+1.8 mg/L艾拉莫德组TNF-α、IL-6、IL-8的水平增加降低(P<0.05);与pcDNA+1.8 mg/L艾拉莫德组比较,pcDNA-TLR4+1.8 mg/L艾拉莫德组TNF-α、IL-6、IL-8的水平增加(P<0.05)。见表4。

表4 各组细胞TNF-α、IL-6、IL-8水平比较
3 讨 论
软骨细胞是关节软骨内合成软骨基质的唯一细胞,对于维持软骨正常的结构和功能具有重要意义。软骨细胞在慢性炎症、机械应力的刺激下发生损伤会导致关节软骨基质降解并逐步出现软骨退行性改变、继发性骨质增生和骨赘形成等OA特征性改变。因此,保护关节软骨细胞是治疗OA的关键。但目前常用的非甾体类药物、氨基葡萄糖、硫酸软骨素等药物虽然能够起到抗炎镇痛、促进软骨基质修复的作用,但无法直接保护软骨细胞、逆转软骨退行性变的作用,寻找新的OA治疗药物及手段具有迫切的临床需求。
艾拉莫德是一种新型的类风湿关节炎治疗药物,具有抑制炎症及免疫调节活性,相关的细胞实验证实该药物用于处理类风湿关节炎滑膜细胞能够抑制炎症反应和细胞凋亡[6-7]。近些年,陆续有学者报道了艾拉莫德用于OA治疗的价值。虽然该药品目前未获得治疗OA的适应证,但国内一项随机对照研究将艾拉莫德用于OA治疗,结果证实艾拉莫德显著减轻疼痛、改善关节功能、抑制炎症反应[8];另一项细胞实验证实艾拉莫德对OA软骨细胞模型的细胞基质降解具有抑制作用[5],提示艾拉莫德可能通过延缓或逆转关节软骨退行性改变的途径发挥OA治疗价值,但目前关于艾拉莫德对OA发病过程中软骨细胞的保护作用尚缺乏直接证据,这也使艾拉莫德用于OA治疗缺乏足够的基础研究证据。
本研究设计了细胞实验,采用与既往其他学者相同的10 ng/mL IL-1β刺激的方式建立OA软骨细胞模型并给予艾拉莫德干预[9-10]。OA软骨细胞模型出现了细胞凋亡和炎症反应的激活,表现为增殖活力降低,凋亡率及凋亡基因Cleaved caspase-3表达水平、多种炎症细胞因子水平增加,符合OA的特征。经艾拉莫德干预后,OA软骨细胞模型的细胞凋亡和炎症反应均受到抑制,细胞的增殖活力增加,凋亡率及凋亡基因Cleaved caspase-3表达水平、多种炎症细胞因子水平均降低。以上结果表明艾拉莫德对OA软骨细胞模型的炎症反应和细胞凋亡具有抑制作用,这也为艾拉莫德治疗OA发挥软骨保护作用提供了直接的细胞实验证据,也为今后使用艾拉莫德治疗OA积累了基础研究资料。
艾拉莫德目前的适应证是用于类风湿关节炎的治疗,多项相关的基础研究证实艾拉莫德减轻滑膜组织炎症反应的作用与抑制TLR4/NF-κB通路的激活有关[11-12]。OA的发生、发展同样涉及TLR4/NF-κB通路的激活,该通路的激活显著促进软骨细胞的凋亡及炎症反应[13-15]。本研究使用艾拉莫德对OA软骨细胞模型进行干预后TLR4及NF-κB p-p65的表达水平均明显降低,提示艾拉莫德在OA治疗过程中可能抑制软骨细胞的TLR4/NF-κB通路。进一步设计拯救实验,在艾拉莫德处理的同时通过转染pcDNA-TLR4质粒的方式增加TLR4及NF-κB p-p65的表达后,艾拉莫德减轻OA软骨细胞模型细胞凋亡和炎症反应的作用被逆转,表明艾拉莫德通过抑制TLR4/NF-κB通路减轻OA软骨细胞模型细胞凋亡和炎症反应,这为深入认识艾拉莫德发挥OA治疗价值的分子机制积累了实验数据。
综上所述,在10 ng/mL IL-1β刺激所建立的OA软骨细胞模型中,给予艾拉莫德干预能够减轻凋亡及炎症反应,这一作用与抑制TLR4/NF-κB通路有关,这为今后使用艾拉莫德治疗OA、研究艾拉莫德的分子药理机制积累了细胞实验数据。TLR4下游包括MyD88依赖途径和非MyD88依赖途径,本文初步揭示了艾拉莫德抗炎及抗凋亡的作用与抑制TLR4/NF-κB通路有关,但具体对MyD88依赖途径和非MyD88依赖途径调控作用尚不清楚,今后应进一步探讨TLR4下游不同途径在艾拉莫德抗炎及抗凋亡中的作用。
