山羊肺源肠外致病型大肠杆菌的分离鉴定、耐药性测定和毒力基因检测
2023-02-15徐海军李小红爨淑楠张娅菲王书明张圣尧
徐海军,李小红,爨淑楠,张娅菲,贾 哲,王书明,张圣尧
(1.皖西学院 生物与制药工程学院,安徽六安 237012;2.安徽金丰源畜牧科技有限公司,安徽六安 237000)
大肠杆菌可分为共生型、肠内致病型和肠外致病型(Extraintestinal pathogenicEscherichiacoli, ExPEC)3类菌群。共生型大肠杆菌是正常肠道菌群的重要组成部分,但致病型大肠杆菌可引起人和动物的疾病。肠内致病型大肠杆菌包括肠致病性大肠杆菌、产肠毒素大肠杆菌、肠侵袭性大肠杆菌、肠聚集性大肠杆菌、弥散黏附性大肠杆菌和肠出血性大肠杆菌,可引起腹泻、仔猪水肿病、畜禽败血症、人溶血尿毒综合症[1]。ExPEC不引起宿主肠道感染,但可以侵袭、定植于肠外组织,导致泌尿系统感染、新生儿脑膜炎、肺炎、心内膜炎、败血症等[2-4]。动物源的ExPEC也可以通过污染的食品传染给人,对人类健康构成威胁[5-6]。
随着养羊业的规模化、集约化发展,由肠内致病型大肠杆菌引起的山羊大肠杆菌病已成为一种常见病和多发病,主要表现为羔羊腹泻。近年来,羊感染ExPEC的报道也日渐增多[7-8]。由于ExPEC感染引起的症状和病变缺乏特异性,给基层准确诊断本病造成了一定困难。
2020年11月,安徽金丰源畜牧科技有限公司动物疾病诊断实验室从发病山羊肺脏分离得到1株细菌,通过分离纯化、16S rRNA基因序列分析,结合菌体形态特征和选择性培养基上菌落形态特征,鉴定为大肠杆菌。对该菌开展溶血试验、系统进化群分析、致病性测定、进化树构建、毒力基因检测、耐药性检测,并选择敏感药物对患病山羊进行治疗。期望研究结果能为进一步研究该菌的生物学特性和致病机理奠定基础,同时也为山羊ExPEC性肺炎的诊治提供参考。
1 材料与方法
1.1 材 料
1.1.1 试剂药品 胰蛋白胨大豆琼脂(Tryptic soybean peptone agar, TSA)、胰蛋白胨大豆肉汤、伊红美蓝琼脂、麦康凯琼脂购自北京奥博星生物技术有限责任公司;无菌脱纤绵羊血购自南京亚松生物科技有限公司;Taq酶、dNTP Mix、DNA Marker等购自TaKaRa公司;Ezup柱式细菌基因组DNA抽提试剂盒、SanPrep柱式DNA胶回收试剂盒购自生工生物工程(上海)股份有限公司;革兰氏染色液、药敏纸片(呋喃唑酮、复方新诺明、万古霉素)购自杭州滨和微生物试剂有限公司;药敏纸片(卡那霉素、新霉素、头孢曲松、多粘菌素B、庆大霉素、阿米卡星、恩诺沙星、阿莫西林、氟苯尼考、红霉素)购自常德比克曼生物科技有限公司;头孢噻呋钠粉针剂购自内蒙古联邦动保药品有限公司;麻杏石甘散购自上海亿源生物药业有限公司。
1.1.2 主要仪器 AE124型电子天平(上海舜宇恒平科学仪器有限公司);SW-CJ-2FD型洁净工作台(上海博讯实业有限公司医疗设备厂);HGPN-II-270型隔水式电热恒温培养箱(上海跃进医疗器械有限公司);GI54DP型立式自动压力蒸汽灭菌器(厦门致微仪器有限公司);DHG-9035A型电热鼓风干燥箱(上海一恒科学仪器有限公司);XS-208B型生物显微镜(济南德胜光电仪器有限公司);HC-2518R型冷冻高速离心机(安徽中科中佳科学仪器有限公司);DYCP-31DN型DNA 电泳槽、DYY-5型稳压电泳仪(北京六一仪器厂);2720型PCR仪(Applied Biosystems);FR980型凝胶成像仪(上海复日科技仪器有限公司)。
1.1.3 试验动物 昆明种雄性SPF级小鼠10只,体质量(20±2)g,购自安徽中医药大学实验动物中心。
1.2 方法
1.2.1 病史调查、临床症状与病理剖检观察 2020年11月下旬,六安市金安区某山羊养殖户饲养的2月龄小山羊陆续出现零星发病,症状为精神不振,气喘,发病较突然,有的在外面放牧时发病,体温38~40.5 ℃。发病半个月以来累计死亡6只小山羊,大山羊和母山羊未发病。2020年12月1日,又有1只小山羊发病,送来就诊。该羊较瘦,极度虚弱,精神高度沉郁,耳根发凉,但气喘不明显,也未见咳嗽。该羊送达后不久死亡,对其进行了病理剖检观察。
1.2.2 细菌分离纯化、革兰氏染色镜检及溶血试验 无菌操作采集病死羊病变肺组织,涂擦接种于TSA平板,37 ℃培养18 h。用接种环挑取长出的菌落用划线接种法分别转接于TSA平板、伊红美兰平板和麦康凯平板,37 ℃培养18 h后,观察菌落形态,挑取TSA平板上的单个菌落进行革兰氏染色镜检,并挑取单个菌落进行纯化培养。将纯化的分离菌接种于含5%无菌脱纤绵羊血的TSA平板,37 ℃培养18 h后,观察有无溶血。
1.2.3 分离菌16S rRNA基因测序、进化树构建 将分离菌纯化培养3次的TSA平板纯培养物送生工生物工程(上海)股份有限公司进行16S rRNA基因测序。将获得的基因序列在NCBI网站利用BLAST程序进行相似性比对,根据比对结果,结合分离菌在选择性培养基上的菌落特征确定分离菌株的生物种属。选取相似性高的序列,运用 MEGA 7.0软件采用邻接法构建该菌的系统发育进化树。
1.2.4 系统进化群鉴定 参照文献[9]合成扩增系统进化群分群基因(chuA、yjaA和TspE4.C2.)的特异性引物,引物由生工生物工程(上海)股份有限公司合成。引物序列、退火温度及扩增片段预期大小见表1。用Ezup柱式细菌基因组DNA抽提试剂盒提取分离菌基因组DNA,并作为模板进行PCR扩增。PCR反应体系(25 μL):2×TaqPCR MasterMix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板1 μL,ddH2O 9.5 μL。PCR反应条件:95 ℃ 5 min;94 ℃ 30 s,退火30 s(不同引物的退火温度见表1),72 ℃ 90 s,循环30次;72 ℃ 10 min。取5 μL PCR 反应产物用10 g/L琼脂糖凝胶电泳进行检测,凝胶成像系统观察并记录结果。切下凝胶中的目的条带,用SanPrep柱式DNA胶回收试剂盒回收扩增产物进行测序,并与GenBank中的参考序列进行相似性比对。

表1 研究中使用的引物序列
1.2.5 致病性试验 将10只小鼠随机分为攻毒组和对照组,每组5只。将分离菌菌种接种于胰大豆蛋白胨肉汤中,37 ℃培养18 h,4 ℃、5 000 r/min离心 5 min 收集菌体,用灭菌生理盐水悬浮菌体,进行细菌计数。根据计数结果将细菌浓度调整至108CFU/mL,攻毒组小鼠按每只0.5 mL剂量腹腔注射菌液,对照组小鼠腹腔注射等体积灭菌生理盐水,注射后连续7 d观察记录小鼠状态和死亡情况。对死亡小鼠进行剖检,观察病变情况并从肝脏中分离细菌。
1.2.6 毒力基因检测 根据文献[8-11]设计并合成扩增ExPEC毒力基因papA、sfaS、focG、iutA、hlyD、afa、fyuA、ireA、vaT、irp2、irp1、tsh、ler、iss、papC、kpsMTII、focD、iroN、ompA、ompT、fimH、hylA、gafD、cnf1、bmaE、cvaC、ibeA、iucD、traT、iha、nfaE和malX的引物,序列见表1,由生工生物工程(上海)股份有限公司合成。以细菌基因组为模板对32种毒力基因进行PCR扩增。对扩增产物进行测序,并与GenBank中的参考序列进行相似性比对。
1.2.7 药敏试验 参照美国临床实验室标准化协会(CLSI)2017推荐的标准K-B纸片法进行药敏试验,先将分离菌用涂布棒均匀涂布接种在TSA平板上,再将9类13种药敏纸片均匀贴于培养基表面,37 ℃培养18 h后,测量抑菌圈直径,判定药敏试验结果。以E.coliATCC 25922作为质控菌株。
1.2.8 防治措施 依据药敏试验结果,选用敏感抗菌药对患病山羊进行治疗,对全群山羊进行给药预防。加强饲养环境消毒,保持良好卫生条件。
2 结果与分析
2.1 病理剖检
该病羊剖检病变为一侧肺脏上半部分散在不规则形红色肝变病灶(图1)、心肌较软,其余未见明显异常。
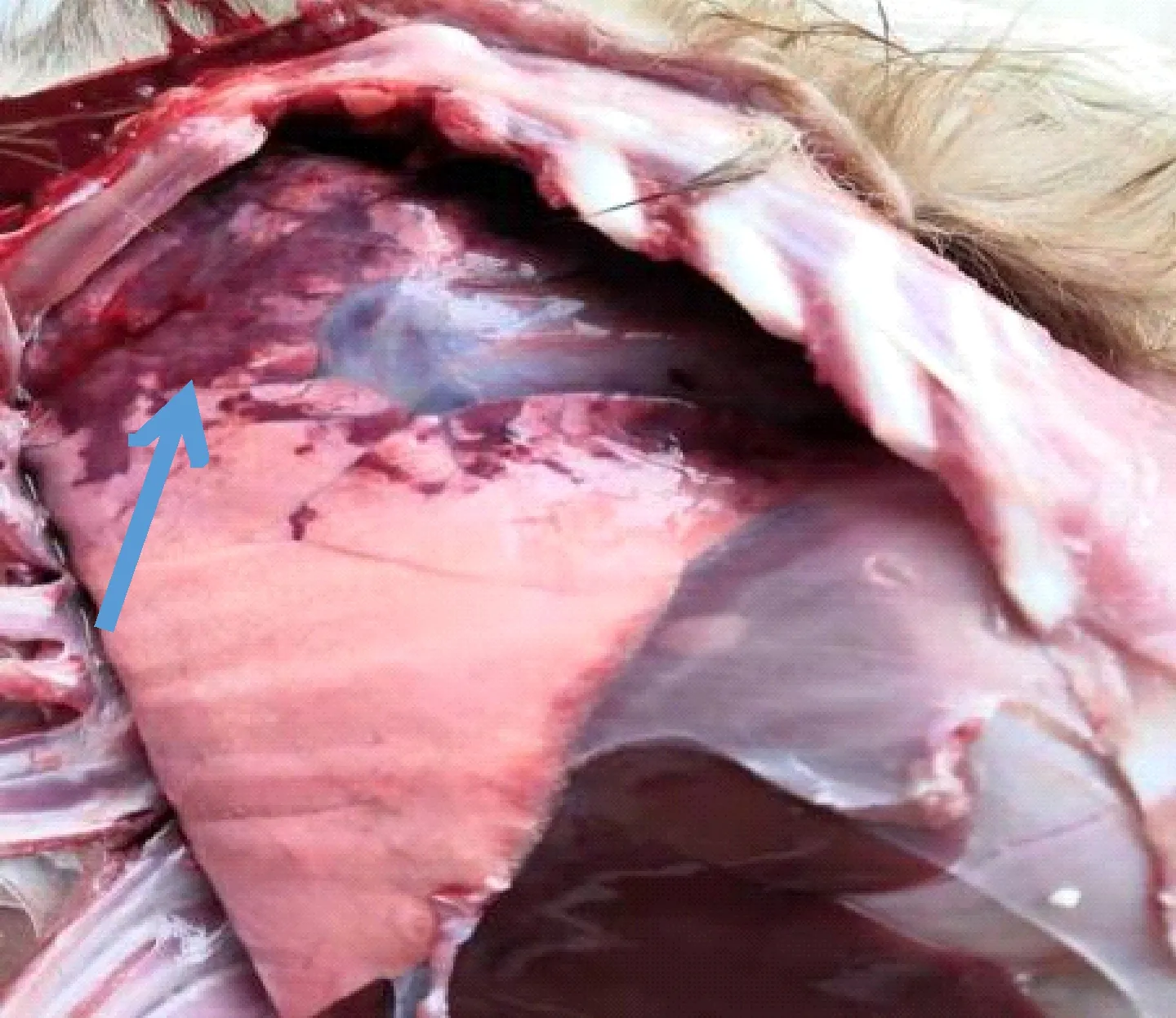
图1 患病山羊一侧肺脏上半部散在不规则形红色肝变病灶
2.2 细菌分离纯化、革兰氏染色镜检及溶血试验
从患病山羊病变肺脏组织分离到40个灰白色菌落,经纯化培养后,分离菌在TSA平板上的菌落呈圆形、边缘整齐、表面光滑湿润、灰白色、隆起(图2);在伊红美蓝平板上的菌落呈圆形、边缘整齐、表面光滑、深紫黑色、带有金属光泽(图3);在麦康凯平板上的菌落呈圆形、边缘整齐、表面光滑湿润、红色(图4)。挑取TSA平板上单菌落制成细菌涂片,革兰氏染色镜检结果表明该菌为短杆状的革兰氏阴性菌(图5)。溶血试验表明该菌无溶血现象(图6)。
图2 分离菌在TSA平板上的菌落形态

图3 分离菌在伊红美兰平板上的菌落形态

图4 分离菌在麦康凯平板上的菌落形态
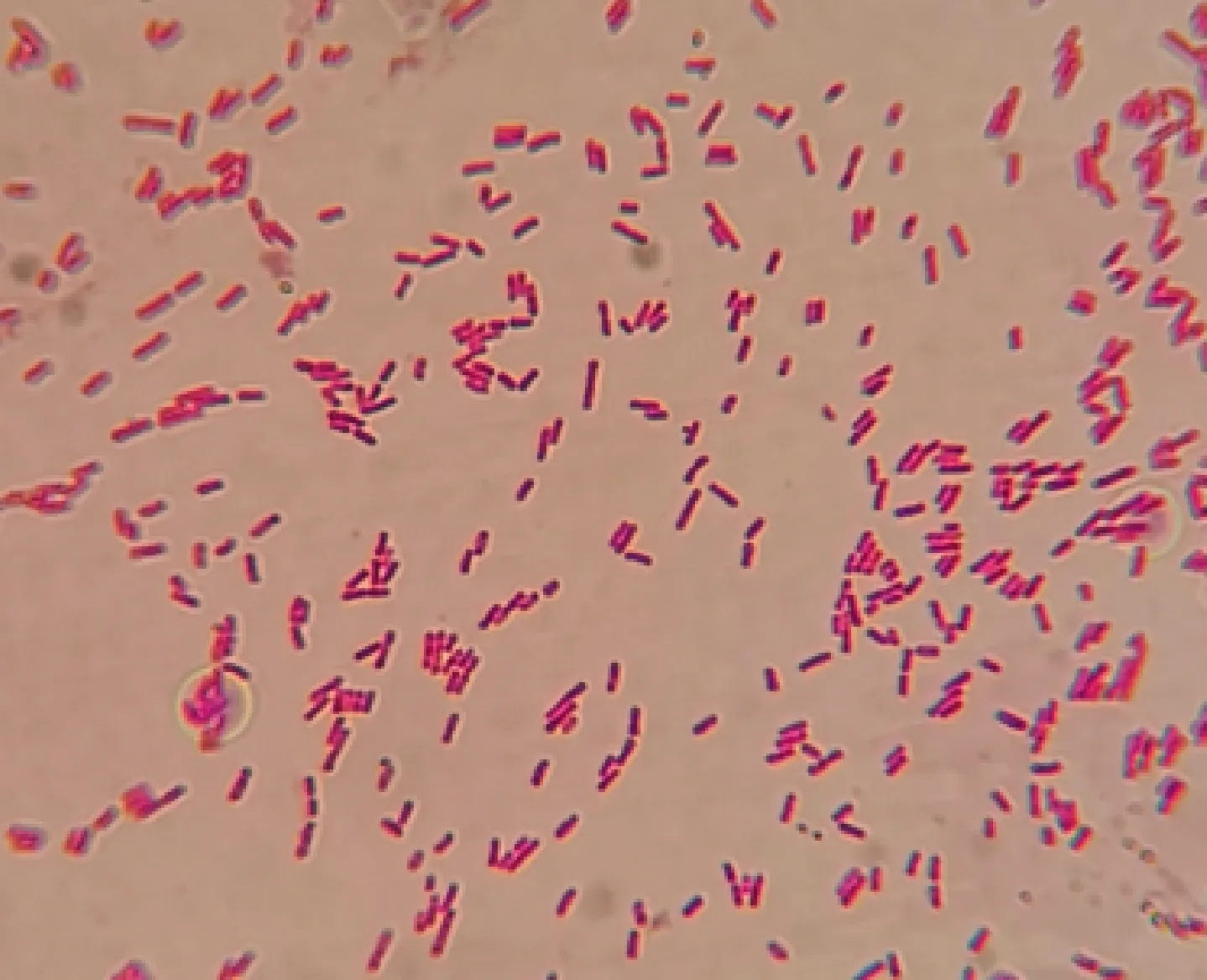
图5 分离菌的革兰氏染色镜检结果(1 000×)

图6 分离菌的溶血试验结果
2.3 分离菌16S rRNA基因鉴定结果及进化树的构建
将测序获得的分离菌16S rRNA基因(1 481 bp)序列在NCBI上利用BLASTn检索程序进行序列相似性比对,结果显示分离菌的16S rRNA基因序列与E.colistrain RHB08-C16(CP057959.1)、E.colistrain RHB18-C23(CP057660.1)、E.colistrain RHB08-C20(CP055971.1)、E.colistrain RIVM C018249(CP068802.1)、E.colistrain EC931(CP049118.1)的16S rRNA基因序列相似度均为99.66%。值得注意的是,分离菌的16S rRNA基因序列与Salmonellasp.S13(CP047094.1)和Shigellaboydiistrain FBD007(EU009178.1)的相似度达到99.73%。但综合分离菌的形态特征、选择性培养基上菌落形态特点和16S rRNA 基因序列的比对结果,将该分离菌最终鉴定为埃希氏菌属的大肠杆菌,将其命名为E.coli-LA-goat。
选取与分离菌相似性高的大肠杆菌16S rDNA序列,运用MEGA 7.0软件采用邻接法构建系统发育进化树,结果显示分离菌株的16S rRNA 基因序列与大肠杆菌E.coliRH808-C16(CP057959.1)株、E.coliRHB18-C23(CP057660.1)株的相应序列聚为一支,置信度为100%(图7),说明三者在进化上亲缘关系非常近。
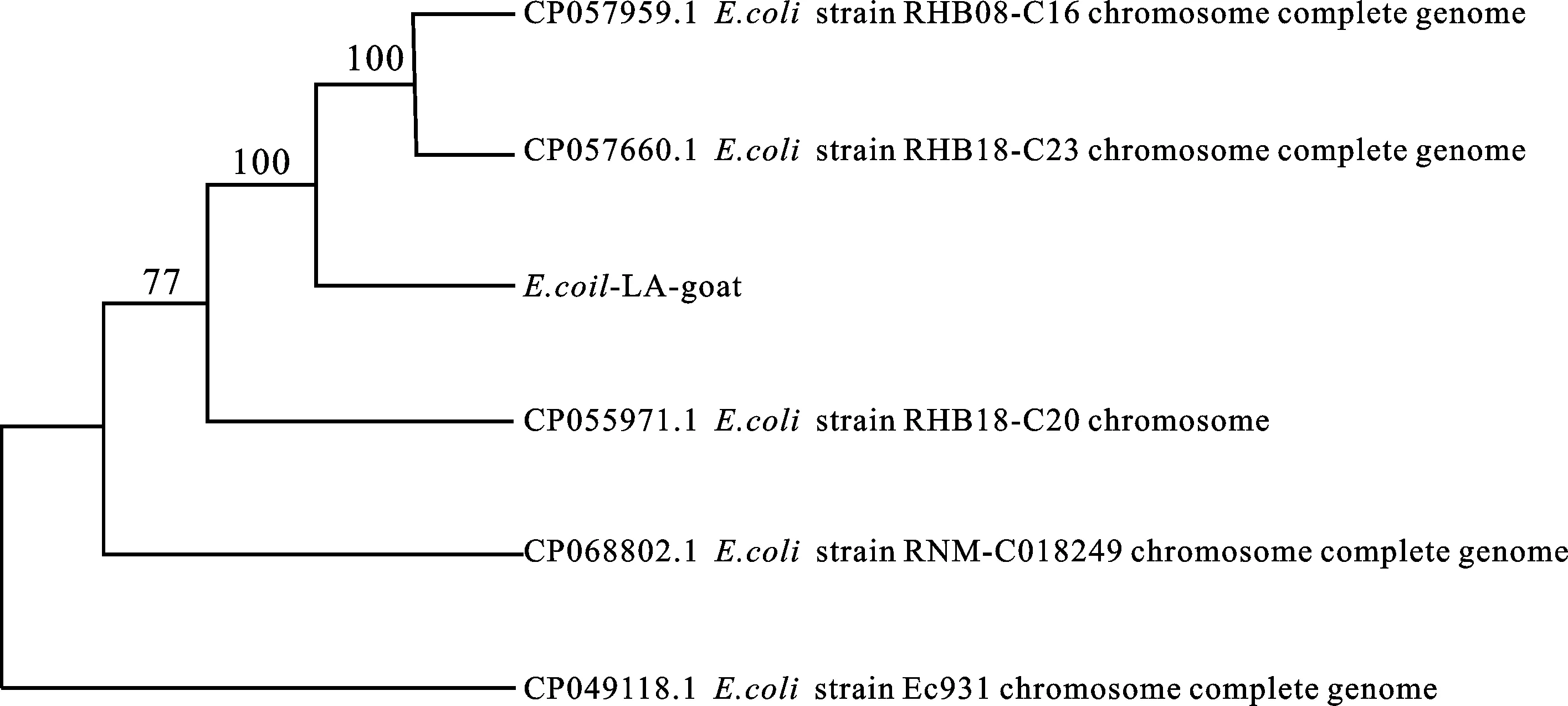
图7 分离菌基于16S rRNA基因序列的发育进化树
2.4 系统进化群鉴定结果
系统进化群分群基因(chuA、yjaA和TspE4.C2.)检测结果(图8)显示该菌TspE4.C2.呈阳性,chuA和yjaA基因PCR扩增结果为阴性。因此,参照大肠杆菌系统进化性组别检索表[12](表2),确定该菌属于B1群。
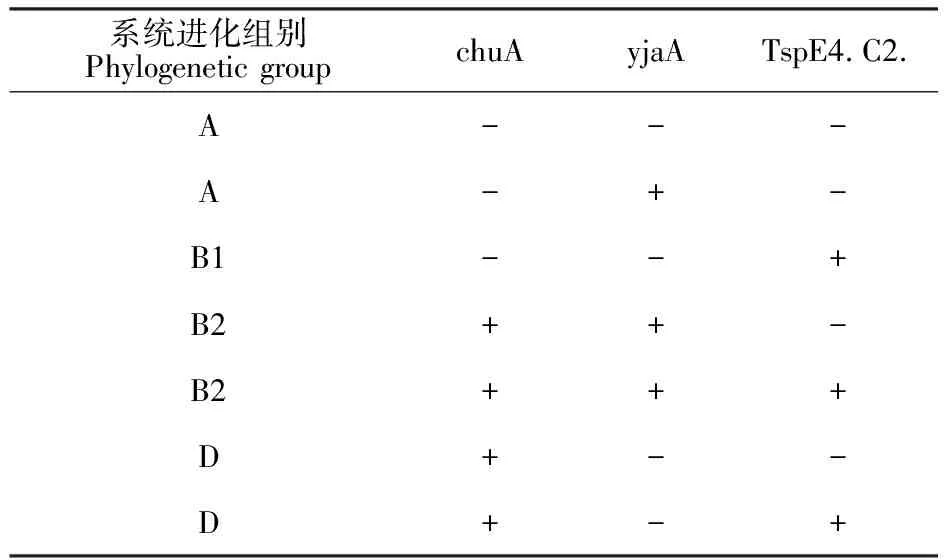
表2 大肠杆菌系统进化性组别检索表

1~4分别为chuA、yjaA、 TspE4.C2.基因和阴性对照(蒸馏水)扩增产物电泳图。 TspE4.C2.基因扩增结果呈阳性,大小为150 bp
2.5 分离菌致病性试验结果
试验组小鼠注射完菌液后24 h内,均出现萎靡不振、双目紧闭、被毛粗乱、食欲下降或废绝,并伴有严重的腹泻,濒死小鼠表现为全身颤抖、呈腹式呼吸。试验组攻毒后第2天小鼠死亡3只,第3天1只小鼠发生严重腹泻,1只小鼠精神好转、被毛恢复光泽,第4天无小鼠死亡,第5天腹泻小鼠死亡,第6天后无死亡小鼠。对照组无小鼠死亡。因此,该分离菌对小鼠的致死率为80%(4/5)(表3)。

表3 分离菌对小鼠致病性测定结果
剖检攻毒死亡小鼠发现肝脏、脾脏肿大,呈黑红色,肺脏有白斑样病灶,胃、肠道内有黄褐色积液,并伴有恶臭味。无菌采集小鼠肝脏组织涂擦接种到麦康凯平板、TSA平板均分离到与攻毒菌菌落形态一致的细菌菌落;将TSA平板上的单个菌落进行革兰氏染色镜检,结果呈革兰氏阴性,且形态特征与大肠杆菌一致。说明山羊肺脏分离菌能够致死小鼠,具有很强的致病性。
2.6 分离菌毒力基因检测结果
对ExPEC的32种毒力基因进行PCR检测,结果显示该菌株携带的毒力基因有iutA(314 bp)、afa(594 bp)、tsh(581 bp)、ompA(718 bp)、fimH(484 bp)、gafD(855 bp)、iucD(710 bp)、traT(283 bp),未检测到其他毒力基因(图9)。毒力基因的PCR产物测序结果与GenBank参考序列的相似性大于99%。
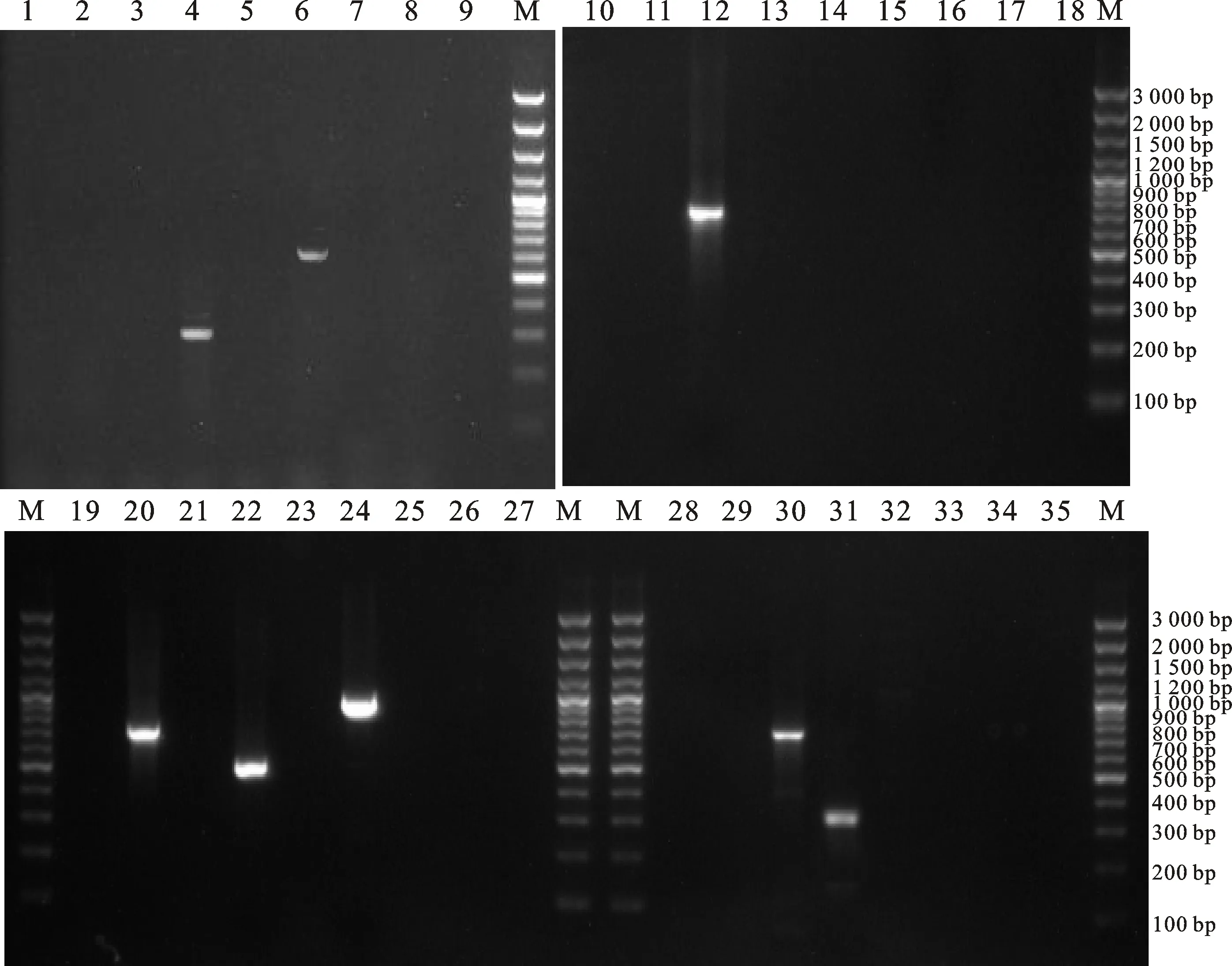
1~35分别为各毒力基因扩增产物电泳图,其中18、27和35为蒸馏水阴性对照。毒力基因iutA(4)、afa(6)、tsh(12)、ompA(20)、fimH(22)、gafD(24)、iucD(30)、traT(31)扩增结果呈阳性;其他毒力基因扩增结果呈阴性
2.7 分离菌药敏试验结果
分离菌药敏试验结果见图10和表4,可见分离菌对头孢曲松、氟苯尼考、恩诺沙星和阿米卡星中度敏感,对卡那霉素、新霉素、阿莫西林、庆大霉素、多粘菌素B、呋喃唑酮、复方新诺明、万古霉素、红霉素等9种抗菌药耐药。

表4 分离菌耐药性试验结果
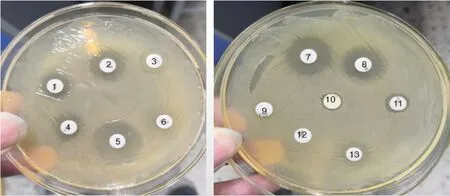
1.新霉素;2.阿米卡星;3.阿莫西林;4.庆大霉素;5.头孢曲松;6.红霉素;7.氟苯尼考;8.恩诺沙星;9.万古霉素;10.呋喃唑酮;11.多粘菌素B;12.复方新诺明;13.卡那霉素
2.8 防治措施及效果
就诊当天,让养殖户回去后将患病山羊隔离,用牛羊鹿流感咳喘注射液(成分为林可霉素和链霉素)肌注治疗,次日根据药敏试验结果改用头孢噻呋钠肌注治疗,按体质量每公斤10 mg,1次/d,连续5 d。对其余未发病山羊用头孢噻呋钠肌注预防,1次/d,连续2 d;同时全群山羊用麻杏石甘散(成分为麻黄30 g、苦杏仁30 g、石膏150 g、甘草30 g)拌料,每只羊30~60 g,连喂5 d。每天清扫、消毒1次羊圈和运动场,连续消毒5 d。2021年12月10日下午回访得知羊群未再发病,病羊已治愈。
3 讨 论
目前,羊的呼吸系统疾病已成为严重危害养羊业健康发展的一类疾病,其病原组成复杂,可由细菌、病毒、真菌、支原体、寄生虫等的一种或几种引起[13]。本研究从病羊肺脏组织中分离的细菌经纯化培养、选择性培养基培养、革兰氏染色镜检、16S rRNA基因序列比对、致病性测定和ExPEC标记基因检测,可以确定该菌为肠外致病型大肠杆菌。药敏试验结果表明,该菌株有较严重的耐药现象,耐药谱较广,只对头孢曲松、恩诺沙星、阿米卡星和氟苯尼考表现中度敏感。建议临床上在使用抗菌药之前尽可能对病原菌进行药敏试验,然后选择敏感药物进行治疗,以提高治疗效果。
大肠杆菌是条件性致病菌,饲养管理措施不当(如环境条件差、转群应激、断奶应激、突然变换饲料、气候突变等原因)容易诱发大肠杆菌病的发生。本次发病可能与冬季气温低、未做好保温工作有关。
ExPEC感染难以通过病史调查、临床症状观察和病理剖检进行确诊。病原分离鉴定是确诊ExPEC感染的可靠方法。但也要注意,不能单纯依赖细菌16S rRNA基因测序来进行细菌鉴定,还要综合考虑其他鉴定方法的鉴定结果,方能得出正确结论。例如,本病例中,分离菌的16S rRNA基因序列与沙门氏菌Salmonellasp.S13(CP047094.1)、志贺氏菌Shigellaboydiistrain FBD007(EU009178.1)的相似度为99.73%,高于与大肠杆菌的相似度(99.6%),但综合考虑在选择性培养基上的菌落特点,将该分离菌最终鉴定为大肠杆菌。需要指出的是,如果遇到用16S rRNA基因测序和选择性培养基培养等常规方法均无法有效鉴别时,还可以考虑用PCR法扩增相应菌的特异性基因进行鉴别。虽然本研究只进行了细菌分离,未进行支原体和病毒的检测,但从采用头孢噻呋钠和麻杏石甘散治疗就控制了本病的治疗结果看,ExPEC可能是引起羊群本次发病的唯一病原。本病例中肺部病变区域与正常区域分界清晰,病变部位呈暗红色肝变,面积较大,位于肺的上半部。这一病变特点与郭强强等[8]在绵羊上观察到的ExPEC引起的肺炎病变十分相似,但后者在肝变区域还散在灰白色斑块状病灶。肺部的上述病变能否作为ExPEC性肺炎的特征病变还有待通过更多的病例观察进行判断。
本次疫情中,发病山羊病程较短,大多发病 2~3 d后即死亡,这也说明本次疫情中引起发病的ExPEC具有很强的致病力。ExPEC通过其特有的毒力因子侵袭、定植于肠外组织并引起感染。已发现ExPEC具有多种不同功能的毒力基因,例如黏附素相关基因(fimH、sfaS、tsh、papA、papC、afa、focD、focG、iha、bmaE、nfaE和gafD)、游离铁摄取相关基因(iutA、iron、iucD和ireA)、荚膜多糖相关基因(kpsMTⅡ)、外膜蛋白相关基因(ompA、ompT、traT和iss)、毒力岛相关基因(irp1、fyuA、irp2、ler和malX)、毒素相关基因(hylA、hlyD、vat、cnf1、cvaC和ibeA)[14-16]。本研究对ExPEC 32个毒力基因检测结果表明该菌株携带毒力基因iutA、afa、tsh、ompA、fimH、gafD、iucD、traT。
铁是所有生物体正常代谢和生长的基本元素,细菌需要10-7~10-5mol/L浓度的铁才能正常生长和分裂;然而,宿主系统的游离铁浓度非常低,例如人类血清中游离铁浓度估计为10-24mol/L。ExPEC主要通过两种方式获得宿主的铁元素:一种方式是产生溶血素使红细胞破裂释放出血红蛋白,然后直接夺取血红素中的铁元素;另一种方式是产生铁载体,通过铁载体与宿主转铁蛋白和乳铁蛋白竞争摄取铁元素。本研究分离的ExPEC没有溶血作用,这与周磊[1]分离到的54株猪源ExPEC没有溶血作用一致。另外,Zhu 等[17]分离的猪源ExPEC大部分(92.3%)不溶血,只有一小部分(7.7%)产生β溶血;Costa 等[18]分离的猪源ExPEC同样只有一小部分(4.9%)分离株产生β溶血,绝大部分(95.1%)的分离株不溶血;但王显峰等[19]从有呼吸困难、流鼻涕症状的病羊鼻腔拭子中分离到的ExPEC有β溶血作用。这些结果说明虽然溶血作用可产生充足的铁离子供ExPEC生长,但溶血作用并不是ExPEC致病作用所必需的。有溶血作用的ExPEC致病性也不一定强于没有溶血作用的ExPEC。没有溶血作用的ExPEC可以通过产生铁载体从宿主获得生长所需的铁。大肠杆菌的铁载体包括气杆菌素和肠杆菌素两种类型。不同于肠杆菌素,气杆菌素能循环利用,因此其运载铁的效率更高,这一特点有利于增强ExPEC的致病力,促进ExPEC的持续感染和在深部组织中的感染[20]。气杆菌素由5个基因编码,其中4个基因(iucA、iucB、iucC和iucD)参与气杆菌素的合成,1个基因(iutA)编码膜受体,它们均受一个操纵子控制[21]。本研究分离到的ExPEC携带有iutA基因和iucD基因,说明该菌能表达气杆菌素作为铁载体从宿主获取铁,从而佐证了该菌具有较强的致病力。
黏附是ExPEC感染的关键一步。ExPEC通过黏附素与组织上皮细胞结合,从而进入肠外组织,并引起肠外组织感染。黏附素可以是菌毛,也可以是非菌毛。菌毛黏附素包括Ⅰ型菌毛(FimH)、S 菌毛(Sfa)等;非菌毛黏附素包括温度敏感血凝素(tsh)、非菌毛黏附物质(Afa)等[22-23]。afa基因编码定植于上皮细胞(如尿道上皮和肠上皮细胞)的黏附蛋白,因此在引起尿道和肠道感染的致病性E.coli中广泛存在。但在其他部位的ExPEC中afa基因表达并不普遍。例如,马增军等[24]从病猪肝、脾、肺、肾中分离到的8株ExPEC中均未检出afa基因。郭强强等[25]从绵羊肺中分离的10株ExPEC中,仅有1株携带afa基因。本研究分离的ExPEC携带丰富的黏附相关基因,既包含I型菌毛基因(fimH),也包含非菌毛黏附素基因(afa、tsh和gafD)。该菌携带如此多的黏附相关基因,可能与其定植在肠外组织发挥致病作用有密切关系。
该菌还表达外膜蛋白OmpA和TraT。OmpA普遍存在于革兰氏阴性菌表面,发挥多种功能,如黏附、毒性、侵袭性和生物膜形成[26]。TraT是一种菌体外膜脂蛋白,与菌体的补体抗性和致病力关系密切[27]。该菌同时具有这两种外膜蛋白,可能与其较强的致病力有一定关系。
本研究共检测ExPEC 32种毒力基因,结果检测到分离菌携带8种毒力基因(iutA、afa、tsh、ompA、fimH、gafD、iucD、traT)。Johnson等[28-29]认为ExPEC中5个毒力标记基因(PapA/Papc,sfa/foc,afa/dra,iutA和 kpsMTⅡ)中至少存在2个,即可认定为ExPEC。因此,根据这一标准,本研究中分离到的大肠杆菌可被认定为ExPEC。并且,该菌具有多种类型的毒力因子,致使其具有较强的致病性。
4 结 论
本研究从安徽金丰源畜牧科技有限公司动物疾病诊断实验室接诊的某山羊养殖场的病羊肺脏组织中分离并鉴定了1株ExPEC,该菌属于B1群,没有溶血作用,对小鼠的致死率为80%,携带8个毒力基因(iutA、afa、tsh、ompA、fimH、gafD、iucD、traT)。该菌对头孢曲松、恩诺沙星、阿米卡星和氟苯尼考表现中度敏感,对其他9种抗菌药耐药。对发病山羊肌注头孢噻呋钠,同时使用麻杏石甘散拌料饲喂,用药后病情得到有效控制。本研究结果可为临床诊断和治疗山羊ExPEC引起的肺炎提供参考。
