油菜(Brassica napus)β-1,4-木糖基转移酶基因 BnIRX14克隆、序列分析及亚细胞定位
2023-02-15吴旺泽靳丰蔚刘婷婷徐一涌杨晓明
董 云,吴旺泽,靳丰蔚,方 彦,刘婷婷,王 毅,徐一涌,杨晓明
(1.甘肃省农业科学院 作物研究所,兰州 730070;2.西北师范大学 生命科学学院,兰州 730070;3.甘肃农业大学,省部共建干旱生境作物学国家重点实验室,兰州 730070)
糖基转移酶(Glycosyltransferase,GTs)广泛存在于原核生物、真核生物、古细菌及病毒中,具有催化蛋白质、糖类、脂质、激素、黄酮等物质进行糖基化的功能。通过糖基化反应能使特定的糖基集团从一些供体转移到靶受体形成糖苷等次生代谢物[1-3]。另外,糖基转移酶还能催化各类糖转变为各种受体分子,改变受体分子的稳定性,水溶性以及受体分子的生物活性和转运能力,从而介导植物生长发育、次生物质代谢、生物及非生物胁迫响应[4-7]。在植物体内,免疫相关复合物如水杨酸、酚类化合物、硫配糖体等三萜类化合物合成的最后修饰步骤就是糖基化过程[8]。通过全基因组数据分析,发现真核生物基因组里大概有1%的基因编码糖基转移酶。
目前,根据GT序列的相似度以及催化底物的特异性和催化产物的立体化学结构,在碳水化合物活性酶数据库CAZy(carbohydrate-active enzyme database)中,已经发现114个糖基转移酶家族(GT1~GT114),其中GT1家族包含最多的家族成员[9]。NDP-戊糖和NDP-己糖是糖基转移酶GT1家族大多成员的反应底物,其中UDP-糖基转移酶(UGTs)是催化UDP-糖的糖基转移酶。在模式植物拟南芥中已经发现350多个糖基转移酶基因[10],在芸薹属物种甘蓝型油菜(Brassicanapus)、甘蓝(Brassicaoleracea)和白菜(Brassicarapa)中已经分别鉴定251、154、140个UDP-糖基转移酶基因[11],这些糖基转移酶主要参与次生代谢物质的合成、生物和非生物胁迫[12]。例如UGT73B3和UGT73B5在拟南芥中通过关联茉莉酸和水杨酸来响应假单胞菌侵染[13],拟南芥UGT85U1/2和UGT85V1能通过改变吲哚衍生物参与盐与活性氧胁迫抗性[14]。UGT84F1被发现在甘蓝型油菜中通过抑制芥子酸来响应非生物胁迫[15]。蔡明亮等[16]从贵州地方稻种平塘黑糯(O.sativassp.japonica)低温转录组文库中,筛选到一个响应低温的糖基转移酶基因OsCUGT1,初步的表达分析认为该基因能被低温诱导,与日本晴(O.sativassp.nipponbare)栽培种相比,OsCUGT1序列具有丰富的SNP多态性。中药材植物中,像黄酮类化合物、咖啡酸及其衍生物等次生代谢物,对药性及药材道地性极其重要,在这些次生代谢物的合成过程中,糖基转移酶具有重要的作用[17]。例如在新疆紫草咖啡酸及其衍生物合成过程中,UDP-葡萄糖基转移酶(UDP-glycosyltransferases,UGTs)调节的苯丙烷途径发挥了重要作用[18]。黄酮类化合物是三七重要的药性成分,重组蛋白试验发现三七糖基转移酶PnUGT82在体外能催化黄酮7-O糖苷化产物的合成[19]。这些证据充分证明,糖基转移酶在植物生长发育,尤其是生物、非生物胁迫中具有重要功能。因此深入了解油菜中糖基转移酶的生物学功能,通过遗传学和生物技术等手段提高油菜品质和逆境抗性具有重要的理论意义和应用价值。
油菜是中国重要的油料作物之一,同时也是发展生物能源的优良经济作物[20]。油菜生长发育过程中经常受到高温、干旱、冻害、病害、虫害等逆境的影响,造成油菜产量和品质严重下降[21-22]。鉴定,挖掘抗逆相关的基因和QTL(quantitative trait locus,QTL),是分子标记辅助选育高抗油菜新品种的先决条件。但与传统模式植物拟南芥和水稻等相比,在油菜中与品质和抗逆相关的基因功能研究相对落后。本研究利用 5′RACE和3′RACE技术从甘蓝型油菜(BrasssicanapusL.)中扩增了β-1,4-木糖基转移酶基因IRX14(IrregularX-ylem14)的5′端和3′端序列,拼接后获得该基因的全长cDNA序列(NCBI登记号KP100641,命名为BnIRX14),对其全序列进行生物信息学分析,并通过构建融合表达载体pCAMBIA-1300-IRX14-GFP,利用烟草瞬时表达系统进行BiFC亚细胞定位,为将来进一步研究β-1,4-木糖基转移酶基因BnIRX14在油菜次生物质代谢及逆境响应中的生物学功能奠定理论基础。
1 材料与方法
1.1 材 料
1.1.1 植物材料 参试油菜为甘蓝型(BrassicanapusL.)栽培品种‘Westar’,烟草为本氏烟草(Nicotianabenthamiana)。
1.1.2 菌株和载体 农杆菌GV3101、大肠杆菌(Escherichiacoli)感受态细胞DH5α、植物表达载体pCAMBIA1300-GFP、克隆载体pMD18-T Cloning Vector购自陕西博瑞德生物科技公司。
1.1.3 酶、试剂盒和主要的化学试剂 PCR聚合酶KOD FX Neo、胶回收试剂盒(OMEGA)、限制性内切酶KpnⅠ、HindⅢ、XbaⅠ,T4DNA Ligase购自陕西博瑞德生物科技公司; 5′RACE System for Rapid Amplification of cDNA Ends Version 2.0试剂盒和Trizol均购自Invitrogen公司;SMARTerRMRACE cDNA Amplification Kit试剂盒购自Clontech公司。
1.2 方 法
1.2.1 油菜总RNA的提取 油菜总RNA采用Trizol法提取,提取方法参考其说明书。
1.2.2 油菜β-1,4-木糖基转移酶基因BnIRX14克隆 根据NCBI中已登记的甘蓝型油菜β-1,4-木糖基转移酶基因保守区序列(http://www.ncbi.nlm.nih.gov/nuccore/AJ971041.1),设计 5′RACE和3′RACE引物,引物由上海生物工程公司合成,相关引物序列见表1。以总RNA为模板,使用5′RACE System for Rapid Amplification of cDNA Ends Version 2.0试剂盒和SMARTer′ RACE cDNA Amplification Kit试剂盒分别进行5′端序列和3′端序列扩增,反转录及RACE扩增均参照试剂盒说明进行。将5′RACE和3′RACE第2轮PCR产物分别进行电泳,对目的片段的回收、连接、转化[23],挑取阳性克隆送上海生物工程公司测序。利用VectorNTI软件拼接5′RACE和3′RACE扩增获得的5′端、3′端片段序列和原来的保守区序列。

表1 5′ RACE和3′ RACE引物序列
1.2.3 油菜β-1,4-木糖基转移酶基因BnIRX14生物信息学分析 利用ExPASy Proteomics Sever(http://expasy.org/)预测 BnIRX14氨基酸序列分子量和等电点[24]。利用NCBI中的Concserved Domain,NetNGlyc 1.0 Server,NetPhos 3.1 Server,SignalP-5.0 Server,TMHMM Server v.2.0,SWISS-MODEL,STRING分别进行BnIRX14蛋白保守性、糖基化位点、磷酸化位点、蛋白信号肽、跨膜结构、蛋白质三级结构和互作蛋白的预测;利用DNAMAN软件同源比对芸薹属物种IRX14氨基酸序列。
1.2.4 油菜β-1,4-木糖基转移酶基因BnIRX14融合表达载体构建 通过Vector NTI软件查找拼接后基因全长的开放阅读框,在起始密码子和终止密码子附近设计开放阅读框的上下游引物P485F、P485R。因克隆的基因序列较长,为保证克隆的片段无突变,在序列中间设计引物P485MR、P485MF,分别与上下游引物配对进行PCR扩增,引物序列见表2。PCR反应体系:模板cDNA 1 μL,KOD FX Neo(1U/μL)1 μL,2× PCR Buffer for KOD FX Neo 25 μL,5′ primer(10 μmol/L)2 μL,3′ primer(10 μmol/L)2 μL,dNTP(2 mmol/L)10 μL,ddH2O 9 μL。PCR反应条件:98 ℃预变性5 min;循环为98 ℃变性10 s,60 ℃退火30 s,68 ℃延伸1 min 30 s,共30个循环;68 ℃延伸5 min。参照胶回收试剂盒(OMEGA)、克隆载体pMD18-T的使用说明书回收目的片段,并分别与pMD18-T载体连接。按照董云等[25]的方法进行连接产物的转化、质粒抽提,使用KpnⅠ和HindⅢ,HindⅢ和XbaⅠ进行双酶切鉴定,双酶切体系:10×BamHⅠ Buffer 4 μL,质粒DNA 2 μL,KpnⅠ或XbaⅠ(10 U/μL)1 μL,HindⅢ(10 U/μL)1 μL,ddH2O 12 μL。分别用KpnⅠ和HindⅢ,HindⅢ和XbaⅠ,KpnⅠ和XbaⅠ将鉴定正确的重组质粒和植物表达载体pCAMBIA1300-GFP质粒进行双酶切,经琼脂糖凝胶电泳检测后进行胶回收及纯化(方法同前)。对胶回收的目的基因两个片段及载体pCAMBIA1300-GFP大片段进行体外连接(图1)、转化大肠杆菌DH5α感受态细胞,在含Kan的LB固体培养基中培养;再将转化出来的单菌落通过摇菌后用485MF/485R进行菌液PCR鉴定,PCR鉴定正确的菌液送测序并保存菌液。

表2 克隆的相关引物序列

图1 融合表达载体pCAMBIA1300-IRX14-GFP构建
1.2.5 油菜β-1,4-木糖基转移酶BnIRX14亚细胞定位
参照郝丽芬等[26]的方法,构建的融合表达载体pCAMBIA1300-IRX14-GFP导入农杆菌GV3101,并瞬时转染本氏烟草叶片,侵染2~3 d后切取侵染区域,在FV10-ASW激光共聚焦显微镜(OLYMPUS)观察亚细胞定位。
2 结果与分析
2.1 油菜β-1,4-木糖基转移酶基因 BnIRX14 克隆
根据NCBI中已登记的甘蓝型油菜β-1,4-木糖基转移酶基因AJ971041.1保守区序列,设计5′RACE引物和3′RACE引物,使用5′RACE和3′RACE试剂盒分别扩增获得223 bp和781 bp的β-1,4-木糖基转移酶基因BnIRX145′端片段(图2-A)和3′端片段(图2-B)。对β-1,4-木糖基转移酶基因BnIRX145′ 端和3′ 端的目的条带分别进行切胶回收、纯化,纯化后的PCR产物分别与pMD18-T连接,转化大肠杆菌后挑取阳性克隆测序,测序结果见图2-C和2-D。测序正确后,利用 VectorNTI 软件将克隆获得的BnIRX14基因 5′ 端序列和3′ 端序列与保守区序列拼接,拼接后测序表明,油菜BnIRX14含有 1 566 bp 的完整开放阅读框,编码522个氨基酸,该基因命名为BnIRX14(NCBI登记号KP100641)。

A.5′端扩增片段;B.3′端扩增片段;C.5′端测序结果;D.3′端测序结果
2.2 油菜β-1,4-木糖基转移酶基因 IRX14生物信息学分析
利用测序氨基酸序列,同源比对芸薹属基因IRX14编码的氨基酸序列,发现与甘蓝型油菜(BnaA07T0142000ZS)、白菜(Bra012145)、芥菜型油菜(BjuA011746)、甘蓝(BolC07g023520.2J)和黑芥(BniB06g014750.2N)IRX14具有高度的相似性,相似性分别为 82.57%、81.78%、81.34%、72.25% 和 75.61%,与同科的拟南芥IRX14相似性为 74%。保守域结构比对发现,油菜BnIRX14具有 GTs 家族保守的 DxD 保守结构域(x表示除脯氨酸以外的任何氨基酸,或者没有x)。BnIRX14还存在 UGT 糖基转移酶一段由 44个 氨基酸组成的 PSPG(plant secondary product glycosyltransferase box)保守结构域(图3)。在 ExPASy 预测,BnIRX14分子质量约 58.92 ku,由 8 315 个原子组成,分子式为 C2631H4168N742O753S21。正电荷残基总数(精氨酸,赖氨酸)为 68,负电荷残基总数(天冬氨酸,谷氨酸)为 53。脂肪指数为 31.14,亲水性为-0.360,蛋白质不稳定指数为53.98,因此推测该蛋白属于不稳定亲水蛋白,属于糖基转移酶GT43家族成员(图4-A)。
利用 Net NGlyc 1.0 Server 和 NetPhos 3.1 Server 预测油菜BnIRX14糖基化和磷酸化位点发现,BnIRX14蛋白中存在3个糖基化位点(96、192和314)(图4-B),多个磷酸化位点,从多到少依次为丝氨酸,苏氨酸和酪氨酸,也存在糖原合成酶激酶3(GSK3)、细胞分裂周期激酶2(CDC2)、蛋白激酶(PKC)、络蛋白激酶Ⅱ(CKⅡ)、蛋白激酶A(PKA)、细胞周期蛋白依赖性激酶抑制因子(CKI)等多种特异性蛋白激酶结合位点(图4-C),跨膜域预测表明,BnIRX14具有一个单次跨膜区,为膜蛋白(图4-D),不存在信号肽,属非分泌性蛋白(图4-E)。对 BnIRX14 蛋白结构进行预测分析,结果表明该蛋白二级结构中α螺旋结构(α-Helix)占29.17%,β片层(β-strand)占 5.95%,无规则卷曲(Randomcoil)占46.45%,延伸链占 18.43%。蛋白三级结构源建模使用的模板为人类 β-1,1-葡萄糖糖基转移酶,其同源性为 29.09%(图5-A)。以白菜基蛋白质数据库作为参考,预测分析 BnIRX14 蛋白与其他蛋白的相互作用,发现 BnIRX14 与白菜 Bra019618.1(拟南芥GUT1同源基因,催化葡糖醛酸基转移酶)互作分数最高为 0.997;其次与白菜Bra039502.1(蔗糖裂解酶,为各种代谢提供UDP-葡萄糖和果糖)互作,参与生物催化反应;与 Bra037432.1,Bra036282.1 和 Bra006644.1等互作分数都达到 0.875 以上。这些预测的互作蛋白都与各类糖合成和转运有关。同源比对和互作分析初步表明 BnIRX14 可能参与木糖的合成代谢过程(图5-B)。
2.3 油菜β-1,4-木糖基转移酶基因 BrIRX14融合表达载体构建
根据BnIRX14基因拼接序列设计的上下游引物P485F、P485R与序列中间设计的引物P485MR、P485MF分别配对,以油菜cDNA为模板进行PCR扩增。P485F/P485MR和P485MF/P485RPCR产物分别为727 bp和853 bp(图6-A),胶回收PCR扩增片段,分别与pMD18-T载体连接,经菌液PCR检测后选取阳性克隆,分别使用KpnⅠ和HindⅢ,HindⅢ和XbaⅠ进行双酶切鉴定,切下的目的条带分别为718 bp和845 bp(图6-B),送交测序验证。测序验证后用KpnⅠ和HindⅢ,HindⅢ和XbaⅠ进行双酶切测序质粒载体,分别回收718 bp和845 bp的片段。同时用KpnⅠ和XbaⅠ双酶切pCAMBIA1300-GFP质粒,胶回收、纯化大片段,与回收的IRX14基因718 bp和845 bp的两段双酶切序列片段进行体外连接,随后转化到大肠杆菌感受态细胞中,用P485MF/P485R进行菌液PCR鉴定,阳性克隆测序验证正确(图6-C)。

图6 融合表达载体 pCAMBIA1300-IRX14-GFP构建及阳性克隆PCR鉴定
2.4 油菜β-1,4-木糖基转移酶IRX14亚细胞 定位
将构建的融合表达载体pCAMBIA1300-IRX14-GFP和空载体pCAMBIA1300-GFP分别转化农杆菌GV3101,将活化的农杆菌注射烟草叶片,22 ℃黑暗条件下保湿培养2 d后利用激光共聚焦显微镜观察绿色荧光蛋白的分布情况。由图7可见,pCAMBIA1300-IRX14-GFP的荧光信号主要分布在细胞质中,而对照pCAMBIA1300-GFP在细胞核和细胞质中均观察到绿色荧光信号,BiFC结果表明β-1,4-木糖基转移酶BnIRX14定位于细胞质。
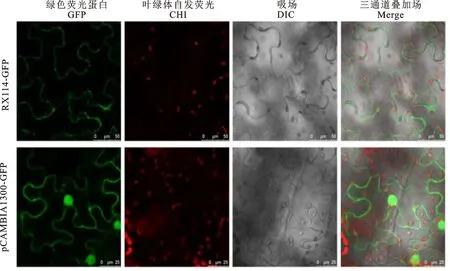
图7 甘蓝型油菜β-1,4-木糖基转移酶BnIRX14亚细胞定位
3 讨 论
干旱、盐害、极端温度、病虫害等非生物和生物胁迫严重影响油菜生长发育和油菜品质,提高油菜逆境抗性,保持稳产优质是当前油菜生产亟待解决的问题。筛选、鉴定与油菜抗逆相关的基因和QTL,揭示其逆境响应分子机制,对培育抗逆性油菜新品种具有重要的经济意义[27-28]。拟南芥IRX9(At2g37090)、I9H(At1g27600)、IRX14(At4g36890)、I14H(At5g67230)属于糖基转移酶GT43家族成员,I9H和I14H在植物组织各器官均有表达,IRX9和IRX14主要在花序和茎中表达。IRX9和IRX14在拟南芥木糖合成中扮演着重要的角色,IRX9和IRX14功能缺失型突变体导致木糖含量降低,生长发育异常[29]。棉花中,GhGT43A1 和GhGT43C1 属于糖基转移酶GT43家族蛋白,与拟南芥IRX9 和IRX14紧密相关,它们参与棉花纤维发育中木糖的合成,GhGT43A1主要在开花后15~20 d的棉纤维中高效表达,但是GhGT43C1却在根茎叶等中广谱表达[30]。这些结果表明,虽然糖基转移酶GT43家族成员进化高度保守,但也具有生物功能多样性。糖基转移酶不仅与植物逆境胁迫响应相关,同时还参与植物体内防御复合物的糖基化修饰,改善其生物活性和溶解度来增强植物抗逆性,因此糖基转移酶已成为近年的研究热点。高世超等[31]、周佩娜等[32]分别从青花菜、霍山石斛中克隆得到β-1,4-木糖基转移酶基因IRX9H、IRX9,生物信息学分析表明IRX9H、IRX9基因编码蛋白均为无信号肽蛋白,并对β-1,4-木糖基转移酶基因IRX9H研究表明在青花菜抗酸雨胁迫中发挥作用。
本研究通过同源搜索比较,利用RACE技术从甘蓝型油菜中克隆到β-1,4-木糖基转移酶基因BnIRX14(NCBI登记号KP100641)。BnIRX14基因具有1 566 bp的完整开放阅读框,编码522氨基酸,其编码的蛋白质无信号肽存在。保守域结构预测,BnIRX14具有UGT糖基转移酶PSPG保守结构域,并具有GTs家族保守的DxD结构域。大多数含有GT-A折叠的GTs家族蛋白都存在DxD保守结构域,是糖基转移酶催化活性的重要结构域,二价阳离子可以与该结构域配位,以稳定结合核苷酸糖[33]。进化树统计分析,BnIRX14与十字花科芸薹属物种白菜、芥菜型油菜、甘蓝和黑芥IRX14相似性达到72% 以上,说明本研究通过RACE技术克隆的甘蓝型油菜BnIRX14属于糖基转移酶GT43家族成员。拟南芥I9H(IRX9同源基因)和IR14H(IRX14同源基因)TMHMM预测具有单次跨膜结构域,构建YFP标签的亚细胞准确定位表明 I9H和IR14H定位在高尔基体中[29];霍山石斛GT43家族成员IRX9 TMHMM预测也具有单次跨膜结构域,PSORT的亚细胞定位发现霍山石斛IRX9定位于微粒体分值最高[31]。BnIRX14 TMHMM预测也是单次跨膜蛋白,BnIRX14-GFP亚细胞定位表明,BnIRX14定位于细胞质中,但目前的BiFC试验还不能准确确定BnIRX14是否也定位于高尔基体中,后期需要通过细胞器特异荧光染料来确定BnIRX14的准确定位。蛋白结构域预测,BnIRX14具有单次跨膜结构域,该结果与前人研究结果一致[33]。糖基化和磷酸化位点是糖基转移酶生物学功能的重要催化活性位点,BnIRX14预测也发现多个糖基化和磷酸化位点,可能与其他催化葡糖醛酸基转移酶的蛋白相互作用调控木糖的合成,从而来调节生长发育和逆境响应。具体BnIRX14如何参与油菜的生长发育和逆境响应还需要深入的试验来证实。目前,通过RACE从油菜中克隆到情况BnIRX14,为深入研究BnIRX14的生物学功能奠定基础,为将来通过生物技术手段培育高抗的油菜品种提供理论和技术支持。
4 结 论
本研究利用5′RACE与3′RACE方法从甘蓝型油菜中扩增获得β-1,4-木糖基转移酶基因BnIRX14,该基因cDNA全长1 566 bp,编码522个氨基酸,具有多个糖基化和磷酸化位点。初步的BiFC结果表明BnIRX14定位在细胞质中,BnIRX14具有GTs家族基因典型的DxD特征结构域,属于油菜GT43糖基转移酶家族成员。
