槲皮素抗急性加重慢性阻塞性肺疾病作用机制的网络药理学与细胞实验研究*
2023-02-15许夏燕潘明月韩雨彤
许夏燕,李 智,潘明月,韩雨彤
(广东省深圳市罗湖区人民医院,广东 深圳 518000)
槲皮素(Quercetin)为黄酮类化合物,广泛存在于西红柿、三七、洋葱等多种日常蔬果中。有研究发现,槲皮素能明显抑制炎性介质的合成及软骨细胞凋亡,促进巨噬细胞向M2 型极化,对慢性骨关节炎具有较好的改善作用[1];槲皮素对非酒精性脂肪肝有良好的改善作用,机制可能与其抑制白细胞介素(IL)-1β、IL -6 和肿瘤坏死因子-α(TNF -α)等炎性因子的分泌,进而发挥抗炎作用有关[2],可知槲皮素具有较好的清除自由基及抗炎作用。但目前基于槲皮素与急性加重慢性阻塞性肺疾病(AECOPD)的网络药理学分析及实验验证较少,具体作用靶点与机制尚未明晰。在此,本研究中利用网络药理学方法对槲皮素作用靶点和AECOPD 疾病靶点取交集,进行富集分析,预测相关作用机制,随后通过细胞实验进一步验证槲皮素抗AECOPD 的作用机制。现报道如下。
1 资料与方法
1.1 网络药理学研究
槲皮素靶点筛选:以“槲皮素”“Quercetin”为关键词,检索Pharmmapper(http:// www.lilab -ecust.cn/pharmmapper/,Version 2017)、Ctdbase(http:// ctdbase.org/)、TargetNet(http:// targetnet.scbdd.com/ home/index/)等药物靶点数据库,预测槲皮素相关作用靶点;筛选,剔除重复靶点。同时,结合已发表的网络文献补充靶点。
AECOPD靶点预测:以“Acute exacerbation of chronic obstructive pulmonary disease”“AECOPD”等为关键词,检索GeneCards(https:// www.genecards.org/,Version 5.0)、Disgenet(https:// www.disgenet.org/,Version 7.0)等疾病靶点数据库,预测AECOPD 相关疾病靶点;筛选,剔除重复靶点。
槲皮素对AECOPD 潜在作用靶点预测:将获得的槲皮素药物靶点、AECOPD 疾病靶点导入OmicShare 基迪奥生物信息云平台进行交集比对、绘制韦恩图,获得槲皮素治疗AECOPD的潜在作用靶点。
蛋白相互作用(PPI)网络构建:将槲皮素治疗AECOPD 的潜在作用靶点导入String(https:// string -db.org/)数据库进行深入分析,项目选择“Multiple proteins”、种属选择“Homo sapiens”,以得分>0.4 为筛选条件,构建PPI 网络。将String 数据库获得的结果导入Cytoscape 软件,进行可视化操作与数据分析,利用其中Cytohubba 插件进行预测分析并评分,以Degree 值排序获得排名前50的核心基因,并以颜色区分(分值低为黄色,分值高为红色)。
富集分析:为进一步探究获得的交集靶点在生物功能和信号通路中的作用,对其进行基因本体论(GO)功能富集分析与京都基因与基因组百科全书(KEGG)通路富集分析。将靶点基因信息导入DAVID 6.8(https:// david.ncifcrf.gov/ home.jsp)数据库中,种属选择“Homo sapiens”;将结果导入Cytoscape 软件,进行可视化操作与数据分析。
分子对接验证:通过分子对接技术验证槲皮素与预测排名靠前的信号通路核心靶点蛋白的亲和力。对接过程包括:下载槲皮素mol2格式文件;下载靶点蛋白3D 结构,进行去水、去配体等前处理;导入Autodock 软件进行加氢前处理;导入PyMOL 软件进行分子对接,计算槲皮素与核心靶点蛋白结合能大小(<-5 kcal/mol提示结合活性较好);对结果行可视化分析。
1.2 细胞实验验证
1.2.1 材料
仪器:Odyssey 型双色红外荧光成像系统(美国Licor公司);Axio Observer3 型荧光显微镜(德国Zeiss 公司);DW-HL828 型-80 ℃低温冰箱(中科美菱低温科技有限责任公司);F3型微量移液器、FC型酶标仪、BB150型二氧化碳培养箱(赛默飞世尔科技<中国>有限公司);1658033型多功能电泳系统(美国Bio-Rad公司)。
试剂:DMEM 高糖培养基(美国Gibco 公司,批号为12677019);槲皮素(成都普瑞法科技开发有限公司,批号 为117 -39 -5);β -actin、磷脂酰肌醇3激酶(PI3K)、蛋白激酶B(Akt)、半胱氨酸蛋白水解酶-3(Caspase-3)和B 淋巴细胞瘤-2(Bcl-2)蛋白单克隆抗体(美国Cell Signaling Technology 公司,批号分别为3700,17366,4691,9662,3498);IL-6、IL-8 检测试剂盒(武汉基因美生物科技有限公司,批号分别为JYM0007Bo,JYM0143Go);胎牛血清、青/ 链霉素双抗、BCA试剂盒(赛默飞世尔科技<中国>有限公司,批号分别为10100147,15070063,23221);香烟(骆驼牌,每支含焦油10 mg,尼古丁0.8 mg)。
细胞:人支气管上皮BEAS-2B 细胞株(中国科学院上海生命科学研究院)。
1.2.2 方法
香烟提取物(CSE)制备:香烟去掉滤嘴后点燃,用50 mL 玻璃注射器收集香烟烟雾,导入20 mL 磷酸盐缓冲液(PBS)中,经0.22 μm 过滤器滤过,在320 nm 波长处测定吸光度,建立标准曲线并对滤出液浓度进行校准,将所制得的CSE溶液分装,-80 ℃冻存备用。
CSE 建模体积分数筛选:将BEAS-2B 细胞培养于完全培养基中(含10%胎牛血清,1%青/链霉素双抗),放入5%CO2,37 ℃细胞孵箱,待细胞融合至约50%时,将培养基更换为不含血清的高糖培养基饥饿培养12 h,再换为含不同体积分数(0,1%,2%,4%)CSE 溶液的无血清培养基继续孵育24 h,收集细胞上清液,按试剂盒说明书测定IL-6 和IL-8 的含量,以确定最佳CSE 建模体积分数。
分组:实验分为模型组(等体积无血清培养基)及槲皮素低、中、高剂量(1,3,10 μmol/L)组。将BEAS-2B细胞培养于完全培养基中,放入5% CO2、37 ℃细胞孵箱,待细胞融合至约50%时,各组分别以无血清培养基或含不同浓度槲皮素的无血清培养基培养12 h;维持药物浓度不变,以含最佳建模体积分数CSE 溶液的无血清培养基继续孵育24 h,收集细胞上清液。
PI3K,Akt,Caspase-3,Bcl-2蛋白水平检测:采用Western blot 法。各组BEAS -2B 细胞加入细胞裂解液提取总蛋白,以BCA 法检测蛋白浓度,加入上样缓冲液并于沸水水浴5 min 使蛋白变性;取适量蛋白样品经10%SDS-PAGE 分离,湿转法转移至PVDF 膜上,经封闭液封闭、一抗4 ℃孵育过夜、洗膜、二抗孵育、ECL 显色后,通过ImageJ2x软件分析蛋白表达水平。
1.3 统计学处理
采用SPSS 21.0 统计学软件分析。计量资料以表示,组间比较行单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 槲皮素对AECOPD 潜在作用靶点
共获得槲皮素潜在靶点854 个,AECOPD 相关疾病靶点1 176 个,取交集,得槲皮素对AECOPD 潜在作用靶点196个,见图1。
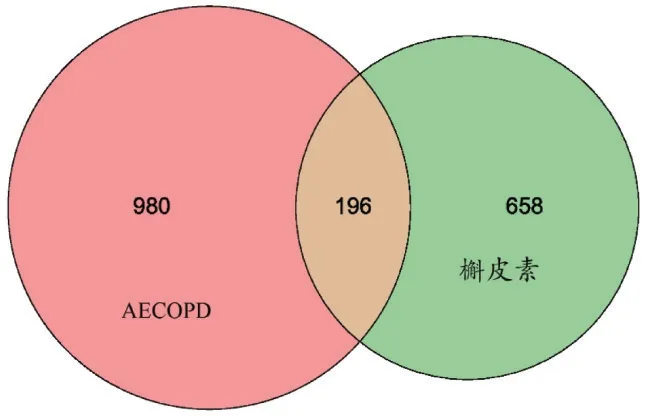
图1 槲皮素对AECOPD潜在作用靶点韦恩图Fig.1 Venn diagram of potential targets of the action of quercetin on AECOPD
2.2 槲皮素-AECOPD 交集靶点PPI 网络
槲皮素-AECOPD 交集靶点PPI 网络见图2。此PPI 网络节点数为196,边数为3 393,平均节点分数34.6,提示PPI网络连通性较好。

图2 槲皮素-AECOPD交集靶点PPI网络Fig.2 PPI network of the intersection targets of quercetin-AECOPD
2.3 槲皮素-AECOPD 关键靶点
关键靶点PPI网络见图3,包括TNF,MMP9,EGFR,CASP3,MAPK8,TRP53,MTOR,AKT1,SRC,PTGS2 等多种炎症、凋亡通路核心蛋白。

图3 槲皮素-AECOPD前50关键靶点PPI网络Fig.3 PPI network of the top 50 key targets of quercetin-AECOPD
2.4 GO 与KEGG 富集分析
槲皮素对AECOPD的治疗作用主要是通过调控凋亡过程、炎性反应、药物反应等生物过程;细胞表面、细胞质膜、膜阀等细胞组成;酶结合位点、蛋白酪氨酸激酶活性、蛋白结合位点等分子功能而实现的。详见图4 A,B,C。
共得到槲皮素-AECOPD 交集靶点KEGG 通路116 条,选取评分较高信号通路数据作图,排名前10 的信号通路包括癌症通路、PI3K/Akt信号通路、趋化因子信号通路、细胞凋亡、TNF信号通路等。详见图4 D。
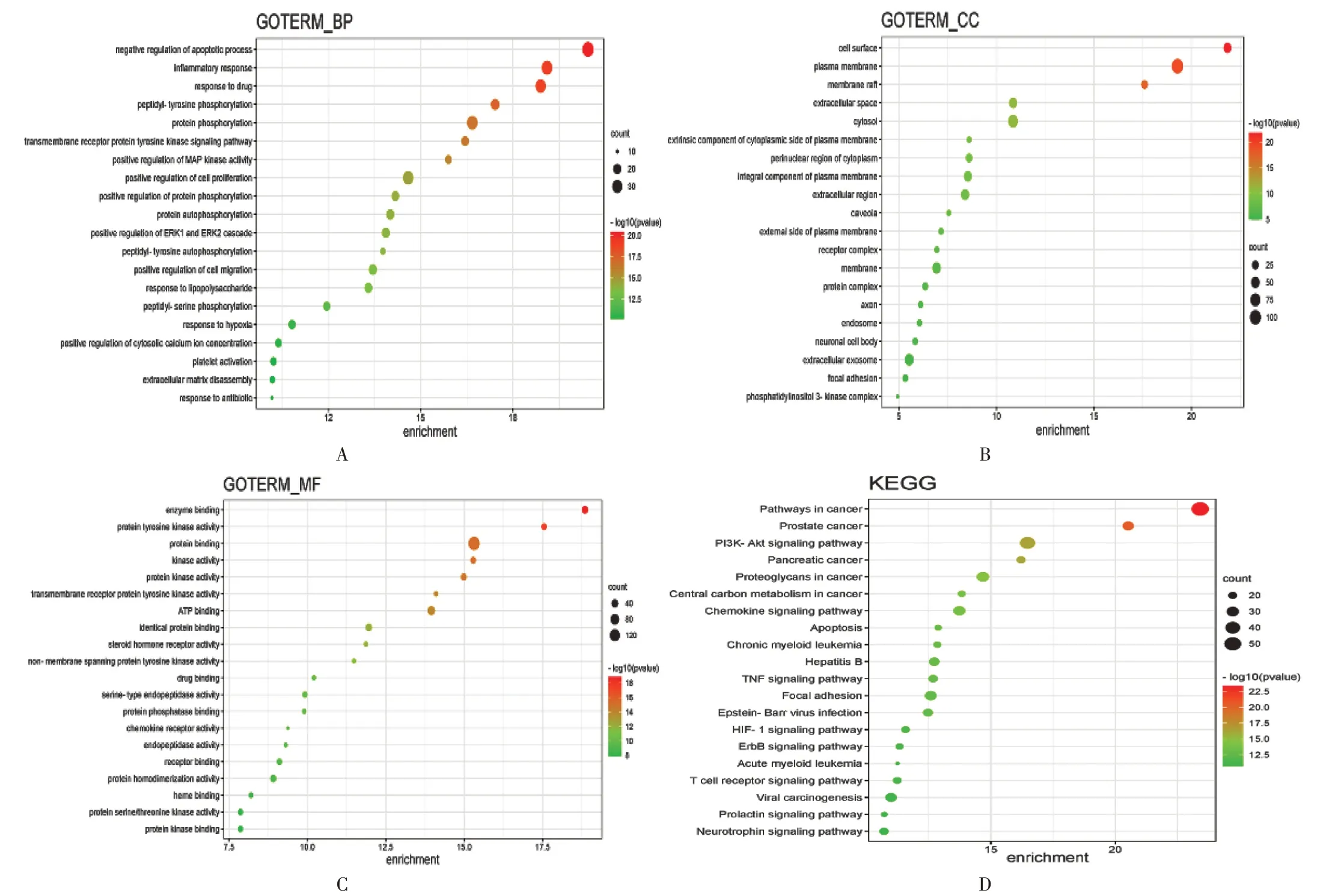
图4 槲皮素-AECOPD交集靶点GO与KEGG通路富集分析A.Biological process B.Cell composition C.Molecular function D.KEGG pathway enrichment analysisFig.4 GO and KEGG pathway enrichment analysis of intersection targets of quercetin-AECOPD
2.5 靶点-信号通路网络
将196个槲皮素-AECOPD交集靶点及排名前10的KEGG富集通路数据,导入Cytoscape软件,构建槲皮素-AECOPD 靶点-信号通路网络(见图5)。结果显示,槲皮素可通过PI3K/Akt 信号通路、细胞凋亡等机制发挥治疗AECOPD的作用。

图5 槲皮素-AECOPD交集靶点-信号通路网络Fig.5 Network of quercetin-AECOPD intersection target-signaling pathway
2.6 分子对接验证
槲皮素与其治疗AECOPD 的5 个核心靶点(PI3K,Akt,mTOR,Caspase -3 和Bcl -2)的结合能分别为-6.64,-6.68,-6.39,-6.06,-6.40 kcal/ mol,提示槲皮素与PI3K、Caspase -3 等PI3K/ Akt 信号通路、细胞凋亡通路核心蛋白具有较好的结合能力。见图6。
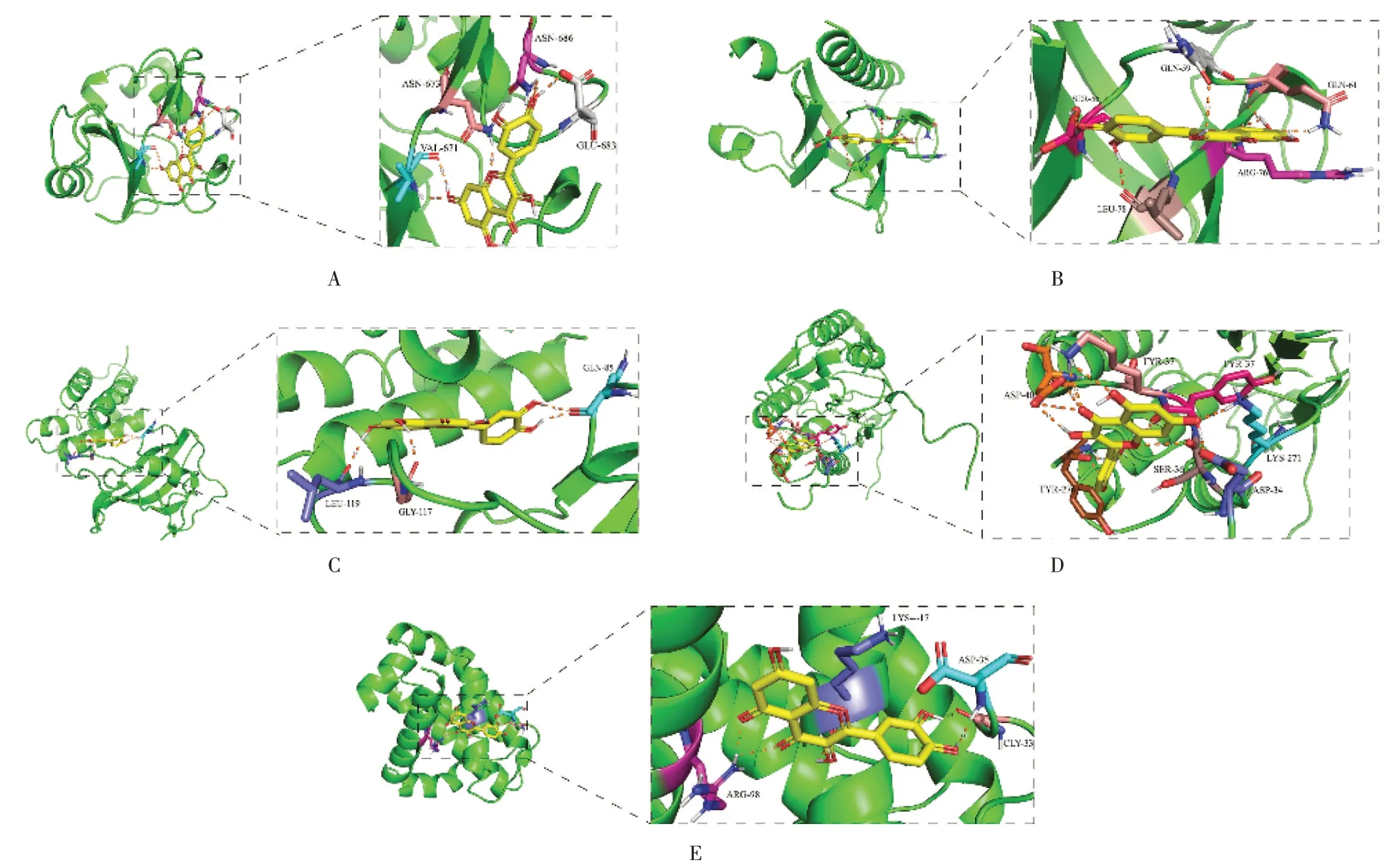
图6 槲皮素与核心靶点分子对接结果A.PI3K-quercetin B.Akt-quercetin C.mTOR-quercetin D.Caspase-3-quercetin E.Bcl-2-quercetinFig.6 Molecular docking results of quercetin and key targets
2.7 CSE 建模体积分数
结果见图7。可见,BEAS-2B细胞经含不同体积分数(0,1%,2%,4%)CSE 溶液的无血清培养基孵育24 h后,IL-6 和IL-8 的释放随着CSE 溶液体积分数的增大有所增加,其中,2% CSE 对IL -6 的作用效果较4%CSE 更稳定,且2%和4%CSE 促进IL-8 释放的作用略优于1%CSE。故本研究中采用2%CSE溶液建模。
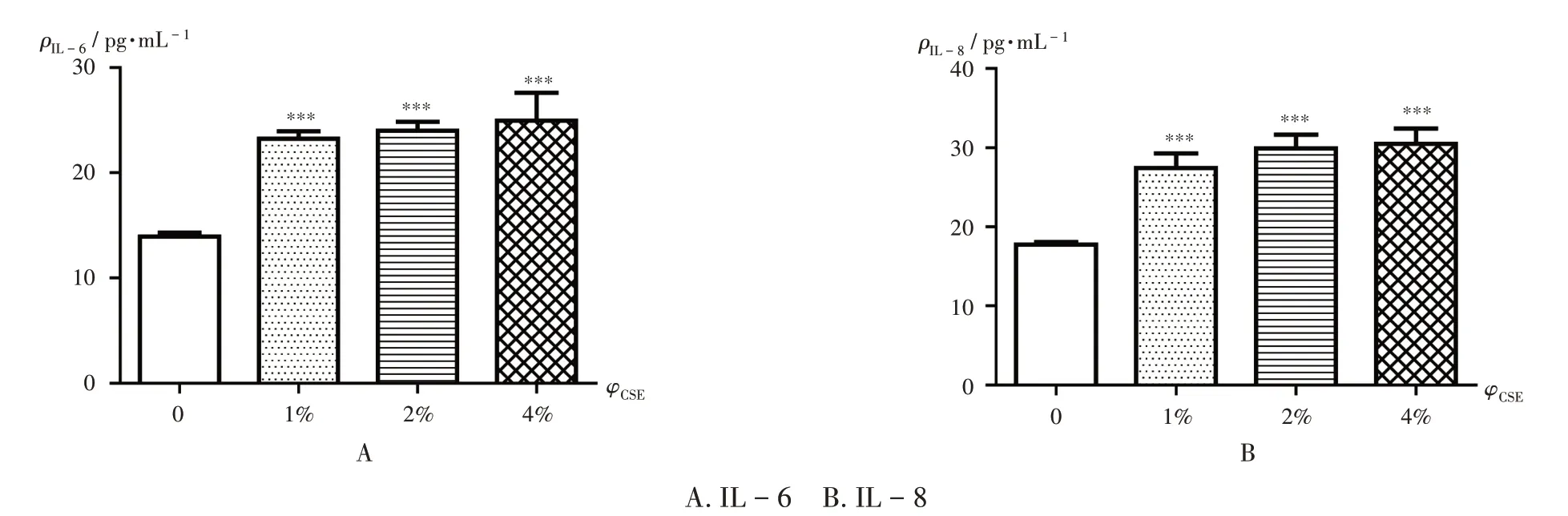
图7 不同体积分数CSE溶液对BEAS-2B细胞释放IL-6和IL-8的影响A.IL-6 B.IL-8Note:Compared with those at 0,***P <0.001.Fig.7 Effect of different volume fractions of CSE solution on the release of IL -6 and IL-8 in BEAS-2B cells
2.8 槲皮素对CSE 诱导BEAS-2B 细胞的影响
PI3K/Akt通路:与模型组比较,槲皮素中、高剂量组BEAS -2B 细胞中PI3K 蛋白表达水平显著降低(P<0.01),槲皮素高剂量组BEAS -2B 细胞中Akt 蛋白表达水平显著降低(P<0.01),提示槲皮素对CSE 诱导的BEAS -2B 细胞PI3K/ Akt 通路具有明显的抑制作用。详见图8 A,B。
细胞凋亡:与模型组比较,槲皮素高剂量组BEAS-2B细胞中Caspase-3 蛋白表达水平显著降低(P<0.01),槲皮素中、高剂量组BEAS-2B细胞中Bcl-2蛋白表达水平均显著降低(P<0.05),提示槲皮素对BEAS-2B细胞凋亡具有抑制作用。详见图8 C,D。
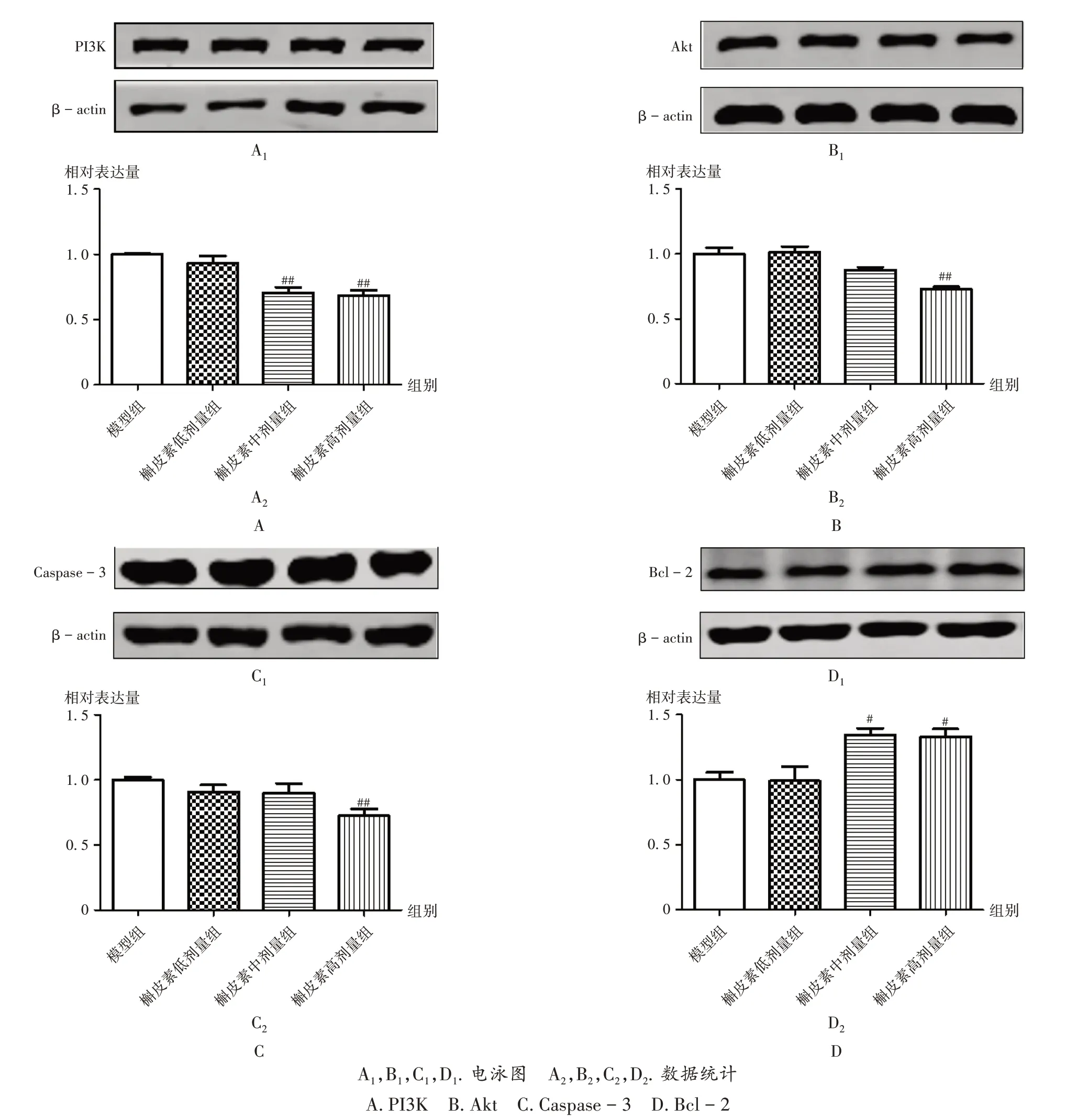
图8 槲皮素对CSE诱导的BEAS-2B细胞PI3K/Akt通路和细胞凋亡的影响A1,B1,C1,D1.Electrophoretogram A2,B2,C2,D2.Data statistics A.PI3K B.Akt C.Caspase-3 D.Bcl-2Note:Compared with those in the model group,#P <0.05,##P <0.01.Fig.8 Effect of quercetin on PI3K/Akt pathway and apoptosis of BEAS-2B cells induced by CSE
3 讨论
PI3K/Akt 信号通路通过调控下游多种靶蛋白,广泛参与细胞的生长和增殖、蛋白合成及能量代谢等重要生理过程[3]。PI3K 激活后与下游重要靶蛋白Akt 结合,Akt 由细胞质转移到细胞膜,发生磷酸化反应,进而促进各类炎性蛋白的合成,对AECOPD 的发生起重要作用[4]。烟雾颗粒能激活中性粒细胞内PI3K/Akt 通路并调控其迁移至肺部受伤或感染部位,引起炎性反应,进而诱发AECOPD[5]。而使用LY294002(PI3K/ Akt 信号通路特异性阻断剂)可明显减少慢性阻塞性肺疾病(COPD)模型中粒细胞的迁移及趋化过程,有效减少因炎症风暴导致的肺组织损害[6]。目前临床常用的COPD治疗药物如茶碱、吸入性糖皮质激素、长效β2受体激动剂等均可直接或间接作用于PI3K/ Akt 通路,发挥抗COPD 炎症作用[4]。本研究中通过生物信息数据挖掘发现槲皮素与AECOPD 排名前50 的关键靶点中包含PIK3ca,PIK3cb,Akt1,mTOR 等PI3K/ Akt 信号通路核心蛋白;KEGG通路富集分析也显示PI3K/Akt信号通路排名第2,具有较好的通路相关性;分子对接实验也证实,槲皮素与P13K,Akt,mTOR 等靶蛋白结合能力较好;细胞实验结果证实,槲皮素对AECOPD 体外细胞模型中的PI3K 与Akt 的蛋白表达均有明显的抑制作用。提示槲皮素治疗AECOPD的潜在机制与抑制PI3K/Akt通路的信号传导密切相关。
除PI3K/Akt 信号通路外,细胞凋亡也被发现很可能是槲皮素治疗AECOPD 的作用机制之一。细胞凋亡也称为细胞程序性死亡,其典型特征包括凋亡小体形成、细胞核固缩、脱氧核糖核酸(DNA)降解等,对维持器官与组织稳态有重要意义[7]。香烟烟雾引起的肺血管内皮细胞凋亡,是COPD 重要发病机制之一[8]。目前普遍认为,细胞凋亡程序的启动有内源性途径和外源性途径[9-10]。内源性途径的启动主要是与细胞内环境的紊乱(氧化损伤、内质网应激)有关。通过Caspase-9 与促凋亡蛋白等结合形成凋亡小体,诱导Caspase -3 活化导致凋亡发生。外源性途径的启动则与死亡配体与死亡受体的结合相关。死亡配体(TNF,Fas 等)、死亡受体及Caspase -8 相互结合形成死亡诱导信号复合物,启动Caspase-8/10,进而激活Caspase-3 引起细胞凋亡过程[9]。可见,无论是内、外源性途径均需Caspase-3参与,其在细胞凋亡过程中发挥核心作用;此外,Caspase -3 也是PI3K/ Akt 信号通路重要的下游靶蛋白之一,PI3K/ Akt 信号通路激活后,通过信号交互网络启动Caspase -3,调控细胞凋亡过程[11]。本研究中发现Caspase -3 是槲皮素与AECOPD 重要的交互靶点,相关性很高,Degree 值排名前10;Caspase -3 也是KEGG 通路分析排名前10 的PI3K/ Akt、趋化因子信号通路、细胞凋亡等多条信号通路的共同靶点;进一步的分子对接实验验证也显示槲皮素与Caspase -3具有良好的结合能力;细胞实验显示,槲皮素能显著抑制Caspase -3 蛋白表达,进而抑制细胞凋亡过程。以上结果提示,槲皮素对AECOPD 的防治作用与抑制细胞凋亡有关。
综上所述,本研究中通过网络药理学、分子对接实验及细胞实验证实槲皮素抗AECOPD作用与抑制PI3K/Akt 和细胞凋亡有关,为槲皮素的进一步开发和临床使用提供了研究思路和实验数据参考。
