金鲳鱼发酵菌株筛选及其生物学特性与风味形成评价
2023-02-14苏伟明胡梦杰沈会连林琰佳刘楚祺钟赛意
苏伟明,胡梦杰,沈会连,林琰佳,邓 旗,刘楚祺,钟赛意,刘 颖,
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东省海洋生物制品工程实验室,广东湛江 524088;2.海洋食品精深加工关键技术省部共建协同创新中心,大连工业大学,辽宁大连 116034)
金鲳鱼(Trachinotus ovatus)学名卵形鲳鯵,常生活于热带及温带海洋中,其肉质细腻、鲜甜、口感绵延,是一种深受消费者喜爱的海洋鱼类。近年来,随着深海网箱、海洋牧场等技术的不断推广与应用,金鲳鱼养殖产量逐年快速增加,成为南方沿海规模化生产的鱼类之一[1]。但同时由于过快地扩张,导致金鲳鱼市场供过于求,而且目前的市场销售以活鲜、冰鲜和冷冻鱼等产品为主[2],行业存在产品种类单一,高附加值深加工产品缺乏等问题,造成利润严重下滑,制约了金鲳鱼产业发展的空间。湛江乌石镇地处雷州半岛西南部,是广东省主要渔港之一,全镇以渔业为主,其中当地居民用传统盐制的发酵的方式,形成具有独特湛江风味的发酵金锠鱼,受到消费者喜爱。
发酵是一种经济而古老的食品加工与保存方法[3],通过微生物与食物成分的相互作用及微生物酶的降解作用,产生乳酸、酮类、醛类、醇、烯烃类等物质,赋予发酵产品独特的风味、口感与色泽[4-6],Narzary等[7]对18种发酵鱼产品的营养成分、风味、滋味、益生性及微生物的组成进行了报道,发现发酵鱼中微生物对其营养、风味有重要的影响,同时产生的抑菌物质又延长了产品的保质期。因此,开发以发酵金鲳鱼为代表的深加工产品有望成为解决滞销、行业低迷等问题的有效途径。但是,利用盐制或风干方法制备的传统发酵鱼中的微生物是来自于自然富集的,由于受到不同年份、不同季节温度与湿度的影响,参与发酵的微生物种群不确定,影响其产品质量的稳定性、保质期以及安全食用性[8]。因此,筛选具有良好特性的微生物进行人工接种,对提高与稳定产品质量,缩短发酵时间尤为重要。而用于接种发酵的微生物通常是从传统发酵产品中分离优质微生物这一策略获得[9],Shubham等[10]利用此策略从印度的发酵鱼中分离筛选到40株乳酸菌,并发现其中两株菌具有较好的应用特性。近年来,研究发现植物乳杆菌属、片球菌属、乳杆菌属等乳酸菌在鱼的发酵过程中起到了关键的作用[11-12]。另外,田国军等[13]成功地从自然发酵的腊鱼中分离到1株优质乳酸菌,并接种到新鲜的腊鱼中进行发酵,其产品的风味和质量均得到了明显的改善。Barbara等[14]发现,乳杆菌属用于鱼发酵香肠生产中,有效减少了发酵时间。总之,随着人工接种发酵技术的不断成熟,在食品发酵中使用发酵剂进行定向接种已成为提高加工速度和产品质量的重要手段[15]。
针对传统方法制备的发酵鱼微生物种群结构的不确定性,导致产品质量不稳定这一问题,本研究以广东湛江乌石镇传统方法制备的优质发酵金鲳鱼为材料,从中分离筛选出适合作为发酵剂的微生物菌种,并对分离菌株的生物学特性及其形成的风味进行评价,以期为实现定向接种,人工控制发酵生产提供依据。
1 材料与方法
1.1 材料与仪器
传统发酵金鲳鱼 新鲜优质,来自于广东湛江乌石镇,每条400 g左右;金黄色葡萄球菌(StaphylococcusaureusATCC29213)、大肠杆菌(Escherichia coliATCC35218) 均购自广东省微生物研究所;MRS肉汤、MRS培养基、营养肉汤(NB)、营养琼脂(NA) 青岛海博生物技术公司;Mighty Amp DNA Polymerase Ver.2 宝生物工程有限公司;16S rRNA细菌通用引物27F:5” -AGAGTTTGATCCTG GCTCAG-3” ,1492R:5” -GGTTACCTTGTTACGAC TT-3” 上海生工生物技术有限公司合成。
CFX96 Touch型实时荧光定量PCR仪、Gel Doc XR+型凝胶成像仪 美国BIO-RAD公司;PEN3型电子鼻 德国AIRSENSE公司;SA402B型电子舌 日本INSENT公司;Varioskan Flash型酶标仪美国热电公司。
1.2 实验方法
1.2.1 发酵菌株的筛选 用无菌水冲洗掉发酵金锠鱼表面的杂质,沥干水之后,用灭菌剪子剪碎,称取25 g加到无菌均质袋中,再加入pH7.2灭菌的PBS 225 mL,均质30 s后,吸取0.1 mL均匀涂布于MRS培养基中,30 ℃培养48~72 h。挑取不同形态特征的菌落,反复纯化,直至获得纯的分离株。
参照文献[16],筛选具备过氧化氢酶实验呈阳性、发酵葡萄糖产酸,但不产生生物胺、不产气,具有一定的耐盐性,并有良好的抗菌活性菌株作为潜在发酵菌株。抗菌活性测定采用牛津杯法[17],其它指标测定采用《常见细菌系统鉴定手册》描述方法[18]。
1.2.2 发酵菌株的16S rRNA鉴定 分别以27F、1492R为正、反向引物,使用MightyAmp DNA聚合酶对发酵菌株进行菌落PCR,PCR体系与反应条件按照Lu等[19]的方法。再将目的PCR产物寄送生工生物工程(上海)股份有限公司进行测序。根据测得的16S rRNA基因序列,从EzBioCloud数据库进行同源性搜索,下载相似性高的模式菌株的相应基因序列[20],并用MEGA5.1建立系统发育树。
1.2.3 温度对发酵菌株生长的影响 挑取两环发酵菌株,接种于50 mL MRS液体中,30 ℃静置培养18 h,作为发酵菌株的种子液,再将种子液按3%接至MRS液体中,混匀后分别置于20、25、30 ℃培养28 h,且每间隔2 h测定发酵液的OD600nm[21],绘制生长曲线,评价温度对两株发酵菌的影响。
1.2.4 pH对发酵菌株生长的影响 将1.2.3中的发酵菌株的种子液按3%的接种量分别接种于pH为3.0、4.0、5.0、6.0和7.0的MRS液体中,30 ℃静置培养24 h后,测定发酵液OD600nm值[22],绘制生长曲线,评价pH对两株发酵菌的影响。
1.2.5 发酵菌株产酸能力测定 按3%接种量将种子液接种于100 mL的MRS液体中,30 ℃静置培养24 h,每间隔4 h取样,测定发酵液的pH[23]。
1.2.6 发酵菌株抗菌活性的测定 挑取两环S.aureus与E.coli分别接种于NB中,37 ℃摇床中培养16~20 h,然后将两种指示菌的菌液浓度稀释至106CFU/mL,再将指示菌的稀释液按1:100的比例加到55 ℃的NB中,混匀后趁未凝固前快速倒入摆放有灭过菌的牛津杯培养皿中,待凝固后拔出牛津杯。接着吸取200 μL发酵菌上清液加到杯孔中,37 ℃静止培养18 h,观察是否出现抑菌圈,并测量抑菌圈的直径[24]。同时,以生理盐水代替发酵上清液做空白对照。
1.2.7 发酵菌株发酵液的电子鼻测定 将1.2.3中发酵菌的种子液按3%的接种量接于MRS液体中,30 ℃静止培养24 h,再量取发酵液20 mL于顶空瓶中,静置30 min后进行电子鼻检测,测定条件为:顶空时间20 min,样品及载气流速均为300 mL/min,传感器自清洗时间60 s,样品测试时间60 s,数据采集间隔为1 s,PEN3电子鼻传感器对不同成份敏感性能描述见表1。
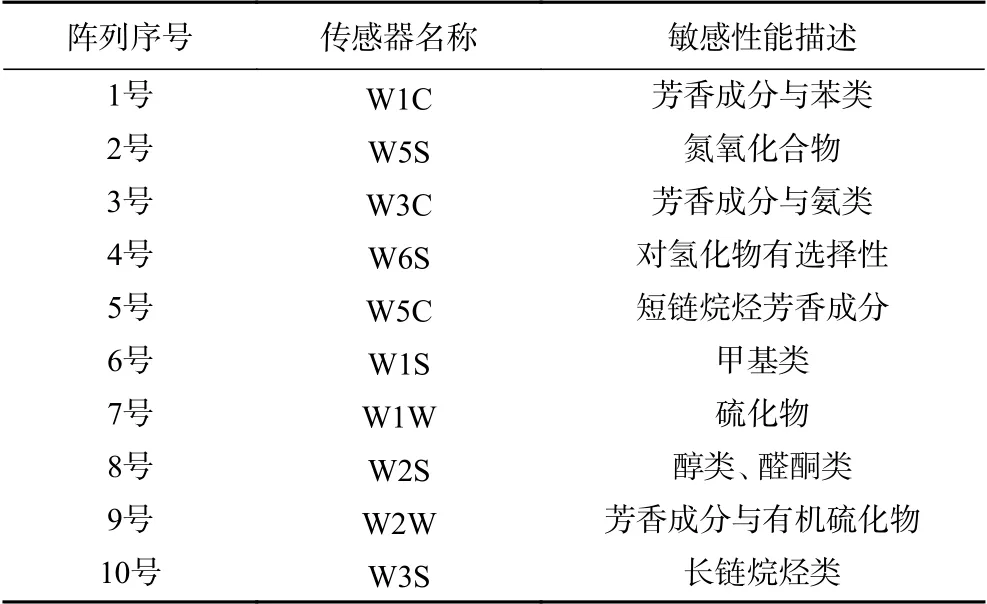
表1 PEN3型电子鼻传感器描述Table 1 Description of PEN3 electronic nose sensor performance
1.2.8 发酵菌株发酵液的电子舌测定 将1.2.7中得到的菌株发酵液稀释5倍,在4 ℃下,以3000 r/min离心20 min,收集上清液过滤,吸收100 mL上清滤液装入专用烧杯中,进行电子舌的检测。电子舌AAE、CT0、CA0、C00和AE1传感器的响应特性分别为鲜味、咸味、酸味、苦味和涩味。在测定前,所有传感器先放在参比溶液(0.30 mmol/L酒石酸和30.00 mmol/L氯化钾混合溶液)中活化24 h,再装机进行自检至信号稳定,每个样品做4次循环,取后3次结果,并对味觉特征进行分析。
1.3 数据处理
2 结果与分析
2.1 发酵菌株的确定
从传统发酵金鲳鱼中分离纯化到38株菌,通过发酵菌株筛选实验,菌株zh-b与菌株zh-f符合发酵菌株筛选标准[16],确定为潜在发酵菌。在MRS培养基上,菌株zh-f菌落呈圆形,色白,细密,显微形态为杆状(图1A、图1B);菌株zh-b在MRS培养基的菌落呈圆形,乳白色,凸起,边缘整齐,不透明,显微形态为球状(图1C、图1D)。Samarjit等[12]也从印度曼尼普人制备的传统发酵鱼中分离到46株形态不同的菌株,传统发酵鱼已成为分离用于发酵微生物的重要来源。

图1 两株菌菌落与显微形态图(100×)Fig.1 Colony and micromorphology of the two strains (100×)
2.2 发酵菌株的16S rDNA鉴定
将菌株zh-b与菌株zh-f的16S rRNA序列与标准菌株进行比对分析,发现菌株zh-b与模式菌株Pediococcus pentosaceusDSM 20336相似性最高,相似率为99.26%,而菌株zh-f与模式菌株Lactobacillus plantarumaATCC 14917相似性最高,相似率为99.11%,并用MEGA 5.1软件构建系统发育树(图2)。结合形态鉴定及16S rRNA序列分析,菌株zh-b与zh-f分别鉴定为戊糖片球菌(Pediococcus pentosaceus)与植物乳杆菌(Lactobacillus plantarum)。从印尼的发酵鱼中也分离到了L.plantaruma与P.pentosaceus[25],而谭汝城等[21]不仅从自然发酵鱼鲊中分离到L.plantaruma与P.pentosaceus,而且又将其接种于新鲜鱼中进行发酵,并与自然发酵鱼的化学指标和感官品质进行比较,结果表明,接种发酵可以改善鱼鲊游离氨基酸的组成,并有效提高了鱼鲊的感官品质。
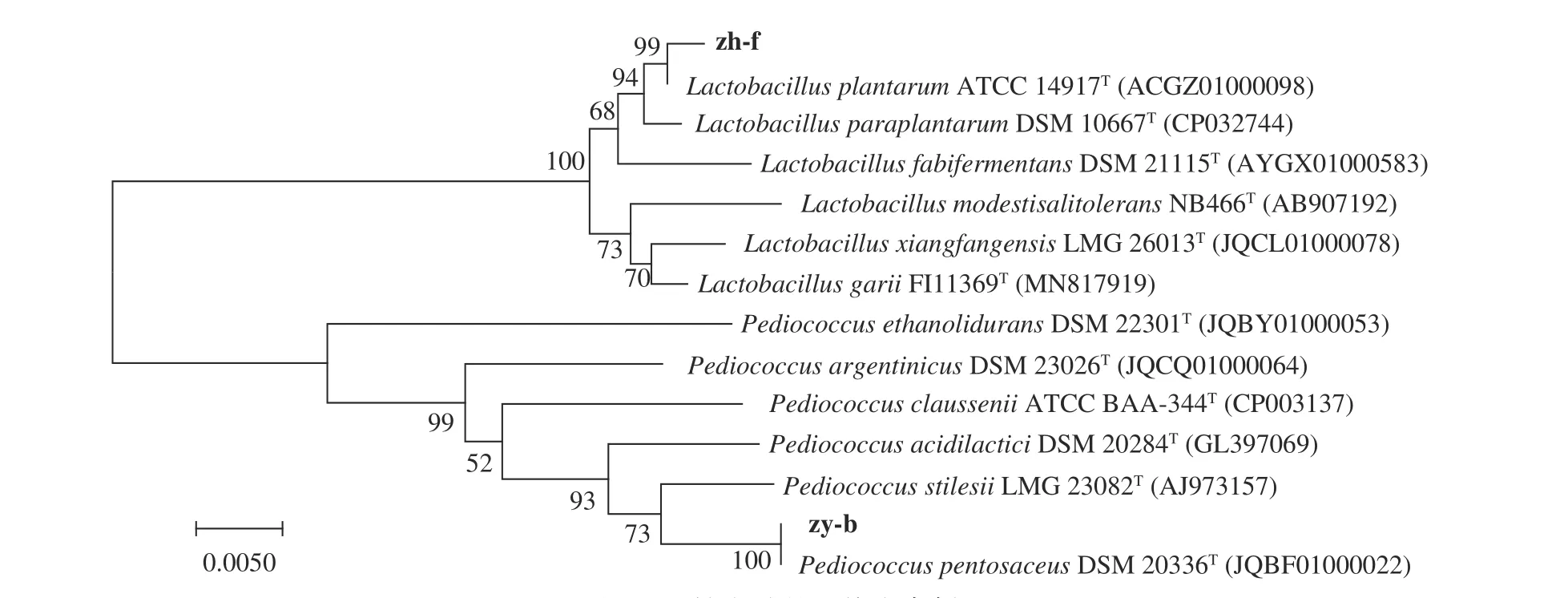
图2 两株发酵的系统发育树Fig.2 Phylogenetic tree of two strain
2.3 温度对发酵菌株生长的影响
图3为两株发酵菌株在20、25和30 ℃的生长曲线,从图中可以看出,在30 h内两株菌的OD600随着培养时间的延长而不断升高,并逐渐趋于平稳,说明菌数随着培养时间的延长而不断提高,并达到稳定期。其中,菌株戊糖片球菌zh-b(图3A)菌液浓度在同一培养时间20 ℃生长最好,其次是30与25 ℃。而植物乳杆菌zh-f(图3B)是30 ℃菌液浓度最高,其次是25与20 ℃。

图3 两株发酵菌在不同温度下的生长曲线Fig.3 Growth curve of two strains at different temperatures
通过比较分析,两株菌混合发酵液的最适发酵温度确定为30 ℃,从生长曲线出现平稳时间分析,确定两株最适发酵时间为16 h。
2.4 pH对发酵菌株的生长影响
图4为两株菌在不同pH培养条件下的生长曲线,其中戊糖片球菌的OD600曲线在pH3~5区间的OD600值呈上升趋势,并在pH5时达到最大值0.45,但在pH6时,OD600出现微小低谷。OD600值总体变化幅度小于0.4,即戊糖片球菌zh-b的生长受pH影响不大。而植物乳杆菌zh-f的生长随着pH的增高,出现了先增大再减小的现象,pH在3~6区间其OD600值随着pH的增大而增大,且增幅明显,并在pH6时,OD600达到最大值1.60后,接着OD600开始下降。

图4 pH对两株发酵菌的生长影响Fig.4 Effect of pH on the growth of two strains
2.5 发酵菌株产酸能力测定
不同乳酸菌产酸能力存在一定的差异,由图5可知,zh-b在24 h内产酸能力较弱,仅在前13 h pH有微小的降低后又开始上升。而zh-f在24 h内一直在产酸,尤其在4~13 h pH下降较快,产酸速率最大,说明该阶段产酸能力最强,20 h后pH达到3.775趋于平缓,说明植物乳杆菌zh-f将是发酵金鲳鱼中产酸的主要贡献者。

图5 两株发酵菌产酸能力的比较Fig.5 Acid production capacity of two strains
2.6 两株发酵菌的抗菌活性
由表2可知,两株发酵菌对E. coli和S. aureus均有抗菌活性,其中植物乳杆菌zh-f对两种指标菌表现出较强的抗菌活性;而戊糖片球菌zh-b对E.coli和S. aureus虽然也对两株菌有抑菌效果,但不及zh-f的抗菌效果,这可能与植物乳杆菌产酸能力或产生其它抗菌物质有关。

表2 两株发酵菌株抗菌活性Table 2 Antibacterial activity of fermentation strains
2.7 发酵菌株的电子鼻测定
用AIRSENSE PEN3型电子鼻对两株菌发酵液的气味成分进行测定,根据响应值绘制雷达图(图6)。通过比较发现,戊糖片球菌zh-b和植物乳杆菌zh-f菌株发酵液均含有甲基类(W1S)、硫化物(W1W)、氮氧化合物(W5S)和有机芳香硫化物(W2W)4种相同的香气成分,但zh-b的响应值明显高于zh-f,另外还产生了醇类或醛酮类(W2S)成分。其中,戊糖片球菌发酵液中的主要香气成分W1S、W1W、W5S、W2S、W2W的响应值依次是64.10、57.98、44.75、40.22和19.93,其他传感器测得的响应值均低于2,香气成分不明显。而zh-f发酵液中主要香气成分硫化物(W1W)、氮氧化合物(W5S)、有机芳香硫化物(W2W)、甲基类(W1S)的响应值分别为34.11、10.68、8.96和5.50,其他传感器W2S、W3S、W6S、W5S、W3C和W1C,响应值均低于2,香气成分不明显。分析表明,戊糖片球菌zh-b是发酵金鲳鱼香气成分的主要贡献者。Shen等[26]采用相关网络模型预测了关键微生物与风味形成存在明显的关系,采用美国Isenso公司的iNose电子鼻检测植物乳杆菌、干酪乳杆菌及戊糖片球菌混合菌制备的发酵带鱼,发现发酵过程中形成了氮氧化合物、有机硫化物,萜类、酯类、甲基类以及无机硫化物风味物质[27]。

图6 两株发酵菌的电子鼻雷达图Fig.6 Electronic nose radar map of two strains
2.8 发酵菌株的电子舌测定
SA402B电子舌传感器酸味和咸味对应传感器的无味点下限分别为-13和-6,其他味觉指标对应传感器的无味点下限均为0,按该电子舌的规定大于无味点的味觉指标,即可作为评价对象。根据电子舌对两株菌味觉响应值的测定,绘制滋味雷达图(图7)。从图中可以看出,两株菌的咸味、涩味、苦回味及涩回味的测定值均不大于无味点下限值,表明两株不产生对应的味道。对于酸味,戊糖片球菌酸味值为-29.5,小于-13,说明该菌不产生酸味,而植物乳酸菌的酸味值为-3.58,明显大于-13,说明该菌具有较强的产酸能力,这与2.5的结果一致。对于鲜味、鲜回味,两株菌的响应值均大于无味点下限,具有产生鲜味、鲜回味的能力,其中,戊糖片球菌的味值分别为14.32、6.64,高于植物乳杆菌产生鲜味、鲜回味(3.20、2.90)。另外,两株菌也产生非常少量的苦味(4.74与1.58)。不同的微生物发酵产品的味觉也存在差异,将清酒乳杆菌接种到鳓鱼中进行固态发酵,采用法国阿尔法莫斯公司的ASTREE II电子舌对味道进行测定,检测到发酵鳓鱼中的酸味、复合味1、复合味2及鲜味比未接种的对照组显著[28],说明微生物在发酵过程中对味觉的形成影响较大。

图7 两株菌的电子舌雷达图Fig.7 Electronic tongue radar map of two strains
3 结论
本研究以过氧化氢酶呈阳性、耐盐性、抗菌性及不产生组胺为评价指标,从湛江传统发酵金鲳鱼中分离筛选出两株潜在发酵菌株(zh-b和zh-f),经分子生物学鉴定为戊糖片球菌(Pediococcus pentosaceus)和植物乳杆菌(Lactobacillus plantaruma),且最适温度分别为20、30 ℃,最适pH为5、6。两株菌均具有抗菌活性,但植物乳杆菌zh-f的抗菌活性更好,且产酸能力明显高于戊糖片球菌zh-b。但zh-b产生的甲基类、硫化物、氮氧化合物、醇类或醛酮类和有机芳香硫化物高于zh-f,而且zh-b产生的鲜味、鲜回味也高于zh-f。本研究从传统发酵鱼中筛选到的两株发酵菌株,由于具有良好的特性,且风味与滋味有较好的互补性,因此,两株菌在发酵鱼应用中的潜力不容忽视。
