自制穿孔球囊给药对急诊经皮冠状动脉介入治疗术中无复流的疗效观察及预后意义
2023-02-13苗浩段洋裴思雨陆远徐晤李承宗
苗浩,段洋,裴思雨,陆远,徐晤,李承宗
急诊经皮冠状动脉介入治疗(PPCI)是ST 段抬高型心肌梗死(STEMI)患者的主要治疗方法,术后90%以上的梗死相关动脉血流可以恢复[1]。随着介入技术进步以及胸痛中心建设的推进,STEMI 患者的诊断和管理取得了显著进展,患者从入门到导丝通过时间大幅度缩短,但死亡率并未随之下降,反而逐年上升[2]。其原因可能是尽管闭塞的冠状动脉重新开放,但心肌仍灌注不足,即出现无复流[3]。在一项长期随访研究中,冠状动脉造影无复流患者的全因死亡率达到了22%,冠状动脉无复流是患者不良预后的独立预测因子[4]。近年来,人们不断探究预防术中无复流的方法,但有效方法仍有限,虽术前静脉或冠状动脉内应用药物可减少无复流的发生[5-7],但效果不一。当前,术中改善冠状动脉无复流常用给药方式多为经指引导管大剂量给药、经微导管给药或抽吸导管给药[8-9],但微导管和抽吸导管价格昂贵,操作复杂,增加手术难度及操作时间。国内不少学者对已使用过的预扩球囊进行改良,送至病变血管远端给药,即穿孔球囊技术,起到了较好的靶向灌注作用[10-11],但临床上仍缺乏大样本试验来进一步论证。本研究以微循环梗阻(MVO)为微循环评价指标,观察不同给药方式对STEMI 患者PPCI 术中无复流后发生微循环阻塞的影响,并初步探究其疗效及短期意义。
1 资料与方法
1.1 研究对象
回顾性收集2020 年7 月至2021 年7 月徐州医科大学附属医院709 例接受PPCI 治疗的STEMI 患者的手术资料,经筛选后纳入81 例患者。纳入标准:(1)符合最新STEMI 诊断指南[12]中的STEMI 诊断标准;(2)首次发作,成功行经皮冠状动脉介入治疗(PCI);(3)符合无复流定义:血管造影证实闭塞冠状动脉重新开放,无限制血流的残余狭窄(<50%)、夹层、血管痉挛或血栓负荷;血管造影显示TIMI分级≤2 级,药物处理后恢复TIMI 血流3 级;(4)PPCI 术后(5±2)d 进行初次心脏磁共振成像(CMR)检查且图像质量满足要求;(5)随访6 个月以上。排除标准:(1)既往有心肌梗死、PCI 史或冠状动脉旁路移植术史;(2)严重肾功能不全;(3)CMR 检查的其他禁忌证(心律失常、起搏器、金属植入物、幽闭恐怖症、对钆对比剂过敏)。按照给药方式将81例患者分为经微导管给药组(n=46)和穿孔球囊给药组(n=35)。本研究经过徐州医科大学附属医院伦理委员会批准(项目编号:XYFY2022-KL374-02)。
1.2 研究方法
1.2.1 治疗方法
穿孔球囊给药组:穿孔球囊给药组通过在冠状动脉开口放置微导管,导丝送至闭塞冠状动脉远端段。使用2.0 mm×15.0 mm 球囊,球囊用压力泵以10 atm(1 atm=101.325 kPa)体外充气,用针头对球囊膜进行6~10 次穿刺,形成数个微孔,让生理盐水从穿孔的节段渗出,以清除所有可能的微气泡。将穿刺的球囊送至无复流动脉的远端,压力泵负压抽吸,直至看到血液充满压力泵头端的管腔,无气泡。通过穿孔球囊往冠状动脉远端注射硝普钠(悦康药业集团股份有限公司,北京)[11]。根据TIMI血流情况初次给予硝普钠50~100 μg,观察药物输注后的心率和血压的变化以及1 min 后复查血管造影,以评价药物的安全性和有效性,无效者重复给药(每次50~100 μg)。如果术中血压小于90/60 mmHg(1 mmHg=0.133 kPa),或基础血压下降大于30 mmHg,则采用静脉泵给予多巴胺。具体穿孔球囊制作图及术中操作见图1、2。

图1 穿孔球囊制备

图2 穿孔球囊技术处理梗死相关动脉无复流
经微导管给药组:采用经皮腔内冠状动脉微导管,常规通过长导丝至无复流相关动脉远端后撤出导丝,注射药物和评价方法同穿孔球囊给药组。
穿孔球囊给药组及经微导管给药组的治疗操作均由同一团队医护人员完成。
1.2.2 检查方法
所有患者均采用仰卧位检查,采用标准心电图触发装置和屏气技术成像。使用3.0T 扫描仪(Ingenia3.0T,飞利浦,荷兰)采用True FISP 序列获得标准的2、3、4 室电影图及左心室流出道切面、左心室短轴电影。以0.10~0.15 mmol/kg 体重的剂量注射对比剂,15 min 后行相位敏感反转恢复的T1加权成像扫描,包括8~10 层左心室短轴切面、左心室两腔心切面以及四腔心切面各一层。
1.3 分析方法
1.3.1 预后分析
主要疗效终点是比较经微导管给药组和穿孔球囊给药组患者恢复TIMI 血流3 级的时间、给药次数、术中不良反应发生率及初次CMR 中MVO 占心肌质量百分比(MVO%)。其他疗效终点包括随访6 个月期间的主要不良心血管事件(MACE),包括心原性死亡、再发心肌梗死、非计划血运重建、心力衰竭再入院。临床随访时间分别为30 d、3 个月、6 个月。
1.3.2 评价指标分析
靶血管TIMI 分级[13]:TIMI 血流评分由进入心外膜动脉的血流程度来定义,按照对比剂充盈、消散的速度分为0~3 级。
MVO 被定义为一个延迟强化区域内的非增强核心区域(图3)。定量MVO 由CMR 实验室(徐州医科大学附属医院)使用CVI42(Circle Cardiovascular Imaging,加拿大)进行分析获得,所有图像均由1名有超过5 年心脏放射学经验的放射科医师进行分析。分析过程如下:首先调整图像的亮度,以达到心内膜和血池的最佳识别能力。在舒张内膜图像上,软件将自动追踪左心室的心内膜和心外膜轮廓,如果不合适,则手动调整初始轮廓。通过计算机辅助阈值>5 个标准差检测梗死区域,并手动调整,纳入无复流区,排除伪影和左心室血池,并使用多短轴切片视图进行量化。上述所有测量结果均以质量(g)和左心室百分比(%)表示。

图3 使用CVI42 软件定量MVO%
其他相关指标:两组从出现无复流到恢复TIMI血流3 级的时间、给药次数、给药剂量、给药后低血压和室性心律失常发生率、除支架外的手术费用。
1.4 统计学方法
所有统计分析均采用SPSS 26.0 进行。定性资料以频数(百分比)表示,根据检验方法的适用条件选择使用χ2检验或Fisher 确切概率法进行比较。采用Shapiro-wilk 检验对定量资料进行正态性检验,若符合正态分布则以均数±标准差表示,并采用t检验进行比较;若符合偏态分布则以中位数(P25,P75)表示,并采用Wilcoxon 秩和检验进行比较。出院后MACE 的风险比较采用单因素Logistic 回归分析。所有统计检验均为双侧检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者基线特征比较(表1)

表1 两组患者基线特征比较 [例(%)]
81 例患者的平均年龄为(57.5±13.2)岁,男性占86.4%。两组患者在年龄、性别、糖尿病、高血压等慢性疾病及吸烟史、冠心病家族史、血脂、药物干预等方面的差异均无统计学意义(P均>0.05)。
2.2 两组患者手术资料比较(表2)

表2 两组患者手术资料比较 [例(%)]
在总人群中,左前降支(50.6%)是最常见的罪犯血管,39 例(48.1%)显示为多支血管病变,71 例(87.7%)选择了单个支架置入。两组患者间胸痛至球囊时间、门至球囊时间、术前Killip 心功能分级、支架总长度、支架直径、主动脉内球囊反搏使用、血栓抽吸使用、术前TIMI 血流分级差异均无统计学差异(P均>0.05)。所有无复流患者给药后均恢复TIMI 血流3 级。两组间输注硝普钠剂量、给药次数及给药后低血压发生率差异均无统计学意义(P均>0.05),但穿孔球囊给药组与经微导管给药组相比,恢复TIMI 血流3 级的时间较短[(2.4±0.8)min vs.(4.2±1.4)min,P<0.01],除支架外费用较低[(2 185.6±212.0)元vs.(5 151.8±252.3)元,P<0.01]。
2.3 两组患者CMR 指标比较(表3)
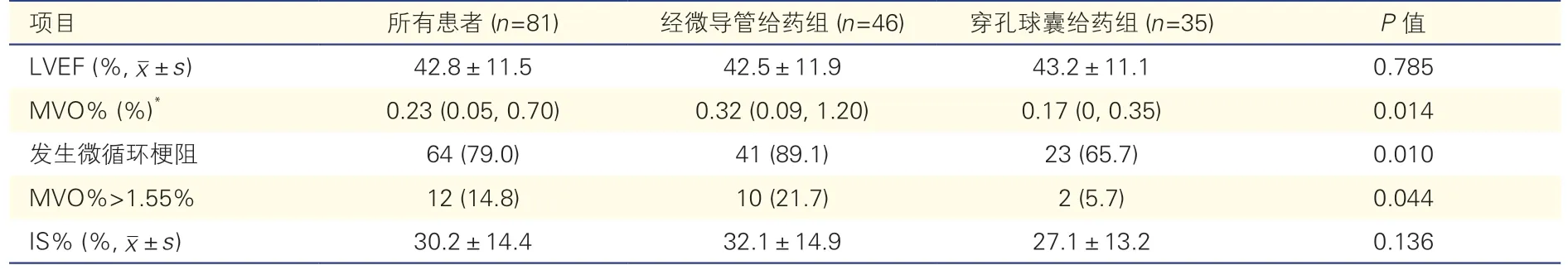
表3 两组患者心脏磁共振成像指标比较[例(%)]
所有无复流患者中,平均左心室射血分数(LVEF)为(42.8±11.5)%,平均梗死面积百分比为(30.2±14.4)%,中位MVO%为0.23%(0.05%,0.70%),64 例(79.0%)患者发生MVO,其中MVO%>1.55%的患者有12 例(14.8%)。穿孔球囊给药组与经微导管给药组比较,发生MVO 的比例(65.7% vs.89.1%,P<0.05)、MVO%>1.55% 的比例(5.7% vs.21.7%,P<0.05)及MVO%[0.17%(0%,0.35%)vs.0.32%(0.09%,1.20%),P<0.05]均降低,差异均有统计学意义。两组患者间LVEF 和梗死面积百分比差异均无统计学意义(P均>0.05)。
2.4 两组MACE 发生率和发生风险比较(表4)

表4 两组主要不良心血管事件发生率和发生风险比较[例(%)]
随访期间共有13 例患者发生MACE,发生率为16.0%。经微导管给药组和穿孔球囊给药组的MACE发生率分别为19.6%(9/46)和11.4%(4/35),差异无统计学意义(P>0.05)。其中心力衰竭再入院发生率分别为13.0%(6/46)和5.7%(2/35),再发心肌梗死发生率分别为4.3%(2/46)和2.9%(1/35),心原性死亡率分别为2.2%(1/46)和0%(0/35),非计划血运重建发生率分别为8.7%(4/46)和0%(0/35),差异均无统计学意义(P均>0.05)。
单因素Logistic 回归分析显示,经微导管给药组发生MACE(HR=1.885,95%CI:0.529~6.718,P=0.328)、心力衰竭再入院(HR=2.475,95%CI:0.468~13.087,P=0.286)、再发心肌梗死(HR=1.545,95%CI:0.134~17.763,P=0.727)的风险高于穿孔球囊给药组,但差异均无统计学意义。
3 讨论
急性心肌梗死患者在PPCI 术中无复流的发生率为20%,主要发生在灌注后的前2 h 内,是急诊手术中最严重的并发症和主要失败原因之一[8,14]。冠状动脉内无复流发病机制尚不明确,目前考虑原因有动脉粥样硬化血栓物质栓塞、血管收缩、炎症级联激活、中性粒细胞堵塞、血小板聚集、氧自由基生成和心肌水肿等[15]。已发表的数据表明,无复流的患者通常预后更差,其特征是慢性心力衰竭、心原性休克发生率和死亡率显著升高[16-17]。既往处理无复流的经验中,中位剂量的硝普钠(200 μg)对血管造影血流和血流速度均有非常显著和快速的改善[18]。经微导管介导远端血管给药是治疗无复流的一种新型方式,可以提高病变血管局部药物浓度,同时减少了药物用量和不良反应的发生。但因价格昂贵,手术操作要求高,部分医院设备缺乏,尤其在急性情况下交换设备风险增大,大大限制了临床应用[11,17]。
Patel 等[17]报道了一种新型穿孔球囊技术,通过改良预扩球囊,将药物从人工塑成的微孔向远端输注。穿孔球囊技术操作简单,时间消耗更少,技术易于使用,可重复性高。由于气球上有多个孔,可以使药物传递的流速更均匀,而不会产生高速的潜在创伤性射流。此外,同一球囊可多次到达病变远端进行药物灌注而不丢失冠状动脉导线通路。Sinha 等[19]使用穿孔球囊技术给71 例无复流患者冠状动脉内输注尼可地尔,84.5%的患者血流恢复至TIMI 血流3 级,TIMI 血流等级从1.03 级提高到2.58 级,TIMI 血流计帧数从(52.9±11.0)帧回归到(16.5±5.0)帧(P<0.01)。张霞等[11]比较了微导管和穿孔球囊技术改善无复流的疗效,结果显示,穿孔球囊技术恢复血流的效果不劣于微导管,且给药速度更快,更经济。
本研究中,81 例STEMI 患者均成功经穿孔球囊(35 例)或经微导管(46 例)于梗死相关动脉靶病变处给药,给药后两组冠状动脉血流均达到TIMI 血流3 级,两组间给药剂量、给药次数及给药后低血压发生率差异均无统计学意义,提示在改善冠状动脉血流的效果及安全性上,穿孔球囊给药不劣于经微导管给药。而在无复流至恢复TIMI 血流3 级的时间方面,两组间差异具有统计学意义(P<0.01),穿孔球囊给药组相比经微导管给药组的给药时间更短。此外,穿孔球囊给药组术中除支架外的耗材费用明显低于经微导管给药组(P<0.01)。
MVO 是指微血管严重的功能障碍或完整性丧失,在CMR 上表现为在高增强梗死区域内缺乏钆增强。一项大规模研究表明,STEMI 患者PPCI 术后通过CMR 测量的MVO 发生比例和程度(即MVO%)与1 年内因心力衰竭死亡和住院的发生率密切相关[20]。王岚等[21]应用心肌声学造影检测了73 例前壁STEMI 患者的微循环状态,发现74.0%的患者存在冠状动脉微循环障碍(CMD),且这部分患者较无CMD 的患者远期心功能差。本研究结果显示,经微导管给药组发生MVO 的比例高于穿孔球囊给药组,MVO%高于穿孔球囊给药组,MVO%>1.55%的比例高于穿孔球囊给药组(P均<0.05)。6 个月随访结果显示,经微导管给药组和穿孔球囊给药组的MACE发生率分别为19.6%和11.4%,两组心原性死亡率、再发心肌梗死发生率、非计划血运重建率、心力衰竭再入院率无差异(P均>0.05),提示在短期预后方面,穿孔球囊给药不劣于经微导管给药。
综上所述,穿孔球囊技术介导冠状动脉远端给药作为一种新型的给药方式,制作简单,不受技术条件和设备限制,经济成本低廉。并且,同一途径可多次通过进行药物灌注而不丢失原来的导线通路,给药节段更广,可以随时回撤,更适合应用于手术紧急情况。当应用MVO 作为微循环评价指标,比较两种方法时,发现穿孔球囊给药组MVO 发生比例和MVO%低于经微导管给药组。6 个月随访发现,穿孔球囊给药组患者预后并不劣于经微导管给药组。然而,穿孔球囊技术尚有不足之处,例如既往支架置入可能导致穿孔球囊回撤困难。此外,目前尚未对该技术进行多中心的大样本量研究,指南也尚未推荐。但本研究肯定了穿孔球囊技术的安全性和有效性,期待未来该项技术的推广可以使更多的STEMI 患者从中获益。最后,本研究是回顾性研究,样本量小,未进行长期随访,数据可能存在一定偏倚,需要进一步增加样本量和更长时间的随访结果来验证。
利益冲突:所有作者均声明不存在利益冲突
