晚期胃癌一线免疫检查点抑制剂联合化疗预后因素及对二线化疗的影响
2023-02-13卢娟杜思成赵传华张婷张颖刘容锐徐建明
卢娟 杜思成 赵传华 张婷 张颖 刘容锐 徐建明
晚期肿瘤免疫治疗常用的预测性生物标记物包括程序性细胞死亡配体1(programmed cell death-ligand 1,PD-L1)表达、微卫星不稳定性(microsatellite instability,MSI)、肿瘤突变负荷(tumor mutation burden,TMB)。另外,中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、体质量指数(body mass index,BMI)及肝转移状态也被认为是影响免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)单药治疗效果的重要因素[1-6]。由于目前免疫检查点抑制剂联合化疗已经成为胃癌的一线标准治疗,上述的标志物是否对联合治疗的疗效有一定的预测价值需要进一步探索。另外,在一些实体肿瘤中,ICIs 治疗进展后对化疗、靶向治疗的疗效增敏现象不断被发现[7-9],但一线ICIs 治疗对二线化疗的影响以及ICIs 治疗进展后是否可进行跨线治疗在晚期胃癌中的相关报道仍较少。因此,本研究探讨了上述因素对一线接受免疫检查点抑制剂联合化疗的晚期胃癌预后的影响,以及一线ICIs 治疗对二线化疗的影响。
1 材料与方法
1.1 临床资料
收集解放军总医院肿瘤内科2018 年1 月至2022年4 月收治的晚期胃癌患者临床资料,通过随访获得生存数据。在一线治疗中,将接受以程序性细胞死亡受体1(programmed cell death receptor-1,PD-1)/PD-L1抑制剂为基础的系统治疗的患者纳入免疫联合化疗组,仅接受化疗的患者纳入化疗组。在二线治疗中,将一线PD-1/PD-L1 单抗联合化疗进展后继续应用PD-1/PD-L1 单抗联合化疗的患者纳入跨线组,仅应用化疗的患者则纳入未跨线组,将同时期一、二线均仅采用化疗的患者纳入化疗组。并根据基线肝转移状态、NLR、BMI(结合既往研究共识和国际标准,将NLR取3 为cut-off 值,BMI 取25 kg/m2为cut-off 值),将各组患者分别纳入肝转移组、无肝转移组、NLR<3 组、NLR≥3 组、BMI<25 kg/m2组、BMI≥25 kg/m2组。纳入标准:1)经组织病理学确诊,包括不可切除的局部进展期或转移性或根治术后复发转移的胃癌患者;2)一线接受PD-1/PD-L1 单抗联合化疗或仅接受化疗;3)ECOG 评分0~2 分;4)年龄≥18 周岁;5)根据RECIST v1.1,至少有一个可测量病灶;6)无明显肝肾功能异常。排除标准:1)一般状况差,不能耐受免疫治疗或化疗;2)多原发肿瘤或原发病灶不明;3)无可进行疗效评价的实体瘤病灶;4)失访。
1.2 主要观察指标
1)患者临床特征和肿瘤特征:包括性别、年龄、ECOG 评分、肿瘤分期、转移器官及个数、HER2 及PD-L1 表达、BMI、NLR、是否手术及辅助治疗等资料。2)各组患者的疾病反应率:客观缓解率(objective response rate,ORR)定义为所有治疗患者中达到完全缓解(complete response,CR)及部分缓解(partial response,PR)的患者比例,疾病控制率(disease control rate,DCR)定义为所有治疗患者中达到CR、PR 及疾病稳定(stable disease,SD)的患者比例。3)各组患者的无进展生存(progression-free survival,PFS)期及总生存(overall survival,OS)期:PFS1 定义为一线治疗开始至疾病进展或因任何原因死亡之间的时间,PFS2定义为二线治疗开始至疾病进展或因任何原因死亡之间的时间。OS 定义为二线治疗开始至因任何原因死亡之间的时间。4)影响患者生存的相关预后因素。
1.3 随访
采用电子病例查阅、电话、门诊等形式进行随访,随访截止日期至2022 年4 月1 日,主要随访内容为疾病进展时间、死亡时间,时间以月为单位。
1.4 统计学分析
本研究应用SPSS 26.0 软件和 GraphPad Prism 9.0 软件进行统计学分析和科研绘图,患者基线临床资料采用描述性分析,记录频数并计算百分比,组间率的比较采用卡方检验或Fisher 检验,采用Kaplan-Meier 方法进行生存分析并行Log-rank 检验,采用Cox 回归模型进行单因素、多因素分析,计算风险比(HR)及95%CI。以P<0.05 为差异具有统计学意义。
2 结果
2.1 患者基线特征
本研究共筛选1 696 例胃癌患者,根据入排标准,最终纳入患者268 例。一线接受PD-1/PD-L1 单抗联合化疗的患者共114 例,疾病进展后,共56 例患者接受了二线治疗,其中继续应用PD-1/PD-L1 单抗联合化疗的患者(跨线组)30 例,仅应用化疗的患者(未跨线组)26 例。一线仅接受化疗的患者共154 例,其中82 例患者疾病进展后二线继续接受单纯化疗,各组患者基线特征见表1。

表1 胃癌患者基线特征 n(%)
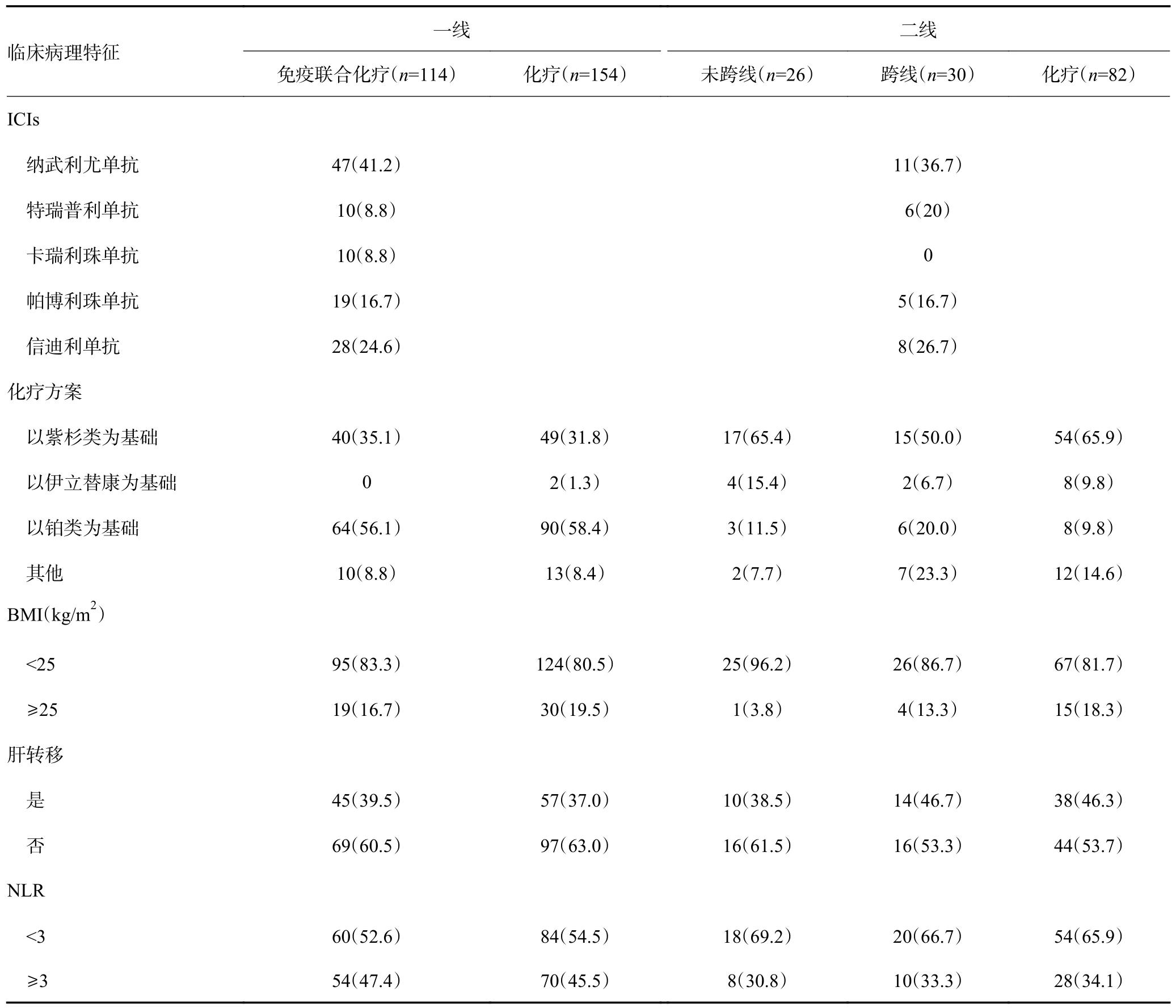
表1 胃癌患者基线特征 (续表1)
2.2 影响一线PD-1/PD-L1 单抗联合化疗的预后因素分析
一线应用PD-1/PD-L1 单抗联合化疗的114 例患者中,0 例CR,53 例PR,47 例SD,ORR 为46.5%,DCR 为87.7%。截止至随访终点,共87 例患者出现进展,中位PFS1 为6.9(95%CI:6.0~7.8)个月。各亚组中,仅NLR<3 组与NLR≥3 组的中位PFS1 有统计学差异(7.4vs.6.7 个月,P=0.044),见图1。为探索一线PD-1/PD-L1 单抗联合化疗的预后影响因素,进一步对114 例患者的临床特征进行了Cox 回归分析。单因素分析结果显示,NLR<3 与较长的PFS1 相关(P=0.047),ECOG 评分0~1 分的患者预后有更好的趋势(P=0.052)。本研究将ECOG 评分、NLR 以及其他具有重要临床意义的指标(PD-L1 CPS、肝转移状态、BMI、化疗方案)纳入多因素分析,结果仍提示基线NLR<3 的患者在PD-1/PD-L1 单抗联合化疗中能够获得更 长 的PFS(HR=0.57,95%CI:0.36~0.90;P=0.015),而BMI、肝转移状态、ECOG 与患者预后无明显相关(均P>0.05),见表2。

图1 NLR、BMI 及肝转移状态对胃癌患者一线PD-1/PD-L1 单抗联合化疗PFS1 的影响

表2 影响一线PD-1/PD-L1 单抗联合化疗的相关预后因素分析

表2 影响一线PD-1/PD-L1 单抗联合化疗的相关预后因素分析 (续表2)
2.3 二线治疗中各组疗效分析
本研究中免疫联合化疗组一线中位PFS1 为6.9(95%CI:6.0~7.8)个月,优于化疗组的5.8(95%CI:4.7~6.9)个月(HR=0.71,95%CI:0.55~0.92;P=0.010)。免疫联合化疗组中可随访到继续接受二线治疗的患者有56 例,这部分患者二线的ORR、中位PFS2 分别为19.6%、3.6 个月,对比化疗组的14.6%、2.9 个月有所提高,两者在KM 曲线上呈分开趋势,但无显著性差异(P>0.05)。本文将56 例患者进一步分为未跨线组、跨线组,其ORR 分别为34.6%、6.7%,中位PFS2分 别 为4.4(95%CI:1.3~7.4)个 月、2.7(95%CI:1.6~3.8)个月,与化疗组相比,3 组间ORR(P=0.015)及中位PFS2(P=0.007)差异均具有统计学意义。进一步分析发现,未跨线组的ORR(34.6%vs.14.6%,P=0.025)和中位PFS2(4.4vs.2.9 个月,HR=0.54,95%CI:0.35~0.82;P=0.004)均高于化疗组,而跨线组的ORR和中位PFS2 较化疗组无显著性差异(均P>0.05),其ORR(6.7%vs.34.6%,P=0.009)和中位PFS2(2.7 个月vs.4.4 个月,HR=2.22,95%CI:1.24~3.96;P=0.007)较未跨线组低。各组间的DCR 及中位OS 差异无统计学意义(均P>0.05),见表3、图2。

图2 各组患者生存分析

表3 胃癌患者二线治疗的ORR 及DCR
3 讨论
免疫治疗在胃癌中取得了突破性的进展,特别是PD-1 抑制剂联合化疗已成为HER2 表达阴性晚期胃癌的标准一线治疗[10-12],但联合治疗的疗效异质性比较大,有效率仅为50%~65%,探索预测相关生物标志物对于优选患者、判断预后具有重要的临床意义。PD-L1 表达作为目前最常用的免疫治疗标志物,在联合治疗中的预测价值仍存在争议,因为部分PD-L1 阴性的肿瘤患者也可以从联合治疗中获益。因此,探索预测免疫联合化疗疗效的标志物是临床医生关心的重要问题。随着对免疫治疗了解的加深,研究发现某些肿瘤特征、患者特征以及血清炎性标志物也会影响ICIs 的疗效,如在单药PD-1/PD-L1 抑制剂治疗某些实体瘤中,NLR 偏低者、无肝转移者、BMI 超重或肥胖者[1-6],往往能获得更好的疾病预后,但上述因素与PD-1/PD-L1 单抗联合化疗的疗效相关性尚不明确。在本研究中探索了NLR、肝转移、BMI 等临床特征与PD-1/PD-L1 单抗联合化疗预后的相关性,发现与单药PD-1/PD-L1 抑制剂一致,在接受PD-1/PD-L1单抗联合化疗的胃癌患者中,基线低NLR 仍可获得更长的无进展生存期,而不同肝转移状态、BMI 等并不能显著影响生存。
PD-1/PD-L1 单抗治疗进展后对化疗、靶向治疗的疗效增敏现象在晚期非小细胞肺癌、肾细胞癌以及头颈鳞癌患者中已有报道[7-9]。在Checkmate 649 最近的更新结果中,报道了纳武利尤单抗联合化疗组的中位PFS2(从随机化开始至二线系统治疗进展或死亡的时间)优于化疗组[13],提示胃癌患者中也存在PD-1/PDL1 单抗治疗后的化疗增敏现象。本研究中,观察到未跨线组二线化疗的ORR(34.6%vs.14.6%,P=0.025)和中位PFS2(4.4vs.2.9 个月,HR=0.54,95%CI:0.35~0.82;P=0.004)均高于化疗组,表明前期的PD-1/PDL1 抑制剂治疗确实会为晚期胃癌患者后线化疗带来获益。一项临床前研究尝试在体外和体内人肿瘤移植模型化疗前使用非特异性活化CD4+T 细胞作为化疗增敏剂,结果发现活性和非活性化疗药物在暴露于CD4+T 细胞后均显著增强细胞毒性[14]。因此这种免疫治疗后的化疗增敏现象,可能是由于PD-1 抑制剂抑制肿瘤浸润CD8+T 细胞上的PD-1 表达,恢复T 细胞的活性和细胞因子分泌[15],形成使肿瘤细胞对化疗更敏感的微环境,从而进一步增强后续化疗的疗效。同样,化疗可通过下调免疫抑制细胞(如调节性T 细胞、髓源性抑制细胞),增加抗原表达和呈递,破坏肿瘤间质,增加免疫渗透,诱导肿瘤细胞凋亡来增强免疫应答[16]。因此,可能是前线的ICIs 半衰期长,导致后线治疗中存在PD-1/PD-L1 单抗与化疗的共同作用。
ICIs 治疗进展后再应用的策略在黑色素瘤、乳腺癌、非小细胞肺癌中已有报道[17-19]。近年的一项荟萃分析显示,在肿瘤进展而停用ICIs 的亚组中,再进行ICIs 治疗的ORR、中位PFS 和中位OS 分别为15.2%、2.9 个月和7.9 个月,提示ICIs 治疗进展后再应用可能是一个可行的策略[20]。本研究中观察到一线PD-1/PD-L1 单抗治疗进展后再进行免疫治疗的跨线组的ORR(6.7%vs.34.6%,P=0.009)和中位PFS2(2.7vs.4.4个月,HR=2.22,95%CI:1.24~3.96;P=0.007)较未跨线组低,认为可能的原因是长期ICIs 治疗可通过免疫抑制细胞、细胞因子和代谢物的募集诱导肿瘤免疫耐受[21],或是增强的免疫相关不良反应使患者基础状况进一步恶化而迅速出现肿瘤进展。当然,不能排除是因为本研究的样本量偏小或者其他未知的微环境调节机制的因素。在一项真实世界研究中[22],10 452例患者接受不同的治疗模式,其中一组为ICIs 治疗进展后跨线使用ICIs(resumption 组),另一组是ICIs 治疗进展后改用化疗,化疗进展后再次使用ICIs(rechallenge 组),resumption 组的OS2(从开始第二次ICIs治疗至死亡的时间)为14.8 个月,rechallenge 组的OS2 为18.1 个月,并且既往ICIs 获益超过 3 个月的人群,ICIs 再应用获益也优于未超过 3 个月的人群,提示间隔化疗可能再次改变免疫微环境,从而逆转免疫耐药。目前,ICIs 治疗进展后如何重启免疫治疗仍存在争议,未来需要前瞻性研究来探索免疫治疗进展后更好的治疗策略。
本研究存在一定的局限性:1)本研究是单中心、小样本的回顾性研究,可能导致不可避免的偏倚。2)在影响一线PD-1/PD-L1 单抗联合化疗的相关预后因素分析中,未将化疗组纳入作为对照组,这意味着无法确定NLR 是否仅是PD-1/PD-L1 单抗联合化疗的预后标志物,且由于临床资料缺失和随访时间不足,未将OS 纳入结局指标。3)在二线治疗中,各组的化疗方案不同,在一定程度上会影响各治疗组间的疗效及生存差异。
本研究中,评估了BMI、NLR 以及肝转移状态等临床特征与一线接受PD-1/PD-L1 单抗联合化疗的晚期胃癌患者生存结局之间的关系,较单药PD-1/PDL1 抑制剂治疗,高基线NLR 仍是疾病进展的独立危险因素,而肝转移状态、BMI 等与患者预后无明显相关。同时,进一步发现一线应用PD-1/PD-L1 单抗治疗可提高胃癌患者二线化疗的疗效,使其获得更长的无进展生存期。由于本研究存在诸多限制,未来还需扩大样本量的前瞻性临床研究来进一步证实。
