胎儿早期小鼠无疤痕愈合的数据转录组学分析
2023-02-12王振YAOMawulikplimiAdzavon刘梓嘉刘梦昱谢飞马雪梅赵鹏翔
王振 , YAO Mawulikplimi Adzavon , 刘梓嘉 , 刘梦昱 , 谢飞 ,马雪梅 , 赵鹏翔
1.北京工业大学环境与生命学部,北京 100124;
2.北京氢分子研究中心, 北京 100124;
3.抗病毒药物北京市国际科技合作基地,北京 100124
作为人体最大的器官,皮肤具有多种功能,包括抵御微生物、调节体温、分泌、排泄和参与内部环境的稳定等[1]。皮肤损伤不可避免,但其修复是一个复杂且受到严格调控的过程,需要多种类型细胞[2]的协同作用以及相关细胞外基质(extracellular matrix,ECM)[3]来促进愈合。皮肤损伤后,凝血级联反应引发炎症,中性粒细胞、巨噬细胞迁移到伤口部位;随后在细胞因子和趋化因子的作用下,血管内皮细胞、角质细胞以及上皮细胞共同负责血管生成和上皮化;与此同时,成纤维细胞迁移到受损区域,产生大量胶原蛋白,肉芽组织和ECM重新形成以填充伤口[4]。此外,上皮细胞经历上皮-间充质转化(epithelial-mesenchymal transition,EMT)参与真皮修复[5]。受伤组织的重塑时间取决于皮肤受损程度以及创伤局部微环境,而自然的皮肤修复通常会形成疤痕。疤痕形成以胶原的过度合成与沉积为特点,从主要的Ⅲ型胶原过渡到Ⅰ型胶原。这不仅给患者造成巨大痛苦,也给医疗工作带来巨大负担。尽管疤痕形成途径和过程已有较多研究,但迄今为止还没有发展出切实有效的疤痕防治方法[6]。
与成年小鼠愈合模式不同,哈里森描述了胎儿伤口的完美修复模式,即有效修复皮肤伤口而不形成疤痕 ,随后的研究逐渐确立了这一无疤痕愈合概念[7]。一般来说,无疤痕愈合只出现在早期胎儿中,人类胎儿在妊娠24周左右[8],小鼠在妊娠18 d左右[9](E18),愈合方式将从无疤伤口愈合转变为疤痕愈合模式。研究表明,快速上皮化是无疤痕伤口愈合的特征[10],无疤痕/疤痕愈合模式之间的主要区别在于血管生成速率、炎症水平、皮肤结构状态和组织重塑快慢的不同,但目前缺乏对无疤痕愈合分子机制的系统研究。为了探索无疤痕愈合的分子机制并确定涉及无疤痕愈合的重要通路、基因,本研究分析了基因表达数据库(gene expression omnibus,GEO)中的GSE71619数据集,比较了小鼠胎儿(E14和E18)和成年(6周龄)皮肤组织中的基因表达。相关研究结果希望有助于发现新的疤痕治疗靶点,并为临床创伤治疗提供更有效的策略。
1 材料和方法
1.1 表达谱芯片数据
不同胎龄皮肤愈合的相关芯片数据来源于GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)。筛选得到数据集GSE71619[11],平台注释文件为GPL19179。GSE71619数据集包含C57BL/6J不同胎龄/鼠龄的皮肤组织样本,纳入胎龄14 d(E14无疤痕愈合模式组)、胎龄18 d(E18)和6周龄成年鼠(W6)(疤痕愈合模式组)各6例,共18例皮肤样本。
1.2 数据处理和DEGs的选取
利用edgeR包(版本:3.32.1)和TMM(trimmed mean of M-values)方法对上述芯片进行预处理和 标准 化[12-13]。应 用Limma 包[14](版本:4.0.3;https://www.R-project.org/)进行DEGs筛选。筛选条件设置为|log2FC|≥1以及P<0.05。在E14vsE18、E14vsB6和E18vsB6 3个比较组之间采用维恩图缩小寻找调控无疤痕愈合相关差异基因的范围[15]。
1.3 功能富集分析
通过Metascape[16]对2个比较组(E14vsE18,E14vsW6)中的关键靶点基因进行基因本体(gene onotology,GO)功能和通路(kyoto encyclopedia of genes and genomes,KEGG)富集分析。
1.4 PPI网络的构建
将1.2中得到的关键靶点导入String[17]数据库(https://string-db.org/)中,置信度分数设置为highest confidence(0.9),隐藏网络中无联系的节点,其余参数保持默认。
1.5 统计分析
采用GraphPad Prism 8.0软件进行统计学处理,计量资料采用均数±标准差(Xˉ±S)表示,多组均数比较采用单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 无疤痕愈合皮肤(E14)和疤痕愈合皮肤(E18+W6)之间的DEGs筛选
为了确保数据分析的准确性,首先使用主成分分析(principal component analysis,PCA)度量集群的相似性[18]。3组样本(E14、E18、W6)之间的相似性如图1所示。为了保持不同组之间的相对独立性,我们在每组中保留了4个样本,共12个样本用于进一步分析。在E14、E18和W6皮肤组织活检中,共对19 784个基因进行了基因表达谱分析,共鉴定出4 654个DEGs(|log2FC|>2,P<0.05)。比较E14和E18的基因表达,我们发现E14中有1 523个基因上调,3 131个基因下调(图2A,C)。与W6相比,E14中有1 160个DEGs,包括791个上调基因和732个下调基因(图2B,D)。
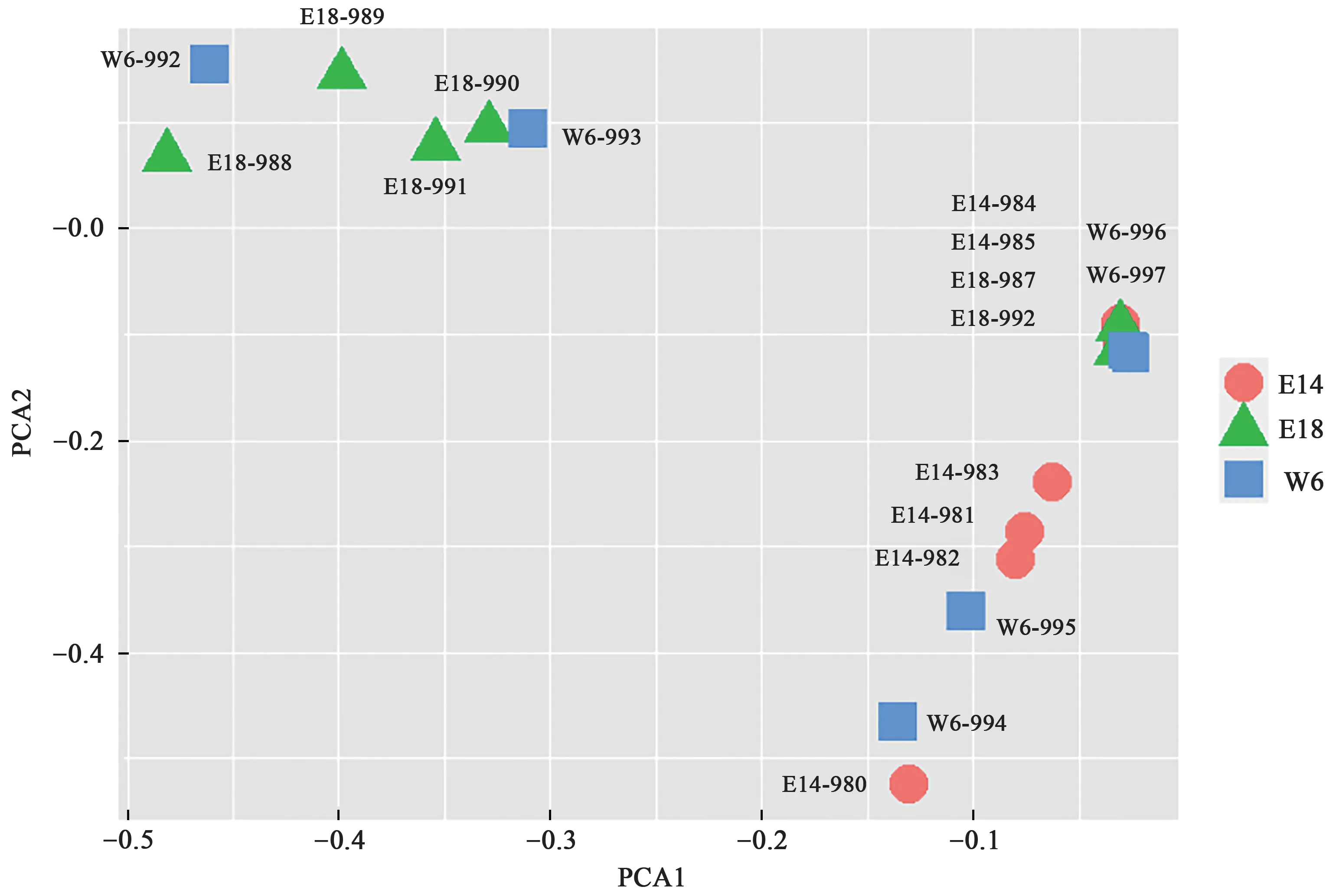
图1 PCA分析Fig. 1 PCA analysis of raw data

图2 不同胎龄和成熟小鼠皮肤组织的差异基因Fig. 2 DEGs in mice embryonic and adult skin
2.2 无疤痕皮肤和疤痕皮肤之间DEGs的功能表征
分别对E14vsE18以及E14vsW6上调和下调基因进行富集分析。E14vsE18上调DEGs主要的生物学功能和途径包括组织形成、上皮发育、细胞黏附;E14vsW6中富集功能包括组织发育以及细胞增殖(表1)。下调DEGs(表2)在炎症反应以及细胞分化(E14vsE18)和代谢过程、氧化还原反应(E14vsW6)功能中富集。

表2 E14 vs E18 和E14 vs W6中下调差异基因富集的前20个生物学功能Table 2 Top 20 biological function of related differential genes to the E14 Down-DEGs in E14 vs E18 and E14 vs W6
2.3 潜在无疤痕愈合相关基因的识别分析
包含不同发育阶段的皮肤组织的数据集结合功能注释表明,筛选出的DEGs也包括调控胎儿皮肤向成人皮肤发育过渡的基因(表1~2)。我们对E14、E18和W6小鼠皮肤组织样本的基因群进行了维恩图分析和功能注释(图3A)。E14vsE18和E14vsW6重叠但排除在E18vsW6之外的228个基因在很大程度上与发育过程无关,其功能注释主要集中在伤口愈合方面。对这228个候选基因进行分析,并从中鉴定出4个Cluster(图3B),其中Cluster 2由于E14组中个体平行性较差,且总体基因数量较少,因此暂不做细化分析。通过分析Cluster 1和Cluster 4发现,E14基因表达水平相似,E18和W6组在这2个Cluster中的表达水平特点呈现相似性,因此将这2个Cluster整合进行后续分析。

表1 E14 vs E18 和E14 vs W6中上调差异基因富集的前20个生物学功能Table 1 Top 20 biological function of differential genes related to the E14 Up-DEGs in E14 vs E18 and E14 vs W6
Cluster 1和Cluster 4中的基因(在E14中大多数表达下调)主要富集于代谢相关功能(图3C),如有机化合物氧化、次级代谢过程、羧酸生物合成过程和AMPK信号通路。PPI网络分析揭示了两个簇中的关键基因,涉及PPP2CB、PPP2R5B、PIM3、PPM1L、AKT2、COX4I1、UBE2G2、MGST3、GSTM1和CYP1B1等(图3D)。
Cluster 3中的基因(在E14中大部分上调)主要富集于肌肉活动和ECM合成相关功能(图3C),GO富集前5个生物学功能为横纹肌收缩、骨骼肌收缩、ECM形成、横纹肌细胞发育和肌肉结构发育。该聚类的PPI网络分析显示,多为富含胶原和肌肉结构家族的hub基因,如COL5A2、COL4A2、COL1A2、MYH8、MYH3、TNNT2和TNNI1(图3D)。
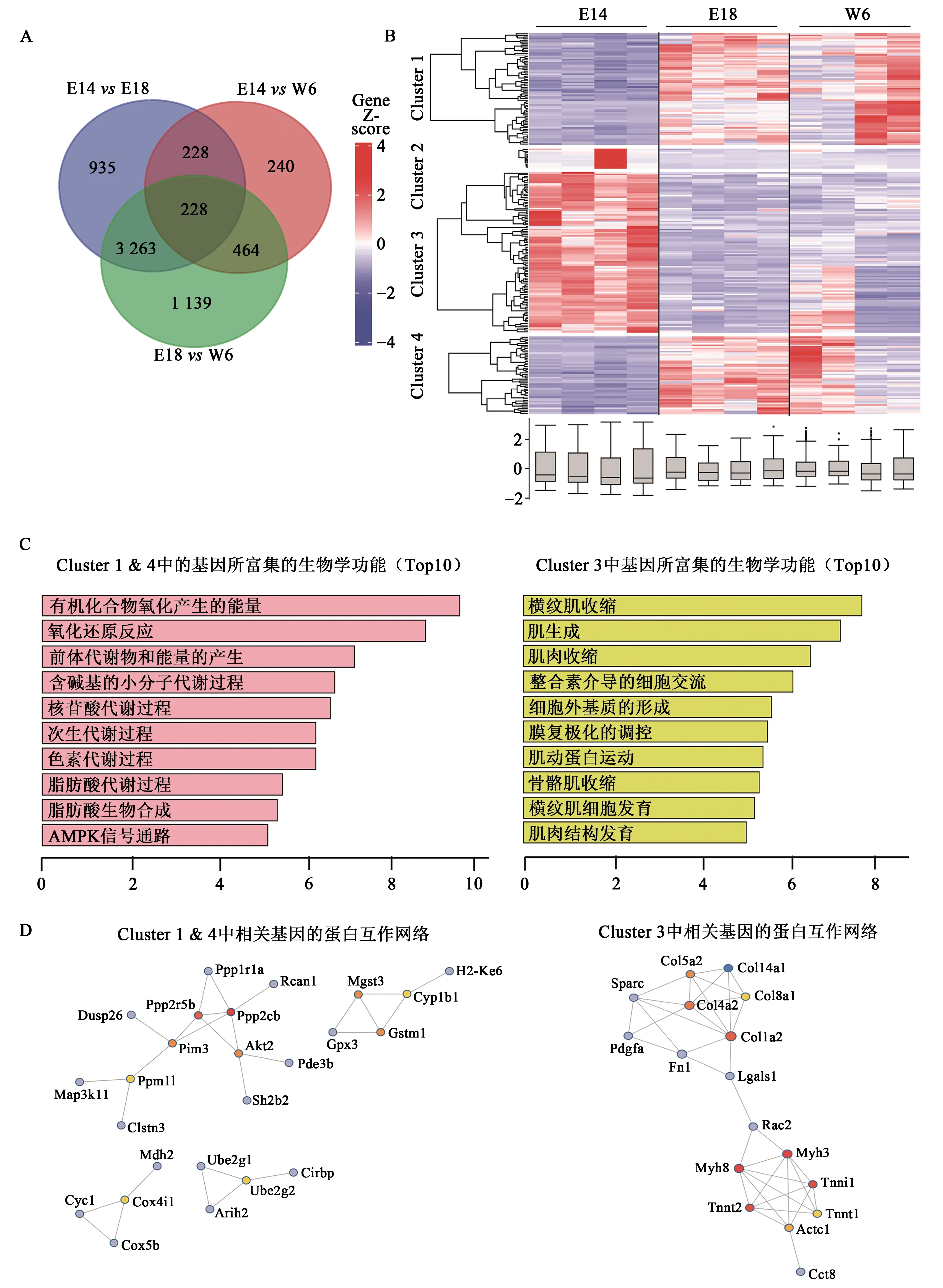
图3 胎儿无疤愈合相关基因的鉴定Fig. 3 Identification of fetal scarless healing related genes.
2.4 关键基因的PPI分析
在ECM成分基因中,我们发现了更多与胶原家族有关的基因,包括COL1A2、COL4A2、COL5A2和COL8A1,它们可能是促进更好的组织重塑的关键基因(图4A)。成纤维细胞和肌成纤维细胞(也称为活化成纤维细胞)是ECM合成的主要来源。这些细胞位于富含ECM的结缔组织中,合成、维持和重组ECM成分。在E14中上调的差异基因富集功能可能与成纤维细胞迁移、增殖和活化有关(图4B)。因此,我们认为E14组的成纤维细胞活化可能是触发无疤痕愈合的另一个关键因素。

图4 Cluster 1&4和Cluster 3中通过PPI分析获得的具有代表性的关键基因Fig. 4 Representative hub genes expression data out from the PPI network analysis for the genes in Cluster 1&4 and Cluster 3.
胎儿早期炎症反应水平较低,与本研究中得到的结果基本一致(图4C),即E14下调的差异基因功能富集于炎症相关功能。此外,炎症加剧会激活基质金属蛋白酶,不利于ECM的进一步堆积。但我们发现线粒体功能相关基因的下调,如CYPB1、COX5B、CYC1(图4E)与兔胎儿伤口愈合过程中的发现不一致[19]。此外,E14组的脂质代谢和抗氧化功能降低(图4D),这可能与胎儿发育的微环境有关。
3 讨论
随着创伤修复研究的深入,研究者已在哺乳动物的胎儿中发现了无疤痕伤口愈合现象,且无疤痕愈合的能力随着年龄的增长逐渐消失。这意味着胎儿皮肤在一定胎龄之前可以实现创伤后无疤痕愈合。本研究利用GEO数据库,比较了孕早期(E14)、孕晚期(E18)和产后成年(W6)皮肤组织转录组数据,最终筛选出了包含25个下调基因和17个上调基因的核心基因模块。
ECM重塑是伤口愈合的一个重要阶段。研究表明,隆起的真皮疤痕组织中Ⅰ型和Ⅲ型胶原、纤维连接蛋白和层粘连蛋白的水平均升高,因此ECM的过度形成导致疤痕的形成[20]。此外,ECM在愈合过程的每个阶段都发挥着重要作用。一方面,ECM被视为修复过程的支架[12],为愈合过程的每个阶段(如血管形成、上皮化等)提供基质;另一方面,ECM在动态愈合过程中发挥转导作用。如ECM通过调节生长因子和细胞因子,对中性粒细胞、单核细胞/巨噬细胞、成纤维细胞和上皮细胞(角质形成细胞)发挥趋化作用[21]。通过本数据集的分析,我们发现Cluster3(E14上调)中基因富集的前3个生物学功能是横纹肌收缩、骨骼肌收缩和ECM形成,表明ECM积累在无疤痕伤口愈合中的重要性。
炎症始终是伤口愈合的一把双刃剑。轻度炎症对组织启动细胞迁移和趋化以及分泌生长因子至关重要,而慢性炎症会导致伤口难以愈合或愈合后出现异常疤痕[22]。糖酵解方式是多种干细胞群体的共同代谢特征,与氧化磷酸化过程相比,细胞一般通过糖酵解产生较低水平的能量[23]。结合在本研究中观察到E14组的低能量生成水平,糖酵解可能在E14妊娠期占主导地位。因此,干细胞特性的维持可能与无疤痕愈合有关。
另一方面,本研究也存在一定的局限性。由于本文主要是采用生物信息学的方法,大量的数据结果是基于计算机与数学的统计功能进行的预测分析。结果的准确性取决于现代计算机技术的发展以及科研工作者对于该技术的理解,因此需要大量的实验对本文结果进行验证。
综上,本研究通过数据集关键基因的筛选,揭示了ECM形成和纤维细胞活化在早期胎儿无疤痕愈合模式中的重要性,相关研究对未来的疤痕医学护理具有一定参考价值。
