造血干细胞移植条件对小鼠造血重建的影响
2023-02-12肖方楠吕雪袁佳佳张明英邢文周圆
肖方楠 , 吕雪 , 袁佳佳 , 张明英 , 邢文 , 周圆
中国医学科学院血液病医院(中国医学科学院血液学研究所),北京协和医学院血液学研究所,实验血液学国家重点实验室,国家血液系统疾病临床医学研究中心,细胞生态海河实验室,天津 300020
造血干细胞(haematopoietic stem cell,HSC)是一群具有自我更新以及多向分化潜能的特殊细胞群体,通过定向分化形成各系造血祖细胞及成熟血细胞,在维持血液系统稳态上起着至关重要的作用。在造血干细胞分化模型中,逐级向下分化为长期造血干细胞(long-term haematopoietic stem cell,LT-HSC)和短期造血干细胞(short-term haematopoietic stem cell,ST-HSC)。体内移植研究已经证实,ST-HSC可以维持6~8周的正常造血功能,而LT-HSC则能维持生命体整个生命周期内正常造血群体和细胞类型[1]。正是由于造血干细胞具有自我更新以及多向分化潜能的特殊性质,自1957年起,临床上应用造血干细胞移植策略治疗血液以及自身免疫性等疾病[2-3]。目前临床上利用CD34+的造血干祖细胞(haematopoietic stem and progenitor cell,HSPC)作为供体细胞治疗肿瘤等疾病的手段已经相对成熟,为进一步提高临床治愈率、扩大应用范围及实现个体化治疗,已经研发出对HSPC进行基因修饰后进行移植的基因疗法[4]。如使用病毒载体修饰HSPC的药物已经获准应用于临床,此外使用CRISPR-Cas9等基因编辑技术对HSPC进行位点特异性修饰的方案也具有广阔的临床应用前景[5-7]。而HSPC经过基因编辑等预处理后是否能完成造血重建以及会发生何种不良反应尚不明确,仍需进一步研究。
在基础研究中常通过小鼠造血干细胞的移植模型来探究血液系统疾病的机制。全骨髓单个核细胞、利用磁珠富集的c-Kit+细胞群体以及通过流式分选得到纯度更高的造血干细胞均可作为移植的供体细胞。此外,根据实验要求的不同,还会对供体细胞进行病毒感染、分选等预处理后再进行移植。但供体细胞植入后,能否持久并有效地进行重建还受到供体细胞质量、来源以及骨髓微环境等多种因素的影响。已有研究表明,骨髓微环境中活性氧的水平以及细胞因子的含量等可以显著影响移植后供体细胞的植入情况,而使用抗氧化药物改善骨髓微环境以及适当升高微环境中IL-6、TNF-α等细胞因子水平将有助于造血干细胞的植入并降低植入后不良反应的发生率[8-11]。但不同供体细胞的选择是否会影响移植后的造血重建效果以及预处理操作对移植效果产生何种影响尚不十分清楚。
本研究选用小鼠移植实验中最常见的2种供体细胞,即全骨髓单个核细胞(whole bone marrow mononuclear cells,BMNCs)和c-Kit+造血干细胞进行移植,并对2种供体细胞进行病毒感染,以探究不同来源的供体细胞以及供体细胞的预处理对移植后重建的影响。在进行造血干细胞移植后,对各系造血重建的检测是评估移植效果的重要指标。前期研究表明移植2周后便会出现粒细胞的重建,在6~8周出现B细胞重建,最后进行T细胞重建[12]。因此,我们通过检测移植后小鼠外周血成分的动态变化以及小鼠移植后的状态来比较不同供体细胞以及预处理因素对移植效果的影响,以期为造血干细胞的移植研究提供参考。
1 材料和方法
1.1 实验动物
供体小鼠C57BL/6J(白细胞抗原表型为45.2)和受体小鼠B6.SJL(白细胞抗原表型为45.1)均由本单位实验动物中心自主繁育。所有实验用鼠均饲养于中国医学科学院血液学研究所SPF级动物房,且所有用于实验研究的小鼠均得到中国医学科学院血液学研究所伦理委员会的管理与批准。实验选取6~10周的小鼠作为供体或者受体小鼠。
1.2 试剂与仪器
小鼠骨髓c-Kit富集使用的anti-mouse c-Kit(CD117)magnetic beads及磁力分选器LS柱均购自美天旎公司。流式分析以及分选所用到的单克隆荧光抗体包括:APC-Anti-CD117、FITC-Anti-CD45.1、APC-Anti-CD45.2、APC-cy7-Anti-Ly6G/Ly6C、PE-cy7-Anti-CD11b、PE-cy7-Anti-CD3、PEpercp 5.5-Anti-B220均购自eBioscience以及Invitrogen公司。红细胞裂解液以及PBS粉末购自索莱宝公司。骨髓细胞冲洗液PBE为PBS+2%血清+2 μmol·L-1EDTA配制。流式分选仪Aria Ⅱ以及流式分析仪Cantoll均购自美国BD公司。
1.3 小鼠全骨髓单核细胞的获取
实验小鼠安乐死后在75%酒精溶液中浸泡5 min进行消毒,之后取小鼠胫骨、股骨以及髂骨置于PBE溶液中,用1 mL注射器吸取PBE溶液冲出骨髓细胞,过300目塑料膜制备成单细胞悬液。
1.4 小鼠c-Kit细胞的磁珠富集
获得的小鼠骨髓单个核细胞悬液300g离心5 min,用1 mL PBS进行重悬,每只鼠取出的骨髓细胞加入200 μLCD117磁珠进行标记,4 ℃避光标记30 min,LS柱进行富集,即得到小鼠c-Kit+细胞。
1.5 小鼠骨髓细胞感染以及分选
将获得的小鼠骨髓单个核细胞以及c-Kit+细胞计数后,以5×105个·孔-1的数目铺在24孔板内,每孔加入100 μL带荧光标签的逆转录病毒,感染48 h后,流式分选仪分选荧光阳性细胞。
1.6 小鼠骨髓细胞移植
取8~10周左右B6.SJL小鼠,用X-Ray辐照仪进行致死剂量照射,总剂量8 Gy。照射完成约3 h后,将5×105c-Kit+细胞或1×106全骨髓细胞与5×105CD45.1保护细胞混合后进行小鼠尾静脉移植。
1.7 小鼠外周血表型的分析
小鼠移植2、4、8、12、16周后,取小鼠尾静脉外周血,使用红细胞裂解液裂解红细胞,分别标记抗体(FITC-CD45.1、APC-CD45.2、APC-cy7-Ly6G/Ly6C、PE-cy7-CD11b 或 FITC-CD45.1、APCCD45.2、PE-cy7-CD3、PE-percp5.5-B220),4 ℃孵育30 min。抗体标记结束后加入3 mL PBS清洗,离心后流式细胞仪进行检测。
1.8 小鼠体质量变化
在小鼠骨髓移植1周后对小鼠体质量进行测量,以该次测量数据当作小鼠基础体质量数值,此后在移植16周后,小鼠完全造血重建后再对小鼠体质量进行测量,取最后测量值与基础体质量数值的差值作为小鼠体质量净增长数值,并进行统计分析。
1.9 统计学分析
采用FlowJo软件对流式图进行处理,数据统计使用GraphPad 8.0进行分析,使用非配对t检验,多组数据之间比较采用One Way-ANOVA进行分析。实验数值以均值±标准误差表示,P<0.05即认为具有统计学意义(*P<0.05,**P<0.01,***P<0.001,****P<0.000 1)。
2 结果与分析
2.1 不同供体细胞群体对髓系重建的影响
小鼠骨髓细胞包括造血干祖细胞及由其分化而来的不同谱系的成熟细胞,通常可通过标记造血干祖细胞表面标记物CD117来进行分离造血干细胞。本研究采用BMNCs以及CD117磁珠富集出的c-Kit+细胞作为供体细胞,同时对获得的供体细胞导入携带荧光标签的逆转录病毒载体以及分选等预处理以模拟对造血干细胞进行基因修饰操作,预处理后将获得的供体细胞群体移植入经致死剂量照射的受体小鼠体内进行后续检测(图1)。在移植2周后,对受体小鼠外周血进行流式分析,观察早期髓系比例变化,实验结果(图2)显示在CD45.2细胞群体内,全骨髓细胞移植组的髓系比例要高于c-Kit+细胞移植组,随着重建时间的延长,发现两组髓系比例均开始下降,最终两组达到同一水平且逐渐稳定。

图1 小鼠移植流程示意图Fig. 1 Schematic diagram of the mouse transplantation process
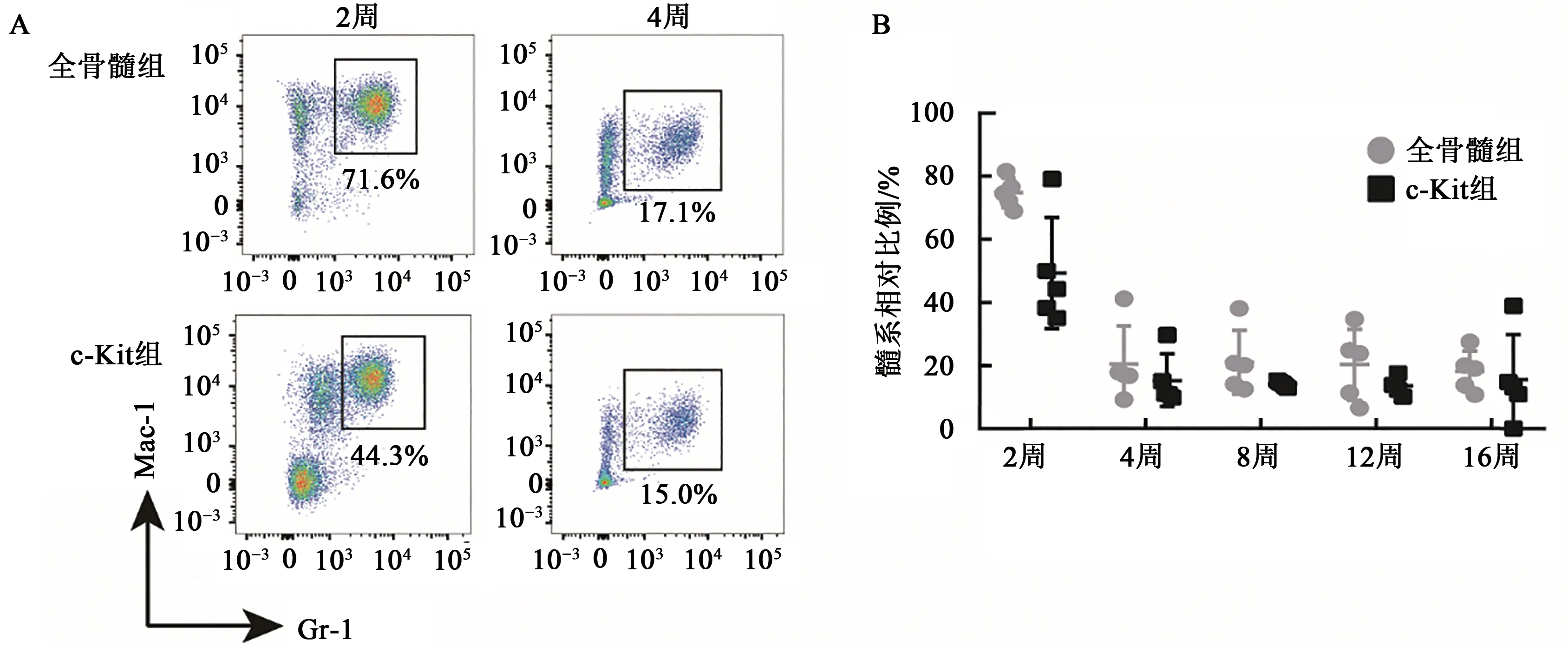
图2 移植后早期髓系比例变化Fig. 2 Change in myeloid proportions in the early stages after transplantation
2.2 不同供体细胞群体对嵌合比例的影响
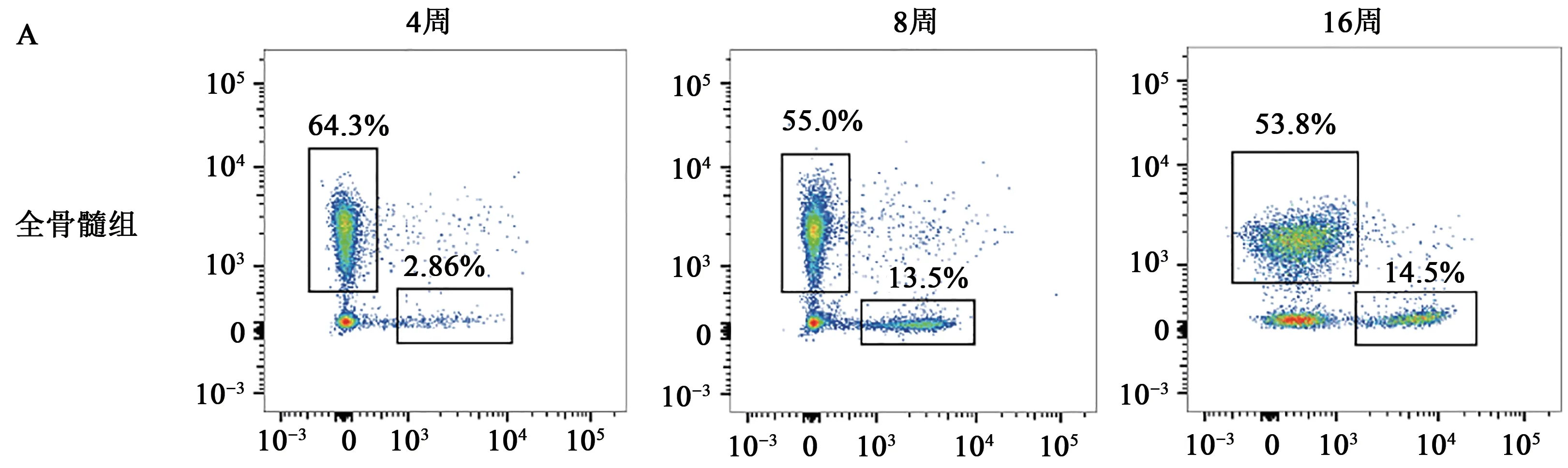
检测移植后的嵌合比例,可以作为判断受体细胞植入效果的另一个指标。本实验结果(图3)显示c-Kit+细胞移植组的嵌合比例要高于全骨髓移植组,表明c-Kit+细胞移植组的植入效率要优于BMNCs移植组。我们还发现虽然使用不同供体细胞均能使受体小鼠达到稳定的造血重建,但BMNCS移植组呈现出较大的个体差异,同组之内的均一性要与c-Kit+细胞移植组相比较差(图3)。除此之外,在对受体小鼠的嵌合率进行检测时,发现供体细胞导入的荧光载体出现明显荧光衰减的现象(图4)。针对此现象,设立不经流式细胞仪分选的实验对照组,对照组荧光水平则保持稳定,并未出现荧光衰减现象(图4)。此外,我们还对CD45.2内各个分群的细胞进行荧光检测以及统计,结果显示(图4),各个分群之间的细胞呈现出均一的荧光衰减现象。

图3 移植后供体细胞嵌合比例变化Fig. 3 Change in donor cell chimeric ratio after transplantation
2.3 不同供体细胞对长期造血重建的影响
造血系统中淋系的重建通常发生在移植后8周,可用于评价长期造血重建效果的指标。因此,我们检测受体鼠移植后外周血中T、B细胞的比例来探究不同的供体细胞对长期造血重建的影响。通过对两组移植小鼠8周内的外周血检测,我们发现B细胞在移植后4~8周开始重建,而T细胞的重建时间要晚于B细胞,且c-Kit+细胞移植组淋系重建要早于全骨髓移植组(图5)。除此之外,在对移植效果进行评估时,移植不良反应也是重要的观察指标。我们对两组移植小鼠进行外观表型检测发现,经全骨髓移植的小鼠在移植后出现脱毛、食欲不振等不良反应。此外,我们还发现全骨髓移植组小鼠的体质量增长要明显比c-Kit+移植组缓慢(图6)。
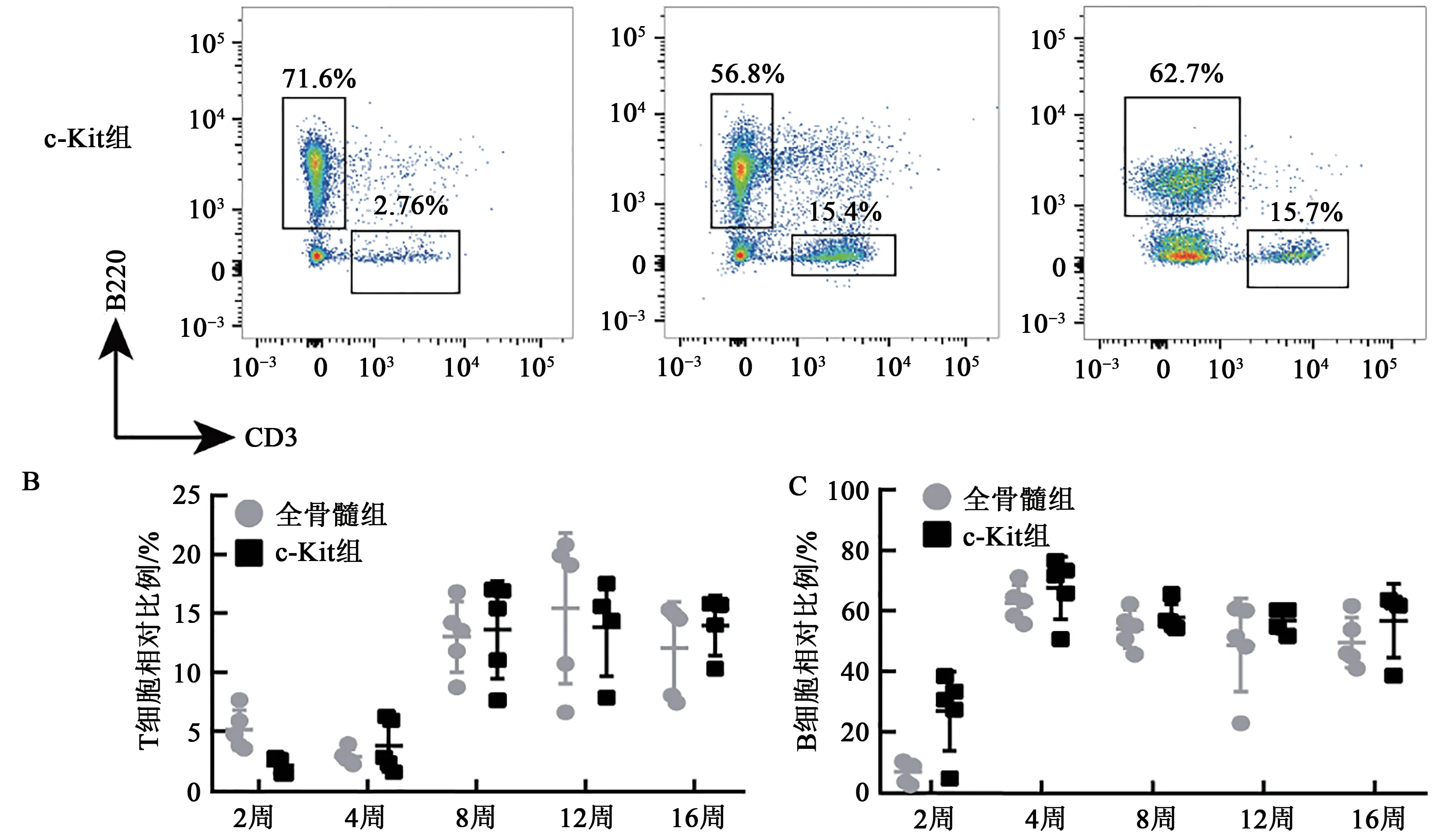
图5 移植后小鼠淋系重建情况Fig. 5 Radiant remodeling in mice after transplantation
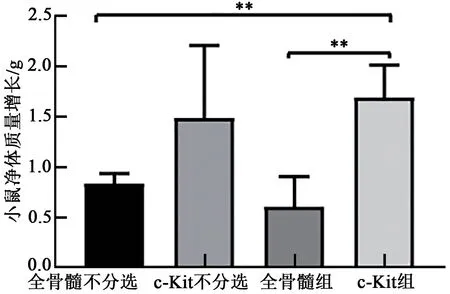
图6 移植后小鼠体重变化Fig. 6 Changes in mouse weight after transplantation
3 讨论
造血干细胞移植作为治疗多种血液系统以及自身免疫系统疾病的有效方案在临床上得到广泛应用。目前造血干细胞不仅可以作为“种子细胞”移植入病人体内,进行造血重建以及提高免疫功能,同时还可以作为“载体细胞”进行基因编辑达到对疾病的定向免疫治疗和基因治疗的目的[2,4]。除了应用于临床疾病治疗外,造血干细胞移植在基础研究中也是必不可少的技术手段。在实验过程中,供体细胞的选择以及对供体细胞做出的预处理都会影响移植效率,从而影响最终实验结果。目前已有研究证实,移植时采用不同类型的保护细胞以及受体骨髓微环境的差异对移植效果会产生不同的影响,但对于如何选择合适的供体细胞群体尚未有明确的研究[1,13-14]。与此同时,流式细胞分选技术作为近30年来飞速发展的一种实验技术,被广泛应用于基础研究及临床检测中。在造血干细胞移植过程中也会利用流式细胞分选技术对移植的供体细胞进行相应的纯化,但分选过程是否会影响移植效果也未有明确的定论。
本研究结果显示,在经过相同条件预处理情况下,使用全骨髓细胞以及c-Kit+细胞均可使受体鼠达到造血稳态水平,但利用磁珠富集得到较高纯度的HSPC进行移植对受体产生的影响最小。我们发现在利用全骨髓细胞移植时,并不能保证受体获得足够数量的造血干细胞,同时受体将被植入大量已分化的成熟细胞,极易导致受体出现免疫排斥等不良反应。而利用c-Kit+细胞进行移植时,虽然在短期造血重建上,髓系比例要低于全骨髓细胞移植组,但其长期造血中的T、B细胞重建早于全骨髓细胞移植组。推测其原因可能是全骨髓细胞移植组中已经含有大量成熟髓系细胞,因此在移植后短期内呈现出髓系比例高于c-Kit+细胞移植组。此前有研究表明,在移植的初期,造血干细胞及其后代暴露在辐照骨髓环境下会产生DNA损伤等“旁观者效应”,从而使植入的供体细胞无法迅速增殖分化[15-16]。我们的实验结果显示,c-Kit+细胞移植组比全骨髓细胞移植组出现更早的淋系重建,提示含有纯度更高HSC的c-Kit+移植组比全骨髓细胞移植组能够更快地摆脱辐照引起的负面“旁观者效应”。此外,除了本研究中检测的粒细胞以及淋系重建之外,血小板和红细胞的重建也是临床上重要的观察指标,但是由于红细胞与血小板发育成熟的特殊性,以及人与小鼠红细胞的差异性,使得红细胞和血小板的重建难以完整展现。在后续研究中或许可以通过使用人源化小鼠模型来实现相关研究[17]。另一方面,本研究通过流式细胞仪对供体细胞进行分选,结果发现虽然分选后得到的细胞也可以达到完全造血重建,但会出现荧光衰减现象。先前有研究报道,体内造血干细胞在分化过程中会导致SFFV启动子序列的广泛甲基化,从而使导入基因表达沉默[18],但我们的研究结果显示在向T细胞、B细胞以及髓系细胞分化过程中,细胞中荧光衰减的水平是一致的。因此,推测荧光衰减的原因为流式激光照射导致的细胞荧光载体淬灭现象,在一定程度上将导致后续实验中分析基因改造供体细胞对造血影响时分群不明确,最终影响实验结果。这提示我们在后续实验分析中不能完全通过荧光表达来区分细胞群体。通过以上的实验研究,我们发现不同处理条件下的供体细胞均可完成造血重建,但c-Kit+细胞移植组的重建效果要优于全骨髓细胞移植组。
造血干细胞移植的应用提高了血液系统疾病和免疫系统代谢性疾病等病人的治愈率和生存期。研究发现,造血干细胞移植后供体细胞内含有的造血干细胞数量以及状态是决定移植结果的关键因素[13]。本研究探究了2种最常见移植供体细胞群体的优劣以及流式分选对移植效果的影响,这些研究结果对于骨髓移植后如何促进早期重建、预防移植相关不良反应的发生具有一定参考价值。
