RGD修饰的低分子量鱼精蛋白/CpG ODN复合物的制备及抗肿瘤活性
2023-02-12刘佳佳苏秋东毕胜利
刘佳佳 苏秋东 伊 瑶 毕胜利
CpG寡聚脱氧核苷酸(CpG oligodeoxynucleotide, CpG ODN)是含非甲基化CpG基序的寡聚脱氧核苷酸,能与B淋巴细胞、树突状细胞、巨噬细胞表面的TLR9受体结合[1]。通过激活下游多种信号通路,诱发免疫级联反应,刺激机体产生强烈的先天性免疫应答及Th1型细胞免疫应答[2, 3]。CpG ODN强烈的免疫激活能力,使其在肿瘤治疗方面表现出极大的研究价值[4]。研究表明,CpG ODN单独使用时即可杀伤肿瘤细胞,发挥抗肿瘤效应,但其诱导的免疫应答强度尚不足以消除肿瘤,而将CpG ODN与其他免疫增强剂或利用基因载体进行靶向给药的方式可以显著增强其肿瘤治疗效果[5~8]。
细胞穿膜肽(cell-penetrating peptide,CPP)是一类具有细胞膜穿透功能的小分子多肽,长度通常为6~30个氨基酸,结构上富含精氨酸、赖氨酸等碱性氨基酸[9]。CPP作为基因递送载体可以携带多种生物大分子(蛋白、核酸、药物、纳米粒子等)进入细胞,在基因治疗、药物体内转运等研究领域具有很大的研究价值[10~12]。低分子量鱼精蛋白(low molecular weight protamine,LMWP)是由天然鱼精蛋白酶解后分离得到的一种阳离子多肽,具有典型的穿膜肽结构[13]。LMWP富含精氨酸,其自身带有的正电荷能有效结合并压缩带负电的核酸形成稳定的复合物[14]。同时LMWP携带核定位信号,有助于指导LMWP/核酸复合物向细胞核内转运,提高细胞内化效果,是一种安全有效的基因递送载体[15,16]。将LMWP作为载体介导抗肿瘤药物递送的研究已有报道,LMWP不仅能提高肿瘤治疗效果,而且治疗过程安全、不良反应小[17,18]。
本研究以肿瘤靶向序列RGD修饰的LMWP多肽作为载体,利用LMWP对核酸的结合特性装载CpG分子形成纳米复合物,通过检测其理化性质、细胞内分布情况及对肿瘤细胞生长的影响,探讨LMWP作为载体递送CpG ODN的可能性,及其对提高CpG ODN肿瘤治疗效果的作用。
材料与方法
1.试剂和仪器:CpG ODN和FAM修饰CpG ODN购自苏州泓迅生物科技股份有限公司;RGD-LMWP购自南京金斯瑞生物科技有限公司;Dulbeccco′s Modified Eagle′s Medium培养基、胎牛血清购自美国Hyclone公司;CCK-8试剂盒购自日本同仁公司;DiD荧光染料购自上海碧云天生物技术有限公司;实验用水为超纯水,其他试剂均为分析纯。紫外凝胶成像系统购自美国Bio-Rad公司;倒置荧光显微镜购自广州市明美光电技术有限公司;二氧化碳细胞培养箱、Multiskan GO多功能酶标仪购自美国Thermo公司;Nano-ZS粒径分析仪购自英国Malvern公司。
2.细胞株:人子宫颈癌细胞株(HeLa)为中国疾病预防控制中心病毒病预防控制所保存。采用含10%胎牛血清的DMEM 培养基于37℃、5% CO2的细胞培养箱中连续培养,取对数生长期的细胞进行相关实验。
3.RGD-LMWP/CpG复合物的制备:将RGD-LMWP和CpG冻干粉分别用去离子水溶解,CpG质量浓度恒定为0.2mg/ml,按照RGD-LMWP与CpG质量比为1∶1、2∶1、3∶1、4∶1、5∶1、6∶1的比例,将CpG加入到等体积不同质量浓度的RGD-LMWP溶液中,涡旋混匀后室温静置30min,即获得不同质量比的RGD-LMWP/CpG复合物。
4.RGD-LMWP/CpG复合物的凝胶阻滞分析:采用琼脂糖凝胶电泳实验分析RGD-LMWP对CpG的包裹能力。称取适量琼脂糖制备1%琼脂糖凝胶(0.5μg/ml),将制得的不同质量比RGD-LMWP/CpG复合物与上样缓冲液混匀后进行电泳(90V,20min),置于凝胶成像系统中观察并拍照。
5.RGD-LMWP/CpG复合物的理化性质表征:取2ml制得的不同质量比RGD-LMWP/CpG复合物,使用激光粒径分析仪对复合物的粒径大小与zeta电位进行检测。
6.肿瘤细胞摄取实验:取对数生长期的HeLa细胞接种于24孔板中,在37℃、5% CO2培养箱中培养使细胞贴壁。将RGD-LMWP与带有FAM荧光基团修饰的CpG按质量比为3∶1制备复合物,每孔加入含5μg CpG的复合物,在培养箱中孵育4h。弃去培养基,用磷酸盐缓冲液(phosphate buffered saline, PBS)漂洗2次后,加入DiD荧光染料,继续在培养箱中孵育30min,弃去培养基,用PBS漂洗2次后,使用倒置荧光显微镜下观察荧光的分布情况。
7.抑制肿瘤细胞增殖实验:采用CCK-8法评估复合物的抗肿瘤细胞增殖能力。将处于对数生长期的HeLa细胞接种于96孔板中(细胞密度为103个/孔),在37℃、5% CO2培养箱中培养过夜使细胞贴壁。用DMEM培养基对RGD-LMWP/CpG(质量比为3∶1)复合物进行倍比稀释,保证CpG的质量浓度梯度为6.25、12.5、25、50、100、200μg/ml。吸去96孔板中的原培养液,用PBS漂洗2次后,加入稀释好的复合物溶液100微升/孔,在培养箱中继续培养。培养24h后,向每孔加入10μl CCK-8溶液,在培养箱中孵育30min后,用酶标仪测定各孔在450nm处的吸光度值,并按下列公式计算细胞存活率:细胞存活率(%)=[(As-Ab)/(Ac-Ab)]×100%,其中As为实验孔(含有细胞的培养基、CCK-8、待测物质);Ac为对照孔(含有细胞的培养基、CCK-8、无待测物质);Ab为空白孔(不含有细胞和待测物质的培养基、CCK-8)。
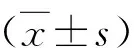
结 果
1.RGD-LMWP多肽的纯度鉴定:采用固相合成法合成RGD-LMWP多肽(南京金斯瑞生物科技有限公司),高效液相色谱分析以及质谱分析结果显示,合成RGD-LMWP多肽的相对分子质量为3656.23kDa,纯度为95.2%。对其进行溶解度测试,RGD-LMWP多肽可溶于超纯水和PBS,详见图1、图2。

图1 RGD-LMWP的高效液相色谱分析

图2 RGD-LMWP的质谱分析
2.RGD-LMWP/CpG复合物的凝胶阻滞结果:凝胶阻滞分析可以反映RGD-LMWP对CpG的包裹压缩能力。游离CpG可与核酸染料结合,随电场发生迁移,在紫外线照射下可观察到明显的荧光条带;RGD-LMWP带正电,可与CpG通过静电吸附缩合成稳定的复合物,阻止CpG与荧光染料的结合。当RGD-LMWP/CpG的质量比<3时可观察到条带,说明CpG未完全被缩合,体系中仍有游离CpG在电场作用下发生迁移;随着RGD-LMWP/CpG质量比的增大,LMWP对CpG的缩合能力增强,可迁移的游离CpG逐渐减少;当质量比≥3时,CpG完全被鱼精蛋白包裹,无迁移现象发生,故观察不到条带,详见图3。

图3 RGD-LMWP/CpG复合物的凝胶阻滞电泳图泳道1.CpG;泳道2~6.RGD-LMWP/CpG的质量比分别为1∶1、2∶1、3∶1、4∶1、5∶1、6∶1
3.RGD-LMWP/CpG复合物的表征:复合物的粒径和表面电位对目的基因能否有效转运至靶细胞具有重要的参考意义。通常粒径为100~200nm,表面单位带正电荷的颗粒更有利于细胞的内化[19]。采用激光粒径分析仪对不同质量比RGD-LMWP/CpG合物的粒径、zeta电位及多分散系数进行了检测,结果显示,随着RGD-LMWP/CpG质量比的升高,复合物的粒径由112.1±0.5nm升高至135.2±2.4nm,呈逐渐增大趋势;而zeta电位的变化趋势不明显,在40mV左右。这表明RGD-LMWP和CpG可以通过静电作用结合形成复合物,并在溶液中均匀分布,而且该复合物还具备被细胞摄取的有利条件。综合考虑以上参数以及后续实验剂量需求,本研究最终选择以质量比3∶1形成的RGD-LMWP/CpG复合物(粒径119.7±1.2nm,zeta电位47.9±0.5mV)作为研究对象继续开展体外细胞实验,详见表1和图4。

图4 不同质量比RGD-LMWP/CpG复合物粒径和电位的差异A.粒径大小;B.zeta电位

表1 不同纳米复合物的粒径分布和zeta电位比较
4.肿瘤细胞摄取实验:将带有FAM荧光基团修饰的游离CpG和RGD-LMWP/CpG复合物分别作用于HeLa细胞,根据HeLa细胞内是否有绿色荧光以及荧光强度进行细胞摄取效率的评价。倒置荧光显微镜结果显示,CpG组HeLa细胞内的绿色荧光较少,说明HeLa细胞对游离CpG的摄取效率较低;RGD-LMWP/CpG(3∶1)复合物组的细胞内分布有大量绿色荧光,说明在细胞穿膜肽RGD-LMWP的转运下,肿瘤细胞对CpG的摄取效率显著增强,详见图5。

图5 HeLa细胞对各组药物的摄取情况(×400)A.游离CpG组;B.RGD-LMWP/CpG复合物组
5.抑制肿瘤细胞增殖实验:采用CCK-8法比较不同浓度的RGD-LMWP/CpG(3∶1)复合物对HeLa细胞增殖能力的影响。结果显示,将RGD-LMWP多肽单独作用于HeLa细胞时,随RGD-LMWP使用剂量的升高,HeLa细胞的增殖能力受到轻微影响,但并未出现明显的细胞毒性,说明RGD-LMWP是一种相对安全的基因载体。与单独使用CpG比较,RGD-LMWP/CpG复合物能够显著抑制肿瘤HeLa细胞的增殖,且使用剂量越高,抑制效果越明显。当CpG使用剂量≤50μg/ml时,复合物组和游离CpG组的细胞存活率比较,差异无统计学意义;当CpG使用剂量>50μg/ml时,复合物组和游离CpG组的细胞存活率开始出现差异,且剂量达到100μg/ml时,两组的细胞存活率分别为31.93%和80.70%(P<0.01)。这些结果表明,RGD-LMWP与CpG形成复合物后,可以有效地将CpG递送至肿瘤细胞发挥抗肿瘤活性,是一种相对安全有效的给药系统,详见图6。

图6 RGD-LMWP/CpG复合物对Hela细胞的抑制作用
讨 论
LMWP作为一种天然非病毒载体,可利用其跨膜功能携带多种外源性分子进入细胞,且不影响所携带分子的生物活性[17]。多项研究肯定了LMWP作为载体介导基因给药的优势,利用LMWP递送FER-siRNA可有效抑制乳腺癌细胞的增殖[20];LMWP还可以通过多种跨膜途径增强药物细胞内递送和肿瘤穿透的效率从而改善耐药型癌症的治疗效果[21]。为提高CpG的抗肿瘤能力,本研究利用LMWP的核酸结合特性,将其与CpG作用形成纳米复合物,并对复合物的肿瘤治疗效果进行实验室评价。同时,为提高转运的靶向性,本研究对LMWP进行了RGD(精氨酸、甘氨酸和天门冬氨酸)修饰,RGD序列可以靶向于整合素过表达的肿瘤细胞或肿瘤内皮血管,是一种常见的提高肿瘤药物递送效率的修饰方法[22,23]。
首先,为验证RGD-LMWP和CpG能否通过静电引力结合成复合物,本研究采用凝胶电泳对RGD-LMWP和CpG的结合能力进行了分析,结果显示,当RGD-LMWP/CpG的质量比≥3时,已经检测不到游离CpG的存在,说明通过简单的静电结合可以实现RGD-LMWP对CpG的完全缩合。对复合物粒径、zeta电位和多分散系数的检测说明RGD-LMWP与CpG结合后不仅能以颗粒状态均匀存在,且具备被细胞摄取的有利条件。一方面,RGD-LMWP/CpG复合物表面携带的正电荷有利于其与细胞膜表面的负电基团结合而黏附于细胞膜上;另一方面,RGD-LMWP/CpG复合物的粒径优势100~200nm以及LMWP的跨膜转运能力有利于其通过多种途径被细胞内化,进入细胞发挥作用。
体外细胞实验是检测物质活性、评价药效的基础内容。将得到的RGD-LMWP/CpG(3∶1)复合物(粒径119.7±1.2nm,zeta电位47.9±0.5mV)作用于肿瘤细胞分析其对细胞摄取效率和肿瘤细胞增殖能力的影响。与游离CpG比较,RGD-LMWP/CpG复合物进入肿瘤细胞的能力更强,对肿瘤细胞生长的抑制作用更明显,这说明RGD-LMWP通过与CpG结合形成复合物,利用复合物的粒径和电位优势可以有效地将CpG输送至肿瘤细胞中,继而发挥抗肿瘤作用。但是,目前尚不清楚CpG是以与RG -LMWP结合成复合物的状态还是从复合物中分离出来的状态在细胞内发挥作用的,更多细胞动力学机制仍需开展进一步研究。
综上所述,本研究成功采用阳离子多肽RGD-LMWP静电结合CpG的方法制备得到了RGD-LMWP/CpG复合物,该复合物能实现CpG向肿瘤细胞内的有效传递,并发挥其抑制肿瘤细胞增殖的作用,为增强CpG的抗肿瘤效果提供了新的研究思路。
