基于组织芯片技术探讨GLUT10在主动脉夹层发病机制中的作用
2023-02-12简丽娟陈远洋邢凯胡知朋
简丽娟 吴 琪 陈远洋 邢凯 胡知朋
主动脉夹层(aortic dissection,AD)是指主动脉内的血液从主动脉内膜撕裂处进入主动脉中膜,使中膜分离,沿主动脉长轴方向扩展形成主动脉壁的真假两腔分离状态,一旦治疗不及时,病死率极高,它具有起病急骤、病情凶险等特点,是一种极为凶险的心血管疾病。AD的发生、发展与许多流行病学因素有关,其中最常见的诱因有高血压、年龄、血脂异常和结缔组织的遗传疾病等。一般情况下,其病理过程复杂,与主动脉中层退行性变及主动脉壁炎性细胞浸润密切相关,以血管平滑肌细胞(vascular smooth muscle cell, VSMC)丢失、破裂、失效为特征[1]。及早发现、早期干预、及时治疗对AD患者预后有极大的帮助,因此,有必要了解其具体发病机制。
GLUT10的编码基因SLC2A10单基因突变容易导致动脉迂曲综合征,主要表现为大中动脉的延长、弯曲和狭窄,并有动脉夹层形成的倾向。在组织病理学上,它与动脉壁中的弹性纤维碎裂和组织混乱有关[2]。GLUT10在VSMC中高度表达,并部分定位于线粒体。Syu等[3]研究表明,GLUT10靶向线粒体对维持VSMC中氧化还原稳态、线粒体结构和线粒体功能至关重要。GLUT10的错义突变会损害VSMC中的线粒体靶向性,表现为活性氧水平升高、线粒体破碎、线粒体功能受损以及细胞增殖和迁移增强。
本研究通过人体组织芯片实验和GLUT10慢病毒敲低VSMC进行转染来研究主动脉组织中GLUT10的表达水平与AD的相关性和机制。
对象与方法
1.研究对象:选取2018年1~11月于武汉大学人民医院确诊为AD患者并行全主动脉弓置换的27例患者为夹层组,所有患者均经过计算机体层摄影血管造影(computed tomography angiography,CTA)检查确诊为AD。纳入标准:①符合AD诊断标准[4];②年龄>18岁;③病史清晰;④标本完整;⑤患者知情同意。排除标准:①合并肝脏、肾脏等其他重要器官疾病;②合并恶性肿瘤;③合并其他血管疾病。患者均在入院后行急诊手术,术中取AD患者病变组织。组织取出后用预冷的0.9%氯化钠溶液漂洗,部分冻存于液氮中,部分用4%多聚甲醛固定,石蜡包埋用于制作组织芯片。另选取18例心脏移植患者作为对照组(此18例患者均无大血管疾病,其在心脏移植术中取下的心脏主动脉血管可作为相对正常主动脉血管组织)。术前所有实验方案均已告知家属,并签署知情同意书,本研究经武汉大学人民医院医学伦理学委员会审批(伦理审批号: WDRY2015-K021)。
2.实验细胞来源及病毒转染:原代血管平滑肌细胞购自武汉普诺赛生命科技有限公司,将购得的细胞培养瓶放入37℃、5%CO2、饱和湿度的细胞培养箱中静置3~4h以稳定细胞状态,吸出培养基,用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗细胞1次;添加0.25%胰酶1ml至T25培养瓶中,轻微转动培养瓶至胰酶覆盖整个培养瓶底后,吸出多余胰酶,37℃温浴1~3min;显微镜下观察,待细胞回缩变圆后,再加入5ml DEM/F12培养基终止消化;用吸管轻轻吹打混匀,按传代比例接种于60mm×15mm培养皿中传代,然后补充新鲜的DEM/F12培养基至3ml,置于37℃、5%CO2、饱和湿度的细胞培养箱中静置培养;待细胞完全贴壁后,在显微镜下观察VSMC的形态进行鉴别,培养稳定后进行传代,对传代细胞随机分为两组:GLUT10敲低组加入适量GLUT10慢病毒及助转染试剂,对照组加入适量对照慢病毒及助转染试剂,放入37℃、5%CO2、饱和湿度的细胞培养箱中静置转染,48h取出至新倒置显微镜下观察细胞转染情况,随机拍片,后提取细胞蛋白用于后续实验。
3.实验试剂:GLUT10抗体购自美国Santa Cruz Biotechnology公司;GLUT10慢病毒、助转染试剂均购自山东维真生物科技有限公司;Vinculin抗体、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)抗体、钙调宁蛋白(calponin 1, CNN1)抗体、平滑肌22α蛋白(smooth muscle 22α, SM22α)抗体、α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)抗体、抗兔二抗均购自武汉赛维尔生物科技有限公司;基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)抗体购自生工生物工程(上海)股份有限公司。
4.Western blot法检测:按照分组要求处理细胞后,加入含有适量比例Cocktail及PMSF蛋白酶抑制剂的RIPA裂解液,用细胞刷刮净细胞至1.5ml EP管中,所得样品置于冰上超声碎裂。根据所获得蛋白上清液的体积,以适当的比例加入5×蛋白上样缓冲液混匀,100℃金属浴15min, 所获蛋白样本冻存于-80℃冰箱中。每孔蛋白上样量为5μg,电泳电压90V,电流40mA,以10% SDS-聚丙烯酰胺凝胶(SDS-PAGE)进行Western blot法电泳。在电流200mA、电压100V条件下,电转2.5h。其后PBST洗膜,5%脱脂奶粉封闭1h,一抗4℃摇床孵育过夜,以Vinculin为内参,以山羊抗兔荧光二抗显影,在Odessy荧光扫膜系统上扫膜,并对结果进行半定量分析。
5.免疫组化实验:各组标本经4%多聚甲醛溶液固定,石蜡包埋后进行切片。选取适量切片后将其置于65℃恒温烘箱中加热融蜡2h,然后放入二甲苯溶液中脱去残留的石蜡,进行常规的水化步骤后用PBS漂洗。用Triton试剂破膜15min,而后在枸橼酸缓冲溶液中进行微波加热修复。自然冷却后,用3%过氧化氢溶液消除内源性过氧化物酶,血清常温封闭1h,一抗4℃孵育过夜。室温复温1h,二抗避光孵育1h。用DAB染色液在显微镜下显色,显色后苏木精染核,盐酸乙醇分化,漂洗干净后进行风干,中性树脂封片,最后在全自动显微镜下观察拍照。
6.统计学方法:应用Graghpad统计学软件对数据进行统计分析,至少取5次独立实验结果。计量资料的两组间比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1.组织芯片中主动脉组织的GLUT10表达:组织芯片的免疫组化染色发现,夹层组患者的主动脉组织中GLUT10的表达(棕色代表阳性信号)较对照组低,且夹层组与对照组比较,差异有统计学意义(P<0.05,图1、图2)。
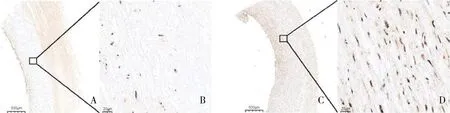
图1 夹层组和对照组GLUT10的免疫组化染色A.夹层组(×30);B.夹层组(×400);C.对照组(×30);D.对照组(×400)

图2 组织芯片中夹层组和对照组GLUT10表达差异的统计图
2.GLUT10慢病毒转染VSMC后相关蛋白的表达:用GLUT10慢病毒转染VSMC 48h后,在新倒置显微镜下观察,发现VSMC转染成功(图3),提取细胞蛋白进行Western blot法检测,发现GLUT10敲低组PCNA、MMP2的表达水平较对照组增高,而GLUT10、α-SMA、SM22α、CNN1表达水平均较对照组明显下降,且差异均有统计学意义(图4)。
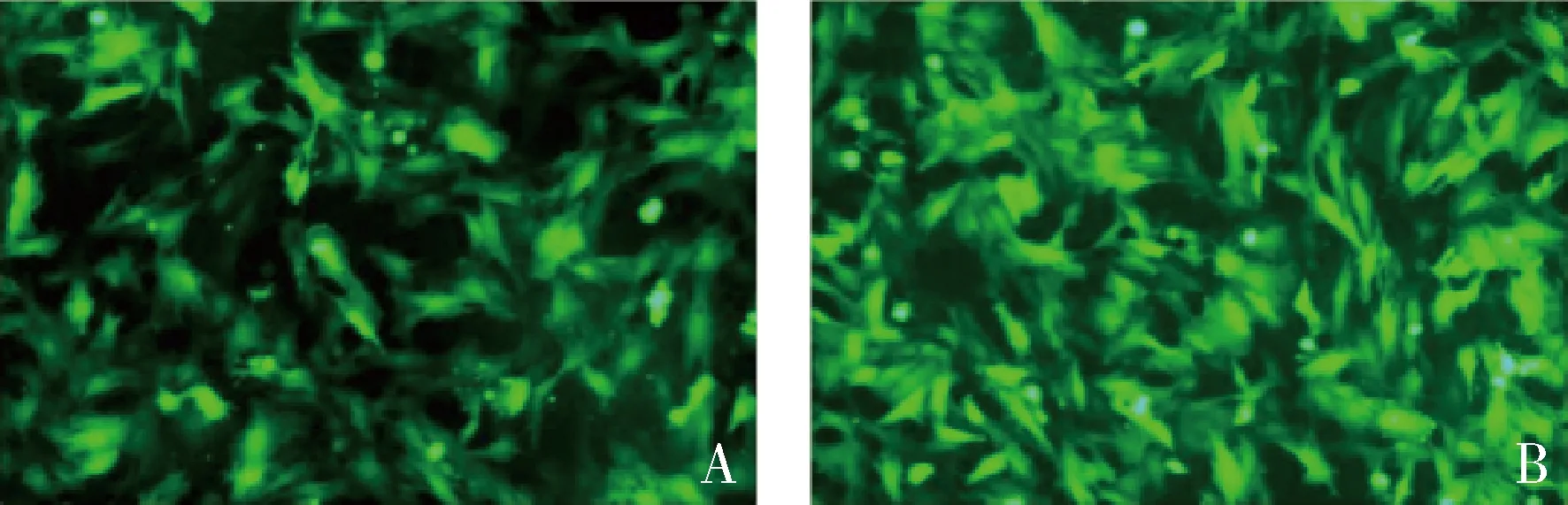
图3 GLUT10敲低组和对照组病毒转染细胞成功结果A.GLUT10敲低组;B.对照组

图4 转染细胞提取蛋白Western blot法实验结果A.Western blot法检测VSMC中GLUT10、CNN1、α-SMA、SM22α、PCNA、MMP2、Vinculin的表达结果;B.GLUT10敲低组和对照组中相关蛋白的表达差异
讨 论
《2021年中国心外科手术和体外循环数据白皮书》显示,近年来我国主动脉夹层诊断数量迅速攀升,这既是诊断水平提高的结果,也体现了现代生活方式下AD发病水平增高,由传统观念中的“罕见病”转成了“常见病”[5]。AD是人体最凶险、病死率最高的疾病,其一旦破裂,患者将在几分钟内死亡,无法抢救。如果没有及时发现和救治,AD患者发病后48h内病死率为50%~68%,发病3个月内病死率高达90%[6]。明确AD发病机制对AD的早期预防和救治均至关重要,但其发生、发展过程错综复杂,主要以主动脉中膜退行性变为基础,伴主动脉炎性细胞浸润、平滑肌细胞增殖、迁移、表型转化、氧化应激、细胞外基质降解等病理生理过程,共同促进AD的发生、发展。
GLUT10作为一种葡萄糖转运体蛋白,通过转运葡萄糖等营养物质进入组织内,从而使组织获得能量,维持机体生命所需。有研究表明,GLUT10是脱氢抗坏血酸的转运体,其基因突变可使平滑肌细胞的氧化应激产物水平明显升高,线粒体碎片化和功能受损[3,7]。当GLUT10功能缺失时,其可能通过上调动脉壁中的转化生长因子-β(transforming growth factor-β,TGF-β)信号通路诱导细胞增殖减少、上皮间充质转化、细胞外基质紊乱导致血管重塑[8~10]。
本研究结果发现,AD患者的主动脉组织中的GLUT10的表达水平较正常主动脉组织明显降低,提示GLUT10的表达在一定条件下调节主动脉生物学功能,其表达的降低将会使主动脉的正常功能紊乱,促进AD的发生、发展。GLUT10不仅在人VSMC中高度表达,还在大鼠VSMC中表达[11,12]。既往研究发现,GLUT10基因的功能缺失突变会导致动脉迂曲综合征,这是一种常染色体隐性遗传病,以动脉迂曲、动脉瘤和大中型动脉狭窄为特征。特别是在动脉迂曲综合征患者中,GLUT10突变导致了主动脉VSMC中GLUT mRNA/蛋白的显著下调和动脉中层弹性纤维的破坏,并伴有转化生长因子-β信号的上调[13]。Lee等[14]研究表明,在VCSM中表达的GLUT10介导氧化形式的维生素C转运到线粒体,从而保护血管细胞免受氧化应激。因此,GLUT10通过葡萄糖转运以外的机制维持血管壁的完整性,在血管系统中发挥着关键作用。为了进一步验证GLUT10在主动脉中的作用,本研究对大鼠的VSMC用GLUT10慢病毒敲低进行了转染,转染后Western blot法检测显示,GLUT10表达水平较对照组明显降低,证明GLUT10慢病毒转染有效。
AD的发病是由多种病理变化相互作用导致,其中主要的病理变化为VSMC的增殖紊乱,VSMC表型由收缩型向分泌型转化以及细胞外基质的大量降解[15~17]。PCNA与细胞DNA合成密切相关,是反映细胞增殖状态的良好指标[18]。α-SMA、SM22α、CNN1是平滑肌细胞的主要标志物,作为收缩蛋白参与细胞骨架的构成[19,20]。MMP能够水解细胞内的各种蛋白,其水平的升高可导致细胞外基质大量降解,细胞功能受损,其中MMP2和MMP9与AD的发病密切相关[21,22]。为了进一步研究GLUT10在AD中的作用,本研究对提取的转染细胞蛋白进行上述相关蛋白检测,发现GLUT10慢病毒敲低转染的细胞中细胞周期蛋白PCNA及MMP2的表达较对照转染组明显增高,而骨架蛋白α-SMA、SM22α、CNN1较对照组明显下降,提示GLUT10与VSMC的增殖、表型转换以及细胞外基质降解等有关,进一步说明GLUT10在维持主动脉血管平滑肌细胞正常生物学功能中发挥重要作用,缺失致主动脉重构、增加主动脉夹层易感性。
综上所述,GLUT10表达对主动脉夹层的发生、发展具有重要作用,维持GLUT10在血管平滑肌细胞中的表达水平对主动脉夹层的预防及治疗都是非常有益的。未来可以通过监测主动脉平滑肌细胞中GLUT10的表达水平来预测主动脉疾病的发病风险。对GLUT10在主动脉夹层中的具体发病机制进一步探索,GLUT10特异性表达于血管平滑肌细胞,有望成为主动脉夹层治疗的新靶点。
