肠道吸收细胞模型研究进展及其在类胡萝卜素上的应用
2023-02-12吴雨卿倪元颖
吴 帆,陈 楠,吴雨卿,倪元颖,温 馨
(中国农业大学食品科学与营养工程学院,北京 100083)
食物中的膳食营养成分对于维持人体健康至关重要。在维持温饱的条件下,世界上仍有数百万人营养不良,且越来越多的研究表明,70%以上的慢性死亡与膳食营养成分密切相关[1]。保证人体摄入足够膳食化合物的基础上,如何高效发挥其功能活性至关重要。为了保证膳食化合物在人体内发挥作用,其必须在消化过程中从食物基质中释放出来,被人体肠道上皮细胞吸收且被分配到靶组织利用,而在吸收利用过程中,膳食化合物会受到食物基质、加工方法以及膳食成分等因素影响,导致吸收利用程度发生变化,从而造成功能活性发挥效果的不同。因此,探究膳食化合物等食物成分在人体内吸收利用过程的影响因素,提高吸收利用程度,对于实现膳食化合物功能活性的高效发挥具有重要意义。
膳食成分在人体的吸收利用程度常用生物可及性和生物利用度这两个指标进行评估:生物可及性是指膳食化合物等经过口腔、胃肠道消化,可被小肠细胞吸收的部分;生物利用度是指吸收的物质中可参与体循环,用于正常生理功能或在人体中存储的比例[2]。生物可及性和生物利用度可采用动物实验或人体实验进行探究,但其存在伦理、成本高、实验周期长等问题,导致适用性差。体外肠道吸收细胞模型是基于人体内胃肠道结构功能和生理环境,体外研究膳食化合物等食物成分在人体内吸收利用度的技术手段。利用体外模拟胃肠消化模型联合细胞吸收模型能够更加方便、快速、高效地模拟人体对食物的消化和吸收[3],从而获得不同类型和来源的膳食化合物的生物可及性和生物利用度。目前,体外胃肠消化模型通过设置恒定的膳食与口腔、胃和小肠消化液的比例,真实还原体内消化环境,已实现标准化[4-5],且经过进一步修正已成功应用于膳食化合物的体外消化[6-7]。同时,肠道细胞吸收模型正在迅速发展且广泛应用,已实现单层细胞模型到共培养细胞模型、2D模型到3D模型、静态细胞吸收模型到动态细胞吸收模型的发展,成为研究膳食化合物等食物成分的有力工具,但目前仍没有能够较好地模拟人体肠道细胞结构和生理环境的标准化肠道细胞吸收模型。
因此,本文综述人体肠道细胞结构和功能,总结现有的体外肠道细胞吸收模型研究进展,同时以类胡萝卜素为代表,探讨体外肠道细胞吸收模型在模拟人体类胡萝卜素肠道吸收上的应用,并对利用体外肠道细胞吸收模型研究膳食化合物吸收转运的发展方向进行展望,以期为利用体外肠道细胞吸收模型研究人体膳食化合物的吸收利用提供借鉴。
1 人体肠道细胞结构和功能
肠道是人体吸收营养物质的关键部位,明确不同肠道细胞的结构和功能对于研究营养物质在人体的生物利用度以及模拟构建体外细胞吸收模型极其重要。在人体肠道中,肠黏膜上皮组织作为一道“吸收性屏障”能够实现肠道的主要功能,其主要由选择性吸收营养物质的肠上皮细胞、分泌黏蛋白的杯状细胞、呈递抗原的微褶皱细胞和分泌溶菌酶的潘氏细胞等构成[8-10](图1)。其中肠上皮细胞间连接方式主要包括紧密连接、黏附连接、桥粒连接和缝隙连接4 种[11],而紧密连接是最重要的连接方式,通过封闭细胞间隙,形成了连续的质膜融合带,可防止细胞间隙中的物质或外部物质进入细胞间隙时溢出[12-13]。此外,根据空间位置的不同,肠黏膜分为顶端膜(又称肠腔侧膜)和基底侧膜[14],二者已成为物质经肠黏膜上皮细胞吸收利用的基本途径。肠黏膜上皮组织表面存在一些微小的凸起绒毛,绒毛的存在大大增加了肠道内壁的表面积,从而实现对食物营养物质的最大吸收。肠绒毛下凹进入固有层形成肠腺,肠腺开口即为隐窝,隐窝处存在大量的肠干细胞[15],这些干细胞通过“不对称分裂”的方式沿着隐窝纵轴向上迁移至顶部绒毛上层[8],影响肠道上皮细胞的更新换代。

图1 人体肠道细胞结构[16]Fig.1 Structure of human intestinal cells[16]
2 体外肠道吸收细胞模型研究进展
为全面模拟人体肠道细胞吸收环境,近年来体外肠道吸收细胞模型逐渐完善,主要分为单细胞培养模型、共培养模型、3D模型以及微流体模型4 类。
2.1 单细胞培养模型
目前用于营养功能物质肠道吸收研究的细胞主要是Caco-2细胞,其来源于人结肠癌细胞,具有结构简单、适用性广且成本较低等优点[17],且能够表达肠道内大多数细胞的形态和生理功能,可作为肠道吸收细胞模型优化的基础细胞。Caco-2细胞模型的建立如图2所示,将Caco-2细胞培养在Transwell上腔室,培养期间细胞生长聚合,自发分化,细胞顶部(肠腔侧)逐渐形成具有微绒毛的刷状缘,细胞之间形成紧密连接,并可以表达多种转运蛋白和代谢酶类,最终形成一层极化的吸收性肠细胞层[18]。该细胞模型应用广泛,常与体外消化模型结合,用于模拟营养功能物质在人体内的消化吸收过程,在食品和医药等方面具有重要研究作用。
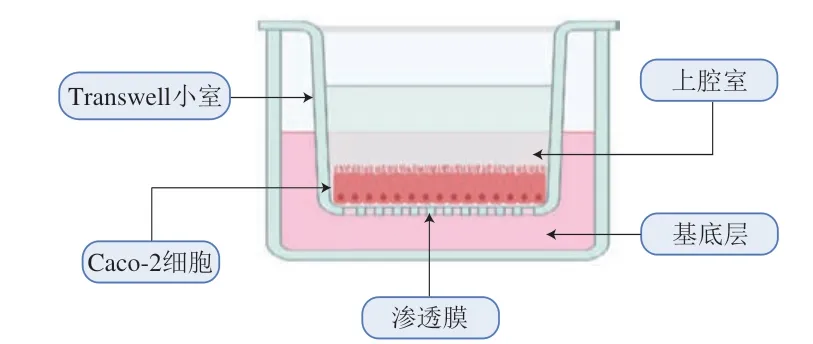
图2 Caco-2细胞模型示意图[17]Fig.2 Schematic diagram of Caco-2 cell model[17]
Caco-2单细胞模型虽然是目前应用最广泛的肠道吸收细胞模型,但其也存在一些问题。该细胞模型是静态细胞模型,无法模拟肠道细胞动态变化过程,缺乏黏液层,且无法在刷状缘微绒毛的表面高效表达所有肠道细胞转运蛋白,难以高度模拟人体肠道细胞的生理条件和结构功能。因此,为更好地模拟人体肠道吸收过程,需要在Caco-2单细胞模型的基础上结合现代科技仪器和理论知识进一步建立更贴近真实肠道细胞的体外细胞模型以满足不同研究需求。
2.2 共培养模型
人体肠道细胞是由不同种类、不同功能的细胞类群组成的,其吸收功能需要多细胞协作实现,因此,将不同特性的单细胞模型利用细胞共培养技术构建更贴近实际的体外肠道细胞模型就显得尤为必要。肠道细胞共培养模型主要是以Caco-2细胞模型为基础,结合其他细胞形成更成熟的体外肠道细胞模型,目前应用较多的主要包括Caco-2/HT29-MTX细胞共培养模型和Caco-2/靶细胞共培养模型两大类。
2.2.1 Caco-2/HT29-MTX细胞共培养模型
通过改变培养条件,可以使HT29细胞以不同路径分化,形成具有不同功能的肠道细胞[19]。其中,HT29-MTX细胞是由HT29细胞定向分化而来的杯状细胞,其可以分泌黏液,从而更加真实地模拟肠道细胞黏液层吸收屏障功能[20]。利用Caco-2细胞模型提供紧密细胞结构,保障细胞屏障功能,同时利用HT29-MTX细胞分泌黏液生成黏液层,进一步巩固细胞屏障功能,构建Caco-2/HT29-MTX细胞共培养模型,能够更好地模拟人体肠道细胞的结构功能和生理条件。Caco-2/HT29-MTX共培养细胞模型主要用于模拟人体肠道细胞对营养功能物质的吸收及对细胞屏障功能影响的研究,但在模型建立过程中,由于两种细胞生长速度不一致,且不同的细胞比例会产生不同的实验结果,因此需要根据实际情况调整两种细胞比例及定向培养HT29-MTX细胞的条件。现有研究表明,Caco-2细胞与HT29-MTX细胞个数比为9∶1时[21-22],共培养模型最接近人体肠道细胞。Caco-2/HT29-MTX细胞模型如图3所示。
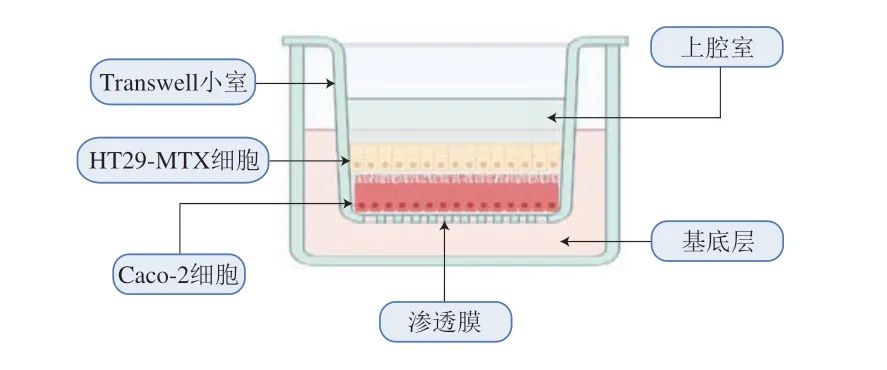
图3 Caco-2/HT29-MTX细胞模型示意图[23]Fig.3 Schematic diagram of Caco-2/HT29-MTX cell model[23]
2.2.2 Caco-2/靶细胞共培养模型
Caco-2细胞可与人体内可分泌内源性介质的肝细胞和免疫细胞等结合,构建分层共培养模型,以研究功能活性物质经吸收后的功效表达效果。如图4所示,将生长在Transwell上腔室内的Caco-2单细胞层与基底层中的靶细胞间隔培养,模拟人体吸收物质后发挥功能活性的作用机制,该模型主要应用于肠道细胞免疫机理以及毒理学方面研究,但目前鲜见其在膳食化合物吸收研究中的应用。
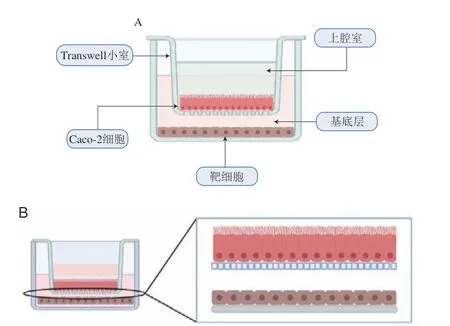
图4 Caco-2/靶细胞模型(A)及分层共培养示意图(B)[23]Fig.4 Schematic diagram of Caco-2/target cell model (A) and layered co-culture (B)[23]
共培养细胞模型可以在一定程度上弥补单细胞模型的缺陷,进一步真实模拟人体肠道细胞功能,但其在模型构建时需考虑不同种类细胞特性,其培养条件严格、过程繁琐、不确定因素较多,且单细胞和共培养模型中的细胞间作用仅限于水平面,无法重现肠道细胞立体作用;因此,需更深入研究方便快速且能够重现肠道细胞环境的体外细胞模型。此外,肠道细胞中黏液层的面积及黏液中黏蛋白浓度等会对膳食化合物的吸收利用产生影响,但体外细胞模型中黏液层对膳食化合物吸收利用的影响目前研究较少,其影响机制需进一步研究。
2.3 3D模型
随着现代科学技术的进步,干细胞、类器官研究兴起,为进一步模拟人体肠道细胞的真实状态,研究者们在单细胞、共培养等2D细胞模型的基础上利用干细胞、类器官等诱导分化构建3D模型[24],以期实现体外模拟人体肠道吸收和转运等多种功能。
干细胞处于肠道细胞隐窝部分,能够自发分化组织成隐窝绒毛结构,具有自更新和自组织能力,同时可诱导分化形成多种肠道细胞,实现肠道细胞功能活性。Sato等[25]报道了肠隐窝细胞的分离和自更新能力,当其被包埋在凝胶水胶体内,在含生长分化因子的混合物培养基或与分泌这些因子的细胞共培养时,会形成一个封闭的球型单层,从而可以模拟肠道的隐窝绒毛细胞连续体。但包埋在基质凝胶水胶体中的3D隐窝绒毛细胞结构不能提供绒毛刷状边缘的物质吸收通道,造成膳食化合物等物质吸收利用时的区域特异性[26]。
肠道类器官是基于诱导分化多种干细胞构建,根据细胞来源不同可分为胚胎干细胞和隐窝肠干细胞分化的两种肠道类器官。由于干细胞材料稀缺且成本较高,再加上类器官封闭似的环状结构,增大了操作难度,因此其目前用于膳食化合物的吸收利用研究较少,主要应用于菌群检测及临床医学等方面研究。
如图5所示,在2D模型细胞间水平作用的基础上,肠道细胞3D模型能够模拟肠道细胞-细胞以及细胞-细胞外基质的相互作用,进一步重现肠道细胞功能。同时,由于人体肠道细胞经常接触信号刺激分子和不同浓度的营养物质,3D模型中细胞培养位于干细胞聚集体或类器官的中心[24],细胞很难暴露并接触培养基中浓度均匀的信号分子和营养物质,因此,可以更好地模拟肠道微环境。但是3D模型属于封闭式结构,在研究膳食化合物吸收利用方面存在取样困难、条件严格、材料稀缺等问题,同时构建3D模型需考虑食品基质(黏度、形状等)的影响,因此需根据特定实验需求构建具体的3D模型。

图5 肠道细胞3D模型示意图[23]Fig.5 Schematic diagram of 3D model of intestinal cells[23]
2.4 微流体模型
体外细胞模型的发展趋向于真实模拟人体肠道细胞环境,一些细胞功能的问题逐渐得到解决,而细胞模型的非生理性缺陷仍存在,需进一步研究动态细胞模型从而更加真实地模拟肠道物理环境。如图6所示,微流体模型的构建是基于流体持续流动的腔室,将细胞培养在腔室上,流体持续流动带动细胞有节奏地伸展[27],模拟肠道细胞的伸缩性和剪切力,构建微流体细胞模型。微流体模型中细胞分化速度快,形成紧密的细胞屏障,且与体内肠细胞具有更相似的垂直高度[27],更接近人体肠道细胞结构。
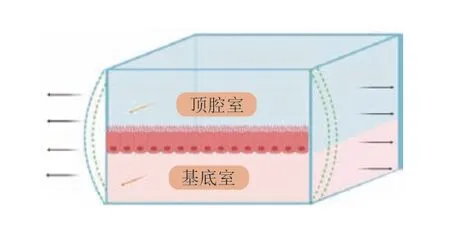
图6 肠道细胞微流体模型示意图[23]Fig.6 Schematic diagram of microfluidic model of intestinal cells[23]
器官芯片是微流体模型中的一种细胞培养装置,能够几乎重现人体肠道细胞的功能和环境。目前,有研究报道了基于聚二甲基硅氧烷设计和制造的肠道微流控芯片可实时、持续地监测肠道细胞内物质含量[28]。Bein等[29]研发了基于Caco-2细胞和其他上皮细胞构建的肠道芯片,利用肠腔侧和基底侧流体压力的变化使模拟肠道组织循环机械运动以模拟肠道蠕动,能刺激体外细胞模型形成肠道绒毛结构,可以在保证黏液分泌的同时增加肠道细胞功能的表达。为更好地构建肠道类器官的隐窝与绒毛结构,Shin等[30]结合干细胞分化而来的类器官构建了肠道类器官-微流控芯片模型。Tsamandouras等[31]通过将单层分化、共培养的Caco-2和HT29-MTX细胞构建在由初代肝细胞和Kupffer细胞组成的肝芯片上,建立了肠-肝模型微流体系统。Chen等[32]结合原代肠细胞培养物的肠芯片和含有共培养HepG2细胞和Kupffer细胞的肝芯片构建了肠-肝芯片微流体系统。目前,在器官芯片持续发展过程中,已有研究构建了肠-肝-皮肤-肾四器官芯片模型[33],这使得体外完全重建肠道细胞已成为可能,对于进一步探究肠道细胞吸收机制具有重要意义。
2.5 肠道细胞模型的验证
肠道细胞模型的成功建立,是保证开展肠道细胞吸收机制研究的基础,因此,需要对细胞的生长状态、完整性和分化特征进行检测,具体检测指标如表1所示。细胞在培养过程中,可通过光学显微镜直接观察细胞生长形态,利用噻唑蓝法测定细胞生长曲线,观察细胞生长动态过程。测定细胞层的跨膜电阻(transendothelial electrical resistance,TEER)是验证细胞单层膜完整性最为简单易行的方法[34]。随着培养时间的延长,肠道细胞紧密连接逐渐成熟,TEER与细胞连接的紧密程度密切相关,TEER越大,细胞紧密程度越高,故可通过运用跨膜电阻仪检测细胞模型的TEER,从而检测细胞单层膜的致密程度。当TEER恒定时,表明细胞紧密连接达到一定程度,通过检测荧光黄的跨膜通透性进一步检测细胞单层膜的完整性。检测细胞培养过程中的分化特征有两种办法:1)测定细胞膜两侧和细胞内部的碱性磷酸酶活性的动态变化[24];2)直接用电子显微镜观察肠道细胞形态,可通过将多孔膜从培养室取下,固定多孔膜上的细胞,经包埋切片后使用电子显微镜观察细胞是否出现极化、细胞间的紧密连接、桥粒和刷状边缘是否形成,从而判断细胞分化程度[35]。综合考虑细胞模型全部检测指标可判定细胞模型是否建立成功。

表1 构建模型的检测指标[34-35]Table 1 Indicators for construction of detection models[34-35]
3 肠道吸收细胞模型在类胡萝卜素上的应用
3.1 类胡萝卜素的结构和功能
类胡萝卜素是自然界中除叶绿素外最丰富的天然色素,是呈黄色、橙色或红色的四萜类物质,均具有聚异戊二烯结构[36]。类胡萝卜素种类丰富,共750余种,广泛存在于动物、植物、微生物以及藻类中。根据官能团可以分为烃类和含氧类胡萝卜素两大类,其中常见的类胡萝卜素有6 种,其结构、营养功能及主要食物来源如表2所示。
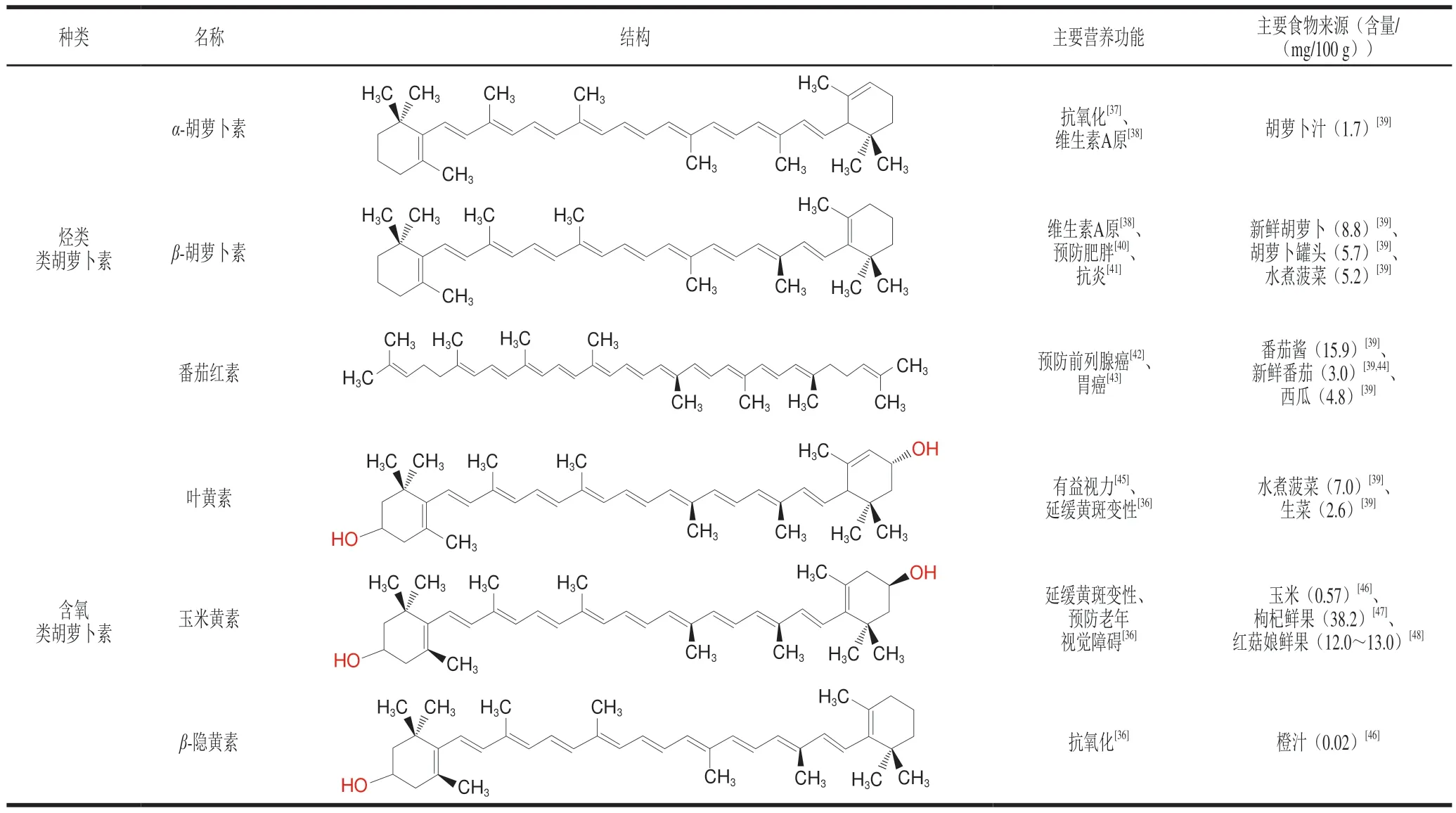
表2 常见类胡萝卜素的结构、营养功能及主要食物来源Table 2 Structures,nutritional functions and major food sources of common carotenoids
类胡萝卜素在自然界中具有不可替代的作用。对于植物来说,类胡萝卜素作为色素成分之一,既可以在光合作用中起到辅助色素的作用[36],又可以在评价植物外观及营养品质上起到关键作用。对于动物来讲,类胡萝卜素在其生长发育与健康方面起着重要的作用,具有作为维生素A原、抗氧化、免疫调节、预防心血管疾病等生理活性功能[36-38,42-43],是一类对视觉和神经系统等具有重要营养价值和功能活性的物质。但由于类胡萝卜素具有特殊的聚异戊二烯结构,脂溶性强、不溶于水[49],且其高度不饱和结构使其极不稳定,对光、热、金属离子等敏感[50],同时在消化吸收过程中易受到食物基质、存在形式、宿主因素等影响[51],因此类胡萝卜素生物利用度较低。在目前发现的750多种类胡萝卜素中,人类正常饮食中已经发现的有50多种,但其中只有10余种能够在人体中检测到,且吸收利用度较低,有人体实验结果表明,β-胡萝卜素的生物利用度为4%~14%,而番茄红素的生物利用度仅为0.1%~1.5%[52]。因此,研究影响类胡萝卜素吸收利用度的内源性和外源性因素,以提出合理建议从而提高其吸收利用度极为重要。
3.2 类胡萝卜素的肠道吸收转运机制
肠上皮细胞作为肠道吸收转运物质的关键部位,主要分为细胞旁途径转运和跨细胞膜途径转运两种转运方式,其中跨细胞膜途径转运又分为被动扩散、转胞吞作用和主动扩散[53]。类胡萝卜素的肠道吸收如图7所示,类胡萝卜素在被人体吸收利用时,通常在经过口腔和胃的消化作用后分散溶解在脂质乳液中进入肠道,在肠道内经过胰液和胆汁的双重消化,脂质被水解,类胡萝卜素与胆固醇、脂质消化物以及胆盐等形成混合胶束,胶束可通过黏蛋白层扩散到排列于肠腔边界的吸收性上皮细胞表面[51]。胶束到达上皮细胞表面后,其中的脂肪酸在微酸性环境下质子化,从胶束中脱离,胶束解离后,类胡萝卜素释放[54],并通过特定的转运机制进入肠道细胞内部,进一步发挥其生理功能。

图7 类胡萝卜素的肠道吸收Fig.7 Intestinal absorption of carotenoids
过去研究者认为类胡萝卜素的肠道吸收转运机制为简单的被动扩散[44,55]。Tyczkowski等[56]通过研究蛋鸡小肠细胞对游离叶黄素的吸收,发现在肠道细胞中存在游离态、单酯、二酯3 种形式的叶黄素,且转运过程中均以未结合的形式存在,沿浓度梯度被动吸收,为被动扩散转运机制。陈波等[57]利用犊牛和仔鸡的离体小肠细胞进行β-胡萝卜素和叶黄素的体外吸收实验,研究类胡萝卜素浓度、游离脂肪酸和吐温20对其吸收的影响,结果发现两种类胡萝卜素的吸收均呈浓度依赖性,为典型的被动扩散模型。但通过进一步研究发现,类胡萝卜素的吸收在个体间存在一定差异,在细胞水平存在顺反异构体的选择性[18],以及与其他物质具有一定的相互作用,转运机制不是简单的被动扩散,还需要载体蛋白介导的主动运输[54,57]。陈叶等[58]通过Caco-2细胞模型测定胶束化对叶黄素肠道细胞摄取、表观渗透系数和细胞内吞的影响,结果表明胶束化处理显著提高了叶黄素的生物利用度,且其在肠道细胞中的跨膜吸收途径以被动扩散为主,兼具网格蛋白介导和小窝/脂筏蛋白介导的主动运输。Borel等[59]采用Caco-2细胞模型研究发现脂肪酸转运酶白细胞分化抗原(cluster of differentiation 36,CD36)参与VA前体物质α-胡萝卜素和β-隐黄素的摄取。
不同类胡萝卜素转运机制不尽相同,大多以被动扩散为基础,同时存在特定转运蛋白主动扩散的转运机制,目前鉴定的转运蛋白主要以脂质膜转运蛋白为主。目前已报道的类胡萝卜素的转运方式总结如表3所示。类胡萝卜素的吸收转运机制与其结合载体存在一定的关联,通过不同转运机制吸收时其生物利用度可能存在一定的差异,因此,需要进一步考虑不同转运方式及转运速率对类胡萝卜素的“高吸收利用”或“低吸收利用”表型的影响,从而制定合理的饮食建议优化类胡萝卜素在人体的消化吸收,最大化其对人体的健康益处。
3.3 肠道吸收细胞模型在类胡萝卜素上的应用
目前已应用于类胡萝卜素肠道吸收研究的体外细胞模型主要包括Caco-2单层细胞模型和Caco-2/HT29-MTX共培养细胞模型两种,相关研究如表3所示。
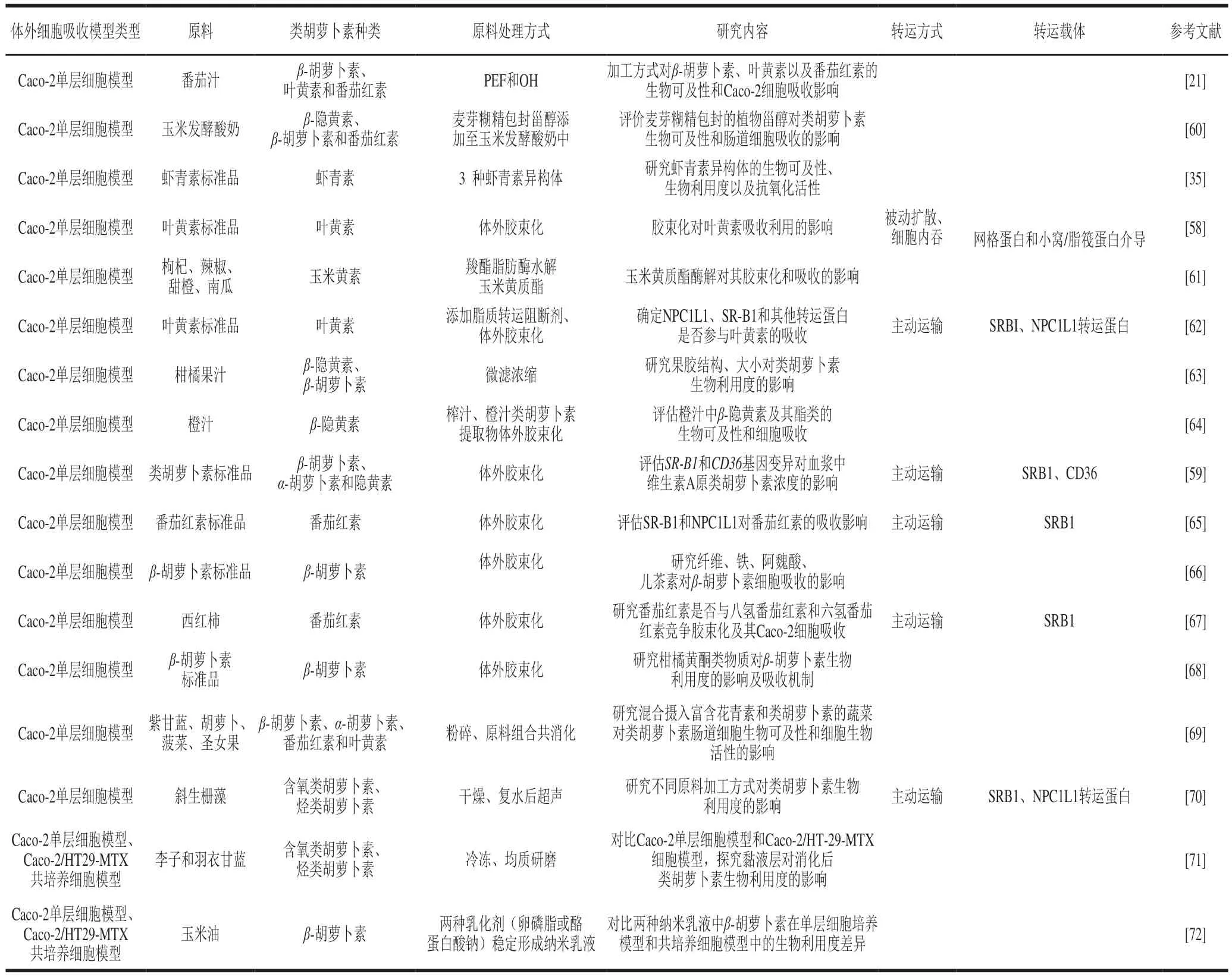
表3 体外肠道吸收细胞模型在类胡萝卜素上的应用总结Table 3 Summary of recent studies on transport mechanism of carotenoids in in vitro intestinal cell models
3.3.1 Caco-2单层细胞模型在类胡萝卜素上的应用
Caco-2单层细胞模型是研究类胡萝卜素吸收应用最广泛的体外细胞模型。Chitchumroonchokcai等[61]通过建立Caco-2体外细胞模型研究玉米黄素酯的酶解对肠道细胞摄取玉米黄素的影响,结果表明玉米黄素酯经羧基酯脂肪酶水解后产生游离态玉米黄素会促进其胶束化,从而提高其生物利用度,此外,在玉米黄素酯和游离态玉米黄素同时存在时,细胞会优先摄取游离态玉米黄素。Murador等[73]利用Caco-2单层细胞模型对比常规提取和离子液提取两种方法对桔皮中类胡萝卜素和叶绿素生物利用度的影响时发现,Caco-2单层细胞对离子液提取物中类胡萝卜素和叶绿素的摄取量(243.8~234.2 ng/mg细胞蛋白)是常规方法提取物中(130.2~131.6 ng/mg细胞蛋白)的近两倍。Zhong Siqiong等[20]利用Caco-2细胞模型研究了新型食品加工技术PEF和OH对番茄汁、超高压处理和PEF对羽衣甘蓝汁中类胡萝卜素的生物可及性和细胞吸收的影响,结果表明,对于番茄汁,PEF处理使番茄汁中番茄红素的生物可及性提高了50%,但β-胡萝卜素的生物可及性降低了44%,PEF和OH两种处理均促进了细胞对叶黄素的吸收,而对于羽衣甘蓝汁,PEF处理会降低果汁中的β-胡萝卜素和叶黄素含量,超高压处理对于果汁中类胡萝卜素和颜色保护效果最佳,但二者均未影响其生物可及性和细胞吸收。
3.3.2 Caco-2/HT29-MTX共培养细胞模型在类胡萝卜素上的应用
Caco-2/HT29-MTX共培养细胞模型基于Caco-2单细胞模型进一步真实还原人体肠道结构和生理条件,已应用于类胡萝卜素等膳食化合物吸收利用的体外研究。Kaulmann等[71]分别采用Caco-2单细胞模型和Caco-2/HT29-MTX共培养细胞模型体外模拟研究肠道细胞对采用不同加工方式的李科和十字花科果蔬中类胡萝卜素和多酚物质的吸收,其结果表明蒸煮对多酚物质生物利用度有影响,但对类胡萝卜素无影响,且通过对比Caco-2单细胞和Caco-2/HT29-MTX共培养细胞对类胡萝卜素的吸收率,发现肠道细胞的黏液层对类胡萝卜素的吸收利用有一定的积极影响。Gasa-Falcon等[72]利用Caco-2单细胞和Caco-2/HT29-MTX共培养细胞两种模型探究卵磷脂或酪蛋白酸钠包埋两种β-胡萝卜素纳米乳液在肠道屏障上的生物活性和生物利用度,结果发现,对于酪蛋白酸钠包埋纳米乳液,β-胡萝卜素经Caco-2单细胞吸收的生物利用度约是Caco-2/HT29-MTX共培养细胞吸收的1.8 倍;对于卵磷脂稳定的纳米乳液,β-胡萝卜素经Caco-2单细胞吸收的生物利用度约是Caco-2/HT29-MTX共培养细胞吸收的3.3 倍,结果表明,Caco-2/HT29-MTX共培养细胞分泌的黏液层在一定程度上会影响类胡萝卜素的吸收。上述两项研究所得到的结论截然不同,因此,未来需要更多的研究探索两种细胞模型对不同食品中类胡萝卜素吸收利用的影响,以明确黏液层对类胡萝卜素吸收的影响及机制。
4 结语
膳食成分在维持人体生理功能、健康生长方面至关重要,但在肠道细胞中的吸收、转运受到诸多因素影响,人体能够吸收利用的比例少之又少。因此,通过构建体外细胞模型阐明人体肠道细胞对膳食化合物的吸收利用机制具有重要意义。Caco-2单细胞模型是研究人体膳食化合物吸收利用的最广泛使用的细胞模型,其结构简单,存在绒毛结构,细胞间连接紧密,可较好地模拟人体肠道细胞吸收和屏障保护功能,但其无法分泌黏液,且无法模拟肠道细胞动态吸收过程,需进一步改进以更好地模拟人体肠道环境。Caco-2/HT29-MTX细胞共培养模型在Caco-2单细胞的优势基础上结合HT29-MTX单细胞优势,既形成了绒毛结构,细胞紧密连接,又可以分泌黏液,形成黏液层,能够进一步真实模拟肠道细胞吸收功能和生理环境,但两种细胞培养条件及比例需严格控制。Caco-2/靶细胞共培养模型是基于人体吸收基础上,进一步研究物质吸收后到达靶细胞发挥功效的作用机制,但目前应用于膳食化合物的研究较少,主要用于药物毒理研究。随着分析方法和仪器的进步以及研究的深入,体外肠道细胞模型逐渐成熟,通过3D模型可以在模拟肠道细胞功能活性的同时模拟细胞-细胞水平间作用以及细胞-细胞外基质的垂直作用,而通过微流体装置可以动态再现人体肠道环境。但需要强调的是,无论是2D、3D静态模型,还是微流体、器官芯片等动态装置,都不是复制人体肠道细胞或器官,而是模拟肠道细胞或器官的结构、功能和环境,不涉及伦理问题。
作为一种广泛存在的膳食营养成分,类胡萝卜素在维持人体生理功能和预防疾病等方面至关重要。目前应用于类胡萝卜素吸收研究的体外肠道细胞模型较少,主要有Caco-2单细胞模型和Caco-2/HT29-MTX细胞共培养模型两种。研究人体对类胡萝卜素等膳食化合物的吸收利用时,需要根据食物基质、膳食化合物结构特性以及模型特点等方面综合考虑体外肠道吸收细胞模型的适用性,而目前用于类胡萝卜素等膳食化合物肠道吸收研究的体外模型仍存在一定局限性。未来如果在体外肠道细胞模型的改进和完善上能实现绒毛和黏液层等肠道结构功能的模拟、转运蛋白和酶类等活性分子的高效表达以及肠道细胞蠕动等生理环境的再现等,将会促进更多关于人体对膳食化合物吸收利用机制的新见解产生,从而为通过膳食改善人体营养健康提供更高效的解决方案。
