海洋生物中砷脂形态分析及毒性评价研究进展
2023-02-12陈佳佳钟映雄周雪巍陈建平刘晓菲贾学静宋兵兵钟赛意
陈佳佳,钟映雄,周雪巍,李 瑞,陈建平,刘晓菲,贾学静,宋兵兵,钟赛意,3,*
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东省海洋生物制品工程实验室,广东省海洋食品工程技术研究中心,广东 湛江 524088;2.广东海洋大学深圳研究院,广东 深圳 518108;3.大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034)
砷是一种类金属,已被国际癌症研究中心(International Agency for Research on Cancer,IARC)确定为人类致癌物,广泛存在海洋生物中。砷中毒会对人体皮肤、神经、呼吸、心血管、免疫、内分泌和生殖系统造成损伤[1]。砷可分为无机砷和有机砷,无机砷主要为三价砷[As(III)]和五价砷[As(V)],有机砷主要包括一甲基砷(monomethylarsonic acid,MMA)、二甲基砷(dimethylarsinic acid,DMA)、三甲基砷(trimethylarsine,TMA)、砷甜菜碱(arsenobetaine,AsB)、砷胆碱(arsenocholine,AsC)、砷糖(arsenosugars,AsS)和砷脂(arsenolipids,AsL)等。砷的毒性与其形态结构息息相关,一般来说,无机砷毒性大于有机砷。几种主要有机砷毒性大小依次为MMA>DMA>AsC>AsB,通常认为AsS和AsL毒性极低[2-4]。其中,砷脂是存在于微生物、植物、鱼类组织中的一类中性脂质类似物[5]。1928年Sadolin[6]首次报道砷脂的存在。1988年研究人员才首次对裙带菜中砷脂的第一个结构AsPL 958进行鉴定[7]。之后由于砷脂结构的复杂性和极低的浓度,很少有研究者尝试对其进行精确鉴定。
砷脂的形态包括含砷脂肪酸(arsenic-containing fatty acids,AsFAs)[8-10]、含砷碳氢化合物(arsenic-containing hydrocarbons,AsHCs)[11-12]、含砷长链醇[13]、含砷磷脂(arsenic-containing phospholipids,AsPLs)[14-15]、含砷磷脂酰胆碱(arsenic-containing phosphatidylcholines,AsPCs)[16]和含砷磷脂酰乙醇胺(arsenic-containing phosphati-dylethanolamine,AsPEs)[16]等。不同海洋生物的砷脂形态与含量不同,一般来说,藻类、真菌和贝类的砷脂含量较低,通常占其总砷含量的4.2%~46.0%[17-18]。藻类中的砷脂主要以AsPLs的形态存在,而鱼类中的砷脂主要以AsHCs和AsFAs为主。Amayo等[19]研究鲽鱼、沙丁鱼、鲭鱼和红鲻鱼这4 种常见鱼类,发现鲽鱼和沙丁鱼的砷脂形态以AsHCs为主;而鲭鱼和红鲻鱼的砷脂形态以AsFAs为主。此外,不同组织部位的砷脂含量也不尽相同。毛鳞鱼油中3 种AsHCs的含量占总砷含量的70%及以上[12],而不同市售罐装鳕鱼肝样品中砷脂含量不同,AsHCs和AsFAs分别占总砷含量的25%和77%[20]。
近年来,研究发现某些形态的砷脂对人体细胞具有毒性[21-22],有些毒性甚至大于亚砷酸盐,会对人体健康造成潜在危害。但由于砷脂形态结构复杂多样、生物利用度低、含量低以及提取和检测难度高等原因,砷脂的毒性作用机制有待深入研究。
目前已有70多种砷脂的形态结构得到鉴定[23-24],但不同海产品中不同砷脂化合物的结构和毒性仍然不明,有待进一步研究。因此,本文对海洋生物中砷脂形态分析和毒性评价领域的最新研究进展进行综述,以期为进一步深入研究砷脂形态、毒性以及安全风险评估提供一定参考。
1 砷脂的形态
目前已报道的砷脂形态主要包括AsHCs、AsFAs、AsPLs三大类。
1.1 含砷碳氢化合物
AsHCs由二甲基亚砷酰基和长链烃组成。长链烃一般为15~20 个碳原子的饱和奇数或偶数碳氢化合物直链,在酸性或碱性条件下结构稳定。从结构上看,AsHCs为两性化合物,由疏水烃类尾部和亲水二甲基亚砷酰基头部组成。一些已知的AsHCs,如AsHC 332、AsHC 360和AsHC 444的结构式如图1所示。

图1 AsHC 332、AsHC 360和AsHC 444的结构式[21]Fig.1 Chemical structures of AsHC 332,AsHC 360 and AsHC 444[21]
AsHCs主要存在于金枪鱼[25]、鳕鱼[11,26]等一些可食用鱼和鱼油[12-13,27]中。在金枪鱼、秋刀鱼、沙丁鱼、鱿鱼、鲣鱼等鱼类中均检测到,含量为6.50~211 ng/g(以每克鲜质量样品所含砷质量计,下同),虾、蟹中的AsHCs含量分别为25.4 ng/g和63.8 ng/g,贝类蛤蜊中AsHCs含量达75.8 ng/g[27]。此外AsHCs也存在于一些藻类中[14,28-29],Glabonjat等[28]对来自羊栖菜的认证标准物质NMIJ 7405-a进行了砷脂的定性和定量检测,发现AsHC 332和AsHC 360的含量分别为(1073f 44)ng/g和(90f 5)ng/g。
1.2 含砷脂肪酸
AsFAs由极性二甲基亚砷酰基和中间带有长烃链的羧酸组成,长烃链可以是饱和、单不饱和/或多不饱和状态,酸性条件下结构稳定。其中一些已知的AsFAs形态,如AsFA 362和AsFA 388的结构式如图2所示。
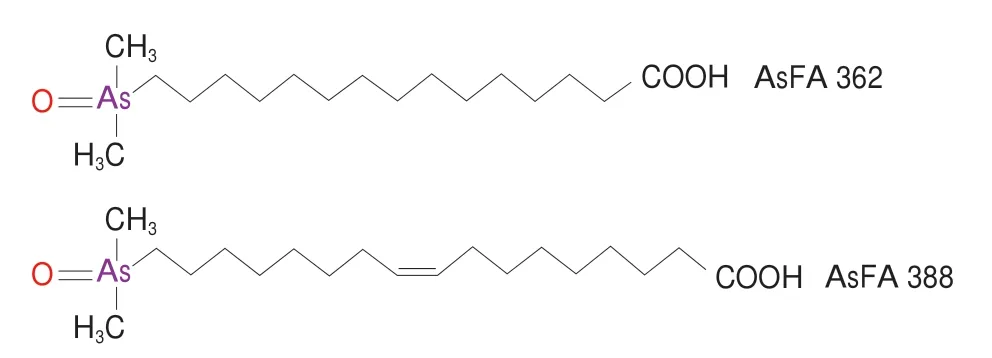
图2 AsFA 362和AsFA 388的结构式[22]Fig.2 Chemical structures of AsFA 362 and AsFA 388[22]
AsFAs主要存在于鳕鱼[30]、鲱鱼和红鲻鱼等一些可食用鱼和鱼肝油[8,31]中。在金枪鱼、秋刀鱼、沙丁鱼、鱿鱼、鲣鱼等鱼类中也被检测出,含量为0~59.2 ng/g,虾、蟹中的AsFAs含量分别为2.88 ng/g和5.60 ng/g,贝类中蛤蜊的AsFAs含量为12.1 ng/g[27]。此外,AsFAs在一些藻类中也有发现[15],红藻中鉴定出AsFA 374,其含量为15 ng/g[29]。
1.3 含砷磷脂
与AsFAs和AsHCs不同,AsPLs结构复杂且不稳定,酸/碱条件下易水解,水解效率可达100%,说明AsPLs中脂肪酸通过酯键结合,而不是通过酸稳定的醚键结合[32]。目前为止,已报道的少量砷脂结构以AsFAs和AsHCs为主,AsPLs由于结构复杂而较难鉴定。在AsPLs中,研究人员对As和P进行特异性电感耦合等离子体质谱(inductively coupled plasma-mass spectrometry,ICPMS)分析,发现AsPLs水解后,磷脂结构绝大部分为常规不含砷的磷脂,其余主要是以磷脂酰乙醇胺和磷脂酰胆碱的形式存在[15]。海带中AsPLs含有70%以上亲脂性砷,这些含砷成分理论上可能是常规磷脂中含有AsFAs,也可能是脂质的含磷部分含有砷,Raab等[15]用反相高效液相色谱-电喷雾离子阱质谱/电感耦合等离子体质谱联用技术(reversed-phase high-performance liquid chromatography in parallel with electrospray ionization mass spectrometry and high-resolution inductively coupled plasma mass spectrometry,RP-HPLC-ESI-MS/ICP-MS)对海带中AsPLs的酸和碱提取物进行分析,发现其不含AsFAs,排除AsPLs中含有AsFAs的可能性。
AsPLs主要包括砷糖磷脂(arsenosugar phospholipids,AsSugPLs)、AsPCs和ASPEs,一些已知AsPLs的结构式如图3所示。
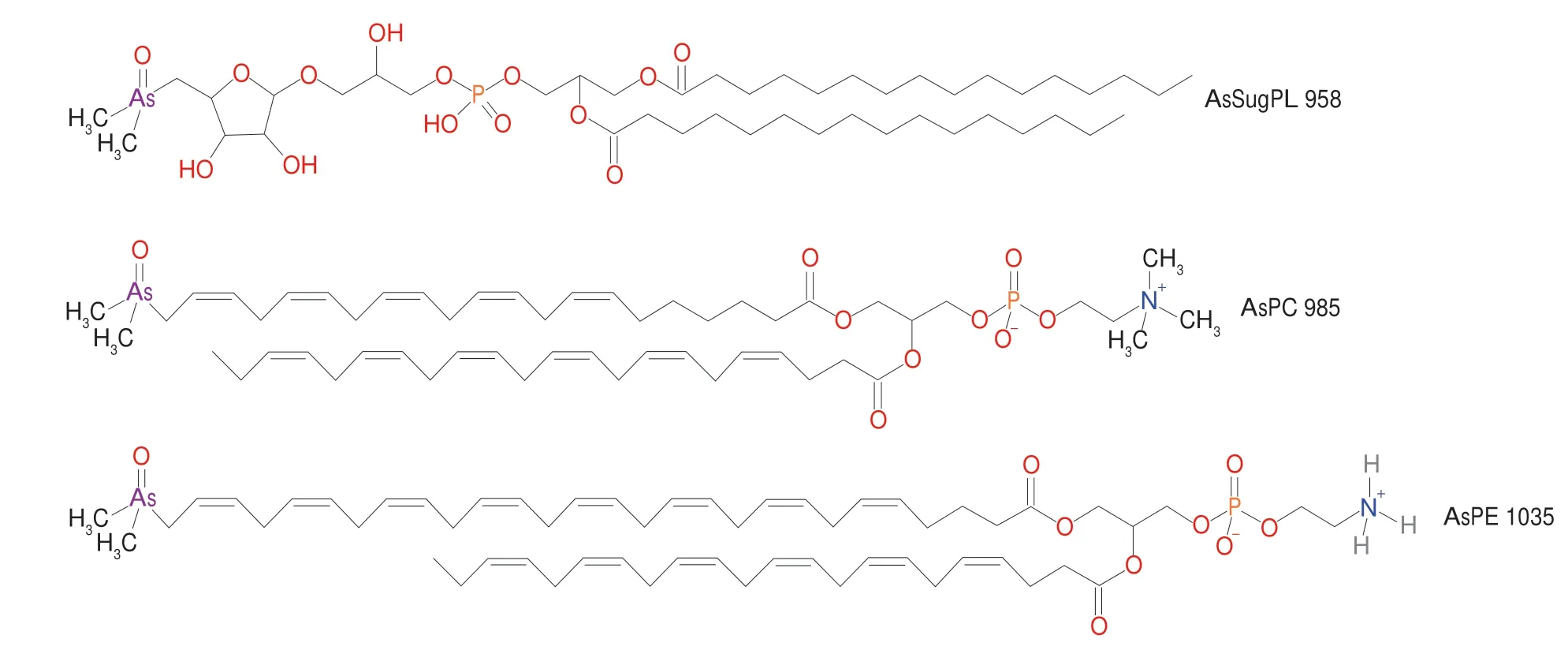
图3 AsSugPL 958、AsPC 985和AsPE 1035的结构式[33]Fig.3 Chemical structures of AsSugPL 958,AsPC 985 and AsPE 1035[33]
1.3.1 砷糖磷脂
AsSugPLs在酸/碱条件下不稳定,水解后以As-糖-PO4部分(3-[5-脱氧-5(二甲基亚砷酰基)-β-D-核糖氧基]-2-羟丙基-2,3-二羟丙基磷酸氢)存在。AsSugPLs主要存在于海带[15]、羊栖菜[14]、裙带菜[14]、紫菜[33]等一些可食用和常见的褐藻中。所有已发现的天然AsSugPL都是二酰基化合物,Yu Xinwei等[34]在可食用褐藻海带中鉴定出8 种单酰基新AsSugPL,与二酰基AsSugPL的区别在于甘油基团上仅包含一种脂肪酸,单酰基新AsSugPL约占海带砷脂总量的30%,二酰基AsSugPL约占50%,AsHC约占20%。这一发现拓展了对天然脂质化学的认识。
1.3.2 含砷磷脂酰胆碱
AsPCs稳定性较差。AsPCs主要存在于鲱鱼鱼肉[29]、鲱鱼鱼子酱[16]和球藻[35]中。Finke等[23]发现氧代-AsPC 839不稳定,在细胞原液和培养基中贮藏48 h就会发生降解,降解产物为氧代-AsFA 362,而硫代-ASPC 855虽较氧代-AsPC 839稳定,但相同条件下也会发生一定程度降解,主要降解产物为硫代-AsFA 378。
1.3.3 含砷磷脂酰乙醇胺
AsPEs稳定性较差,在鱼子酱[16]和绿藻[35]中均有检出。由于AsPEs中脂肪酸侧链中双键的几何构型和位置以及甘油酯的位置还不能确定,因此只能利用HPLC/ICP-MS和MS/MS得到鲑鱼鱼子酱中AsPE 1035的可能结构[16]。此外,Rezanka等[35]采用HPLC/ESI-MS鉴定3 株绿藻中砷脂形态,最终得到8 种AsPEs。
1.4 其他
除了上述三大类含砷脂质外,砷脂还有一些其他复杂结构,如三甲基化砷脂肪醇(cationic trimethylarsenio fatty alcohols,TMAsFOHs)、含砷三酰基甘油酯(arsenic-containing triacylglycerides,AsTAGs)、砷糖植醇(arsenosugar-phytol,AsSugPhytols)、含砷磷脂酰肌醇(arsenic-containing phosphatidylinositols,AsPIs)和含砷磷脂酰甘油(arsenic-containing phosphatidylglycerols,AsPGs)等,其中一些已知的其他形态砷脂结构式如图4所示。
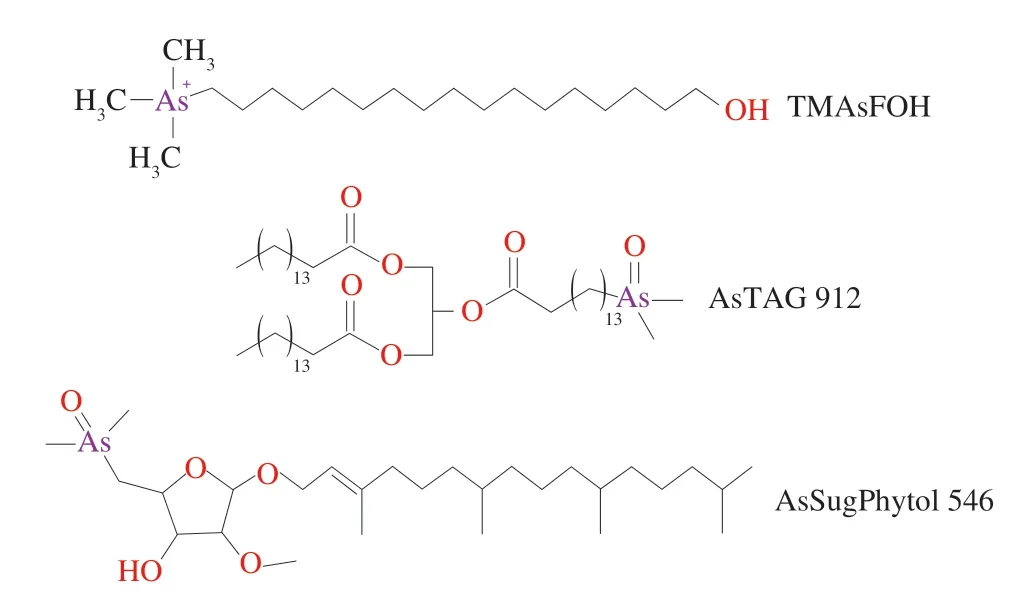
图4 TMAsFOH[13]、AsTAGs 912[41]和AsSugPhytol 546[18]的结构式Fig.4 Chemical structures of TMAsFOH[13],AsTAGs 912[41] and AsSugPhytol 546[18]
目前关于上述形态砷脂的报道则更少。TMAsFOHs的元素组成与AsHCs一致,但结构不同,且极性更高。TMAsFOHs存在鱼油中,Amayo等[13]采用RP-HPLC-ESIMS/ICP-MS测定毛鳞鱼油中的砷脂,鉴定出毛鳞鱼油中两种TMAsFOHs为新型砷脂种类。
AsTAGs是中性脂质,存在于蓝鳕鱼油[36]、秘鲁凤尾鱼[37]、绿藻[35]中。Guttenberger等[38]采用两种方式合成AsTAGs 1和AsTAGs 2,并将其作为模型化合物,后续将对其进行化学、生物学、毒理学方面的研究。
AsSugPhytols是砷与2-O-甲基核糖的结合,其中C、O通过醚键连接。AsSugPhytols可在藻类砷代谢中发现,如Glabonjat等[39]研究单细胞绿藻杜氏藻的砷代谢发现了一种新型砷脂,即植基2-O-甲基二甲基砷酰呋喃核糖苷,是由植醇与2-O-甲基核糖结合得到,约占杜氏藻砷脂总量的35%~65%[18]。因为2-O-甲基核糖目前为止仅在RNA中发现,所以这一发现引发了人们对砷在生命早期生物学作用的猜测。Glabonjat等[40]还在美国犹他州大盐湖底沉积物中发现了植基2-O-甲基二甲基砷酰核糖类似物。
2 砷脂形态分析方法
2.1 砷脂的提取
不同形态砷脂提取的关键在于提取效率高,并且不能破坏砷脂的化学形态。影响提取效率的因素包括样品类型,提取方法、时间、温度以及提取溶剂种类、体积等[42]。海产品中不同形态砷脂通常使用有机溶剂萃取法[43-45]提取。单一溶剂提取到的砷脂形态有限。砷脂的提取率一般用砷脂的提取量在总砷含量中的占比表示。为提高溶剂提取效率,一般采用超声或微波辅助溶剂连续分级提取。此外,同一提取方法,随着鱼类脂肪含量和提取部位不同,砷脂的提取率也不同。
Al Amin等[27]发现AsHCs含量与鱼类总脂肪含量成正比(r=0.67,P<0.01)。Lischka等[9]用丙酮萃取所得的砷含量近似于砷脂的含量,各类海鱼中砷脂提取率在1%~66%之间,其中鲱鱼(脂肪含量高)的砷脂提取率约62%,而比目鱼(脂肪含量低)的砷脂提取率则约为1.7%。Yu Xinwei等[34]采用超声辅助二氯甲烷-甲醇混合振荡法提取新鲜海带和商业海带产品中的砷脂,提取率分别为13%和8%。Stiboller等[46]用吡啶和碳酸氢铵对金枪鱼连续分级提取脂溶性和水溶性砷,其中金枪鱼脑组织中砷脂提取率达55%,肌肉组织中提取率则为20%。
2.2 砷脂的形态分离
目前常用的分离方法有气相色谱(gas chromatography,GC)、HPLC和毛细管电泳法等[47-49]。GC无法使各种砷化物同时被衍生成低沸点化合物,具有局限性[50]。毛细管电泳法具有高效、快速、抗干扰强等优点,但进样量少,因而制备能力差,且灵敏度较低[51]。而HPLC分离砷脂形态时可根据分离形态的性质选择适当的色谱体系,样品无需衍生,且分析速率快、分辨率高、灵敏度高[52]。Miyashita等[53]研究几种市售氟碳固定相对HPLC-ICP-MS中砷的分离性质,发现五氟苯基柱分离大量砷形态的潜力最佳。
2.3 砷脂的检测
ICP-MS不仅灵敏度高,而且能够跟踪多元素同位素信号变化等[54],且检出限可低至ng/L,对于砷这一类结构复杂,生物细胞中痕量、超痕量的化合物是最可靠的形态分析方法[55]。严国等[56]采用ICP-MS分析海蟹中的砷元素分布特征。尽管许多样品中砷脂仅占总砷含量的一部分,但砷脂形态丰富,目前还存在大量未鉴定的砷脂[36]。砷脂的鉴定通常采用HPLC-ICP-MS或HPLCESI-MS/MS[27,57]。HPLC-ICP-MS技术融合了HPLC的高效分离、高灵敏度、高重现性和ICP-MS的低检出限、宽动态线性范围,是目前检测砷脂的常用方法之一[55]。胥佳佳等[58]建立一种同时测定香菇中6 种形态砷化合物的HPLC-ICP-MS分析方法。HPLC-ICP-MS一般选用体积分数0.1%甲酸水溶液和体积分数0.1%甲酸-甲醇溶液作为流动相。Rodriguez等[59]对HPLC-ICP-MS检测中的流动相进行优化,提出了一种高选择性和稳健性的方法;选择20 mmol/L醋酸铵(pH 9)和20 mmol/L醋酸铵(pH 5)作为二元流动相,可在30 min内分离6 种形态砷,虽然分析时间延长,但获得了良好的分辨率,改善了传统方法分离效果差的主要缺点,从而可以鉴定更多的砷形态。Al Amin等[27]采用HPLC-ICP-MS/ESI-MS/MS鉴定海产品中的砷脂形态并进行定量分析,砷脂的检出限为0.4~1.0 ng/g。该方法可通过获得物质的结构信息来鉴定已知、未知的复杂砷化合物,已成为砷脂形态检测领域的主流技术。
Lischka等[9]首次利用HPLC-ICP-MS/ESI-Q-TOF-MS法在商业鲱鱼片中鉴定出16 种脂溶性砷化合物,其中包括7 种未鉴定的砷脂。Rezanka等[35]用HPLC/ESI-MS测定绿藻中的砷脂,确定了39 种AsTAGs、15 种AsPCs、8 种AsPEs、6 种AsPIs、2 种AsPGs和5 种未知脂质。Yu Xinwei等[34]使用HPLC-ICP-MS/ESI-MS/MS和HPLCESI-QTOF-MS-MS在褐藻海带中鉴定出21 种砷脂,其中包括8 种未知的单酰基砷糖磷脂。
3 砷脂的毒性评价
砷脂的分子结构鉴定对于其毒理学评估和了解环境中的砷循环至关重要。砷化合物的毒性很大程度上取决于其化学形式[19],因此不同形态砷在其毒理学行为方面可能存在很大差异[60]。海产品中砷形态毒理代谢规律及砷毒性与其生物转化行为息息相关,对海产品的质量安全有重要影响[61]。无机砷被IARC划分为I类致癌物。相比之下,一般认为砷脂无毒,食品安全评价以总砷含量为指标。海产品中脂溶性有机砷化合物的毒性研究较少[30],但近年来随着研究技术的发展,可通过人工合成一些天然砷脂[62-63],再对其进行具体的毒性分析。总地来说,有机砷毒性依次为AsHCs>AsFAs>AsPLs。AsHCs的生物利用度高,不易被代谢,具有细胞毒性,可以穿过血脑屏障在脑部组织中积累,从而产生神经毒性。AsFAs生物利用度较高,在体内可被硫醇化,有较小的毒性作用。此外,AsFAs的代谢产物DMAV具有一定的遗传毒性,IARC将其划分为可能致癌物质(IIB类)。AsPLs的生物利用度低,但其本身不稳定、易降解,在体内会被代谢通过尿液排出,不会在体内积累,对人体危害小。而其他复杂砷脂(如TMAsFOHs、AsTAGs),相关文献报道较少。其中3 种砷脂形态及其毒性如表1所示。

表1 3 种砷脂形态及其毒性Table 1 Toxicity of three species of arsenolipids
3.1 含砷碳氢化合物
Bornhorst等[41]研究了AsHCs在多细胞生物体秀丽隐杆线虫中的代谢和毒理学特征。AsHCs烃链较长,可能与秀丽隐杆线虫中的亲脂性结构相互作用,通过表皮和肠道吸收,其生物利用度远高于亚砷酸盐(iAsIII)。
秀丽隐杆线虫能够代谢砷脂,发现AsHCs代谢产物包括其硫代类似物、相应的极性较低的AsFAs(AsHCs末端氧化成一个羧酸基团)和短链AsFAs(减少一个2C单位,相对分子质量减小28)[41]。如用AsHC 332孵育秀丽隐杆线虫,得到的代谢产物有AsFA 362、AsFA 334、AsFA 306等,依此类推,该代谢过程与脂肪酸β-氧化一致。
近年来,各项体外研究发现AsHCs具有高细胞毒性潜力,可能与细胞能量水平降低有关。在人肝癌细胞(HepG2)[21]、神经元[64]和尿路上皮细胞(UROtsa)[21]中,低浓度AsHCs可产生与iAsIII相当的毒性[21,64]。此外,Ebert等[67]在HepG2细胞中发现氧代-AsHC 332的代谢产物硫代-AsHC 348,其生物利用度与母体化合物氧代-AsHC 332相比降低约90%,但毒性与氧代-AsHC 332类似。Witt等[64]也发现在与iAsIII相当的浓度范围内,AsHCs在细胞内高度积累,产生细胞毒性作用,干扰神经网络以及降低线粒体膜电位,表明AsHCs可能具有潜在的神经毒性。此外,在挪威哺乳期母亲的乳汁中[68-69]检测到AsHCs,以及果蝇[70-71]和鲣鱼[46]的相关研究表明,AsHCs能够穿越血脑屏障在大脑累积,具有潜在的神经毒性。体外实验也证明,AsHCs能够穿越体外血脑屏障模型[65]和Caco-2肠屏障模型[72]。Bornhorst等[41]发现浓度为100 μmol/L时,两种AsHCs均会影响秀丽隐杆线虫的存活率,且分子质量较小影响效力更高,如AsHC 332比AsHC 360的影响效力更高。
3.2 含砷脂肪酸
体外研究发现,与AsHCs相比,AsFAs在HepG2细胞中的生物利用度降低了71.4%~83.3%,毒性降低了90.9%~95.2%[22]。体内研究发现AsFAs在秀丽隐杆线虫体内的生物利用度明显高于iAsIII,但经体内代谢后部分硫醇化,对秀丽隐杆线虫的生存和发育无毒性作用。
AsFAs在体内会被代谢分解。Bornhorst等[41]利用AsFA 362处理秀丽隐杆线虫,发现AsFA 362代谢产物是硫代-AsFA 362,未观察到明显的短链AsFAs。
近几年的实验研究表明,AsFAs有一定的细胞毒性作用,但毒性较小,对人类健康有潜在危害,其代谢产物中DMAV对培养的哺乳动物细胞有遗传毒性[73]。Wanibuchi等[74]发现DMAV在动物实验中会促进膀胱、肾脏、肝脏和甲状腺致癌。IARC将DMAV划分为可能致癌物质(IIB类)[75]。Meyer等[66]研究了饱和AsFA(AsFA 362)和不饱和AsFA(AsFA 388)及其3 种代谢物(DMAV、DMAPr和thio-DMAPr)在HepG2细胞中的毒性,结果发现与AsHCs和iAsIII相比,两种AsFAs的毒性均较小,但在微物质的量浓度下仍可观察到显著影响,表明不能排除海洋食品中AsFAs对人类健康的危害。Witt等[64]也评估了AsFA 362和AsFA 388对人完全分化神经细胞的毒性作用,发现AsFAs及其水溶性代谢物的毒性较小。
3.3 含砷磷脂
AsPLs是结构复杂的砷脂,在体内不稳定、易降解,并通过尿液排出,所以不会在体内积累,对健康危害较小。Fukuda等[57]报道化学结构已知的磷脂型砷脂代谢,小鼠灌胃AsPCs后,AsPCs主要被胃肠道吸收,代谢成砷甜菜碱并通过尿液中缓慢排泄。与鳕鱼肝油中的砷脂和水溶性砷化物相比,AsPCs的排泄速率非常慢,大多数可在食用后144 h时内排泄,说明摄入AsPCs不会导致砷的积累。
鲱鱼子酱、鱼类和藻类中存在AsPCs[23,76],但其不稳定、易降解且含量低,导致对其进行体外毒理学特征研究较为困难。Guttenberger等[76]首次公开1-O-十六烷酰基-2-O[(15-(二甲基亚砷酰基)十五烷酰基)氧基]-sn-甘油-3-磷酸胆碱(即AsPC 1)的合成,并将其作为模型化合物用于食品中砷脂的生物和毒理学特性研究。Finke等[23]在实验室条件下合成稳定的氧代-AsPC 839和硫代-AsPC 855,并对其在HepG2中的毒理学特征进行研究,结果表明,AsPCs具有高度结构依赖性毒性。与氧代-AsPC 839相比,硫代-AsPC 855在细胞培养基中更稳定,更不易降解,对细胞的生物利用度也更低。氧代-AsPC 839及其水解产物的毒性与氧代-AsFA 362相当,低于AsHCs或iAsIII(约降低66.7%~85.7%),未观察到遗传毒性。
3.4 其他
迄今为止,仅对AsHCs和AsFAs进行了明确的有关毒性、毒理学和动力学的研究。而复杂砷脂的细胞生物利用度、生物转化和毒理学表征尚未得到解决,相关研究则更少。Bornhorst等[41]对AsTAGs进行毒理学表征,结果表明AsTAGs的生物利用度明显高于iAsIII,但低于AsFAs,具有中等生物利用度。但体内代谢后仅观察到一个未知化合物,没有产生相应的硫代产物、水解产物和短链代谢产物;此外,还在经AsTAG 912孵育的线虫代谢产物中检测到痕量的氧代-AsFA 362和硫代-AsFA 362,二者对秀丽隐杆线虫的生长和发育无毒性作用。
4 结语
本文介绍了砷脂的部分形态和毒性分析研究结果。从三大类砷脂(AsHCs、AsFAs和AsPLs)的角度介绍其中部分砷脂结构和形态分析方法以及毒性方面的评价。结果发现,AsHCs和AsFAs的研究相对较为丰富,对其结构、毒性和合成方面的探讨也较为深入,但对其具体毒性作用机制方面的研究还不够深入,未能完全阐明。对于AsPLs,因其结构复杂,对其形态鉴定和定量分析较为困难,合成途径也报道较少;且因其易被体内代谢降解,一般认为不具有毒性,故在毒性评价方面的关注更少。
值得注意的是,砷脂是否具有剂量-毒性作用关系。例如,急性毒药砒霜(As2O3)令人谈之色变,但2.5 mg/kg砒霜可以增强细胞自噬,减轻早期动脉粥样硬化的病变[77]。未来可以更加深入地研究各形态砷脂的毒性作用。针对AsHCs和AsFAs这类毒性作用较大的物质,需进一步研究其作用机制、机理。
