食品中D-氨基酸的形成机制及生理功能研究进展
2023-02-12任娇艳
高 立,徐 飘,任娇艳
(华南理工大学食品科学与工程学院,广东 广州 510641)
α-碳作为氨基酸的立体中心,连接着氨基、羧基、氢原子和侧链基团,自然界构成蛋白质的20 种氨基酸中,除甘氨酸外,其他19 种氨基酸的α-碳均可作为手性碳原子而使其具有两个互为镜像的立体异构体(D-和L-)(图1)。传统观点认为L-氨基酸是参与生命活动的主体,而D-氨基酸在生物体内的存在及生理活性尚未被重视。随着氨基酸手性分析技术发展,在包括人类在内的哺乳动物、植物、微生物等有机体中发现存在大量D-氨基酸及含有D-氨基酸的生物活性肽。越来越多的研究证实,D-氨基酸具备独特的生理活性(如在神经信号传导、激素调节等方面),且含有D-氨基酸的肽(如细胞信号肽及宿主防御肽等)也在生物体中发挥着不可替代的功能[1-2],这表明D-氨基酸与人体健康密切相关。

图1 L-/D-氨基酸的立体构型示意图Fig.1 Diagram of stereoscopic configuration of L-/D-amino acids
食品中存在的D-氨基酸也不容忽视。研究表明,人类日均从食物中摄入高达100 mg的D-氨基酸[3]。食品中的D-氨基酸主要在某些加工条件下产生,少量来自食品原料本身。天然D-氨基酸含量较高的食物主要为果蔬,其D-氨基酸的相对含量约在0.7%~3.4%[4]。加工食品中尤以发酵制品的D-氨基酸相对含量较高(通常高于8%),这主要源于微生物的新陈代谢活动,同时也与发酵条件(pH值、温度等)密切相关。其中,乳酸发酵是产生D-氨基酸的重要途径之一[5],例如乳酸发酵的酸奶中D-丙氨酸、D-天冬氨酸、D-谷氨酸相对含量分别高达53.8%、40.3%、24.2%[6]。不仅如此,D-氨基酸在食品的风味形成及抗菌防腐方面具有突出贡献,但目前关于其机制研究尚不充分。由此可见,食品中的D-氨基酸与人类健康密切相关,深入理解D-氨基酸的形成机制及其生理功能对于有效调控食品加工中的D-氨基酸及发掘其潜在营养价值具有重要意义。
1 食品中的D-氨基酸及其形成机制
天然食品中存在一定量的D-氨基酸(表1)。更值得关注的是,特定的食品加工条件可引发L-氨基酸外消旋形成D-氨基酸。
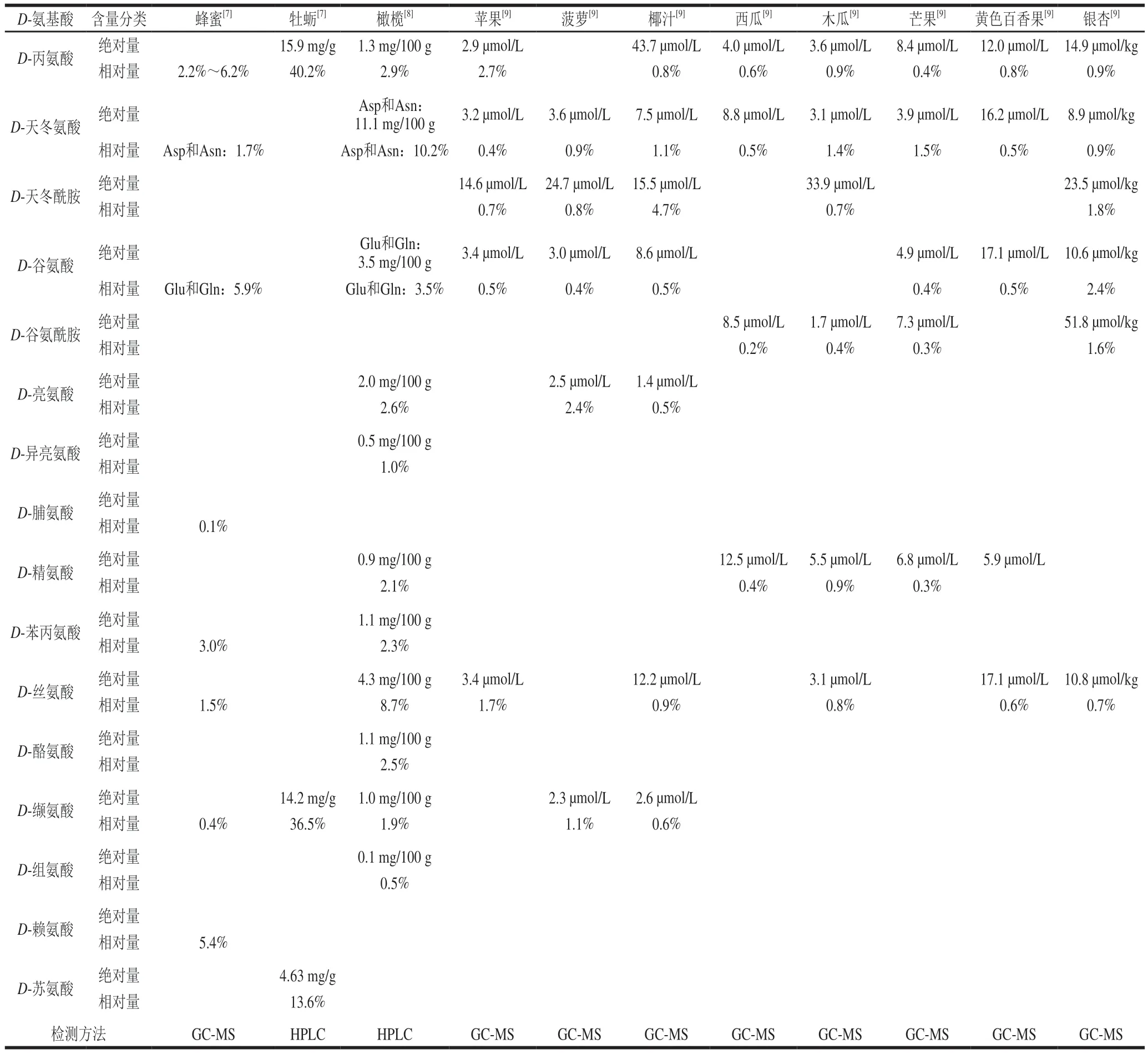
表1 天然食品中的D-氨基酸含量Table 1 Contents of D-amino acids in natural foods
1.1 微生物发酵
目前的研究认为,发酵食品中的D-氨基酸主要是由微生物消旋酶的作用而产生。用于食品发酵的菌株主要为酵母菌、乳酸菌、醋酸菌,其对发酵食品中D-氨基酸的形成具有不可忽视的作用[10]。
研究人员测定了11 种不同工艺发酵制成的食醋中D-氨基酸含量,结果表明,相对于未经乳酸发酵体系中总D-氨基酸浓度(237.7 μmol/L)而言,经乳酸发酵后体系中总D-氨基酸浓度(3773.2 μmol/L)显著增加;而在酒精或醋酸发酵期间未有如此显著的增加。这体现乳酸菌较酵母菌和醋酸菌而言产D-氨基酸的能力更强[10]。随着红葡萄酒和白葡萄酒发酵的进行,D-丙氨酸、D-谷氨酸和D-赖氨酸的浓度均增加,并且在这两种酒中分别检测到除酿酒酵母外的乳酸菌(酒酒球菌)和醋酸菌(食蔗糖葡糖酸醋杆菌)。D-丙氨酸、D-谷氨酸可能由这些微生物中含有的丙氨酸消旋酶和谷氨酸消旋酶同系物作用而形成,但D-赖氨酸的来源尚未明晰,推测可能是由其中底物特异性较低的消旋酶作用而产生[11]。在日本清酒的酿造过程中,酿造用水、酿造工艺、大米抛光率、清酒酵母种类以及清酒中存在的微生物都会影响其中D-氨基酸浓度。Gogami等从日本清酒中检测到15 种D-氨基酸(D-丙氨酸、D-天冬氨酸、D-天冬酰胺、D-谷氨酸、D-谷氨酰胺、D-精氨酸、D-脯氨酸、D-亮氨酸、D-异亮氨酸、D-组氨酸、D-酪氨酸、D-赖氨酸、D-丝氨酸、D-缬氨酸和D-苯丙氨酸),其中以D-丙氨酸、D-天冬氨酸和D-谷氨酸浓度最高(66.9~524.3 μmol/L),D-对映体占比分别为34.4%、12.0%和14.6%[12]。该研究团队随后又发现发酵产生的D-氨基酸对清酒风味具有突出贡献,尤其是D-丙氨酸含量升高可提升清酒的鲜味[13]。Erbe等[14]检测了多种啤酒中的D-氨基酸含量,其总D-氨基酸质量浓度为12.2~88.8 mg/L(0.7%~11.7%);其中,柏林白啤酒的D-丙氨酸(22.5 mg/L;30.1%)和D-脯氨酸(51.9 mg/L;21.1%)含量之高尤为突出,此外还检测到D-天冬氨酸(5.2 mg/L;14.7%)、D-谷氨酸(6.6 mg/L;10.9%)、D-赖氨酸(1.3 mg/L;4.0%)和D-苯丙氨酸(1.3 mg/L;3.2%),Erbe等[14]推测这些D-氨基酸的产生主要缘于乳酸菌中消旋酶的作用。随着存放时间的延长,食醋和酒中的D-氨基酸含量也有所增加[14-15]。发酵乳制品酸奶和奶酪中也含有丰富的D-氨基酸,如奶酪中相对含量较高的D-丙氨酸、D-天冬氨酸和D-谷氨酸的占比范围分别达16.1%~48.1%、13.9%~46.3%和10.9%~26.6%;另外还存在相对丰度较低的D-赖氨酸、D-缬氨酸、D-脯氨酸、D-色氨酸、D-亮氨酸等[16]。酸奶也主要含有D-丙氨酸、D-谷氨酸和D-天冬氨酸[16]。发酵乳制品中的D-氨基酸含量也是评价发酵程度的指标之一[17]。经乳酸菌发酵后的橙汁含有游离D-缬氨酸(62.3%)、D-丙氨酸(32.7%)、D-苯丙氨酸(20.0%)、D-谷氨酸(24.3%)、D-丝氨酸(2.6%)、D-天冬氨酸(0.8%)[18]。Abe等[19]测定了60 种发酵鱼露中的游离D-氨基酸,主要存在的D-氨基酸为D-丙氨酸、D-天冬氨酸和D-谷氨酸,其中以D-丙氨酸含量最高。值得注意的是,多数D-氨基酸(除D-脯氨酸和D-天冬氨酸外)具有甜味,对于发酵食品的风味具有独特的贡献[13,19-20]。各类乳制品及发酵食品中的D-氨基酸含量如表2和表3所示。

表2 乳制品中的D-氨基酸含量Table 2 Contents of D-amino acids in dairy products
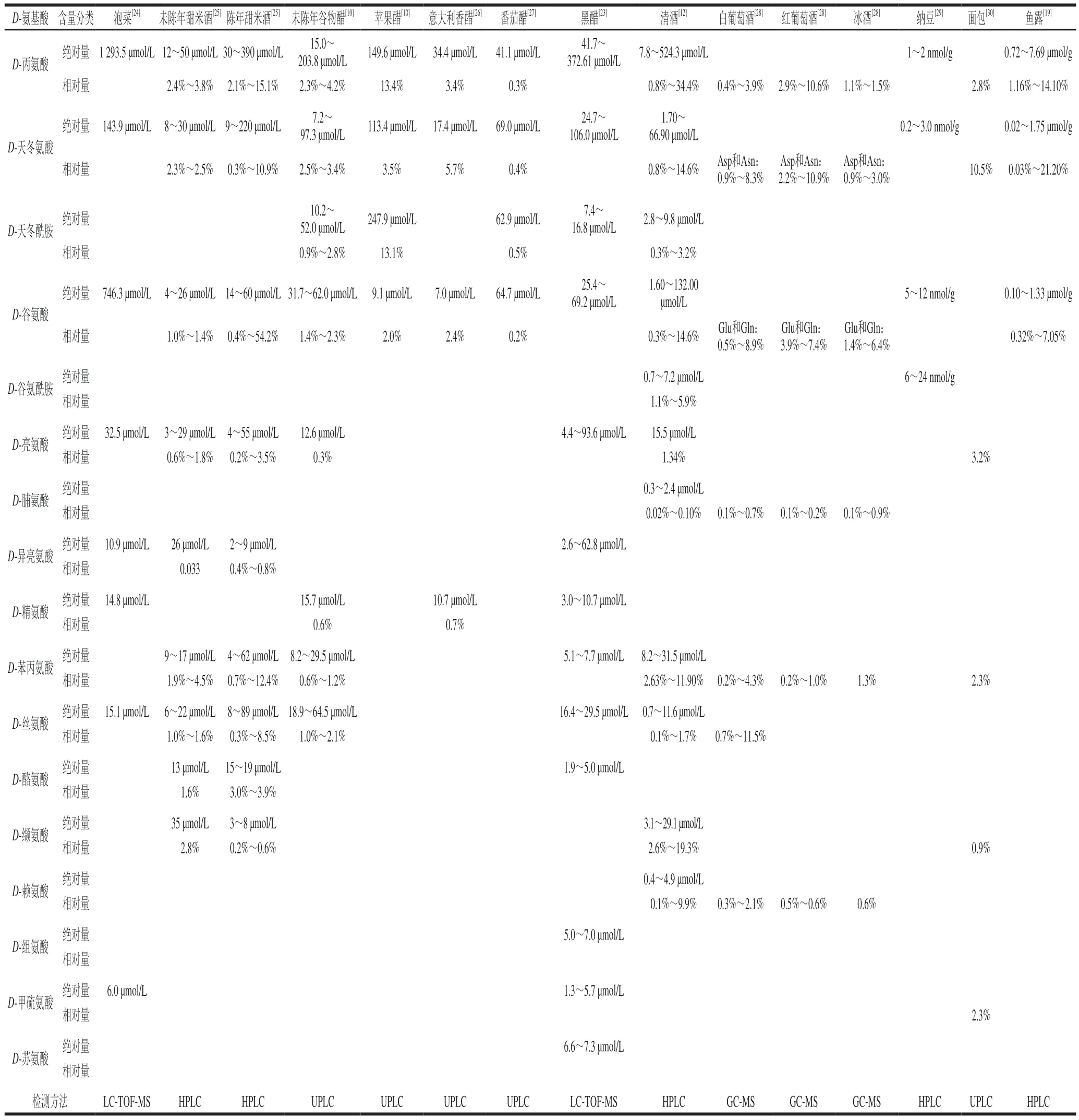
表3 其他发酵食品中的D-氨基酸含量Table 3 Contents of D-amino acids in other fermented foods
1.2 温度和pH值
除了在相关酶的催化下可形成D-氨基酸外,极端pH值和/或加热条件也可诱导食品中的L-氨基酸发生外消旋化而形成D-氨基酸。
未陈年和陈年的日本甜米酒中均有D-丙氨酸、D-天冬氨酸、D-谷氨酸、D-亮氨酸、D-异亮氨酸、D-苯丙氨酸、D-丝氨酸、D-缬氨酸、D-酪氨酸检出;陈年甜米酒中的D-丙氨酸(2.1%~15.1%)、D-天冬氨酸(0.3%~10.9%)、D-谷氨酸(0.4%~54.2%)的平均含量占比高于未陈年甜米酒[25]。进一步研究发现,甜米酒熟化过程中伴随着美拉德反应,同时体系pH值会随着熟化时间延长而降低,D-天冬氨酸的占比也受pH值的影响:D-天冬氨酸在pH 4.0时的占比(11.3%)高于pH 5.6(5.1%)。陈年甜米酒中D-氨基酸含量较高可能是由不同pH值下烯醇化途径的变化引起的。美拉德反应中Amadori重排产物在酸性条件下主要经历1,2-烯醇化,在中性条件下主要经历2,3-烯醇化[31],而所有烯醇(1,2-和2,3-烯醇)可以形成各自的碳阴离子,故Inoue等[25]推测两个碳负离子之间的结构差异会影响氨基酸的外消旋度。Taniguchi等[24]探究了在不同储藏温度下的泡菜中游离D-氨基酸含量的变化,12 种D-氨基酸(D-丙氨酸、D-天冬氨酸、D-谷氨酸、D-丝氨酸、D-亮氨酸、D-异亮氨酸、D-天冬酰胺、D-组氨酸、D-苯丙氨酸、D-精氨酸、D-酪氨酸和D-甲硫氨酸)的含量随着储藏时间延长均升高,且在25 ℃下的变化较4 ℃显著,尤其是在25 ℃下D-丙氨酸、D-谷氨酸和D-精氨酸的占比分别高达22.2%、23.4%和34.3%。
在一定温度和pH值的食品加工体系中常伴随着美拉德反应的发生,反应产物中的Amadori化合物也是D-氨基酸形成的一种前体[31-32]。Pätzold等[31]发现在微波炉中对蜂蜜进行微波加热(180 W、3 min或700 W、1 min)处理后,D-氨基酸含量显著增加,并指出D-天冬氨酸、D-丙氨酸、D-苯丙氨酸和D-亮氨酸可以在体系中葡萄糖的诱导下消旋形成。Pätzold等提出的外消旋化机制为:美拉德反应的Amadori重排产物形成后,氨基酸与葡萄糖的反应便开始。Amadori重排产物容易发生烯醇化,烯醇化有利于从键合氨基酸的α-碳原子中提取质子,形成中间体sp3杂化碳阴离子。这些反应也可能有利于分子内氢桥的形成。平面碳负离子的两侧可发生再质子化反应,从而产生部分外消旋的氨基酸。而外消旋程度取决于氨基酸侧链的空间和电子性质[31,33]。在可可豆在热加工过程中,D-氨基酸含量会随着温度升高而增加。一种产自非洲象牙海岸的可可豆在150 ℃下烘焙 2 h后,D-氨基酸的相对含量升高(D-脯氨酸37.0%、D-丙氨酸17.0%、D-异亮氨酸11.7%、D-天冬氨酸和D-天冬酰胺11.1%、D-酪氨酸7.9%、D-丝氨酸5.8%、D-亮氨酸4.8%、D-苯丙氨酸4.3%和D-缬氨酸1.2%)[34]。Pätzold等[31,34]推测可可豆中D-氨基酸是由美拉德反应的Amadori产物形成。并合成了果糖-L-苯丙氨酸和果糖-D-苯丙氨酸加以验证,将二者在200 ℃下加热 5~60 min后,生成了11.7%D-苯丙氨酸和11.8%L-苯丙氨酸[34]。与之相类似,在烟草、雪茄[35]、水果(葡萄、苹果、梨、石榴、枣)和各种其他植物(多肉玛瑙、甜菜根、甘蔗、角豆)的加工汁液[36]、麦汁和香醋[37]中也检测到经美拉德反应而产生的D-氨基酸。
在一定的碱性条件下,质子从氨基酸的不对称碳原子中被去除而形成带负电荷的碳负离子。当碳负离子与质子结合时,理论上将形成等量的D-和L-对映体(各占50%)[26,38],因而食品加工中的高温碱性环境也可能会促进L-氨基酸消旋形成D-氨基酸。研究人员将α-乳清蛋白、β-乳球蛋白、α-酪蛋白、溶菌酶和牛血清白蛋白以及混合的游离氨基酸在pH 9、83 ℃的环境下反应0.5~24 h或96 h后发现,大多氨基酸均发生消旋化反应而生成D-氨基酸,其中半胱氨酸、丝氨酸和天冬氨酸的消旋率较高[39]。进一步的研究表明,对于游离氨基酸,其外消旋速率约为结合残基的10%,外消旋化的主要驱动力是侧链的吸电子能力(天冬氨酸除外);而对于结合态氨基酸,其外消旋化受氨基侧链效应、与主体蛋白质相关因素以及碱性条件的诱导[39]。橄榄中富含D-氨基酸,其总量达18.6~38.2 mg/100 g,主要的D-氨基酸为D-天冬氨酸、D-谷氨酸、D-丝氨酸和D-亮氨酸[8]。据报道,橄榄中游离氨基酸在碱液(pH 8.3~10.3)中热处理(121 ℃)时的外消旋程度显著增加,尤以L-丝氨酸和L-丙氨酸的消旋程度变化最为明显。121 ℃下加热35 min后,橄榄中的游离D-丝氨酸和D-丙氨酸占比分别约为20%和11%。随着环境pH值的增加,L-丝氨酸、L-丙氨酸和L-天冬酰胺的外消旋值随之增加,而L-天冬氨酸的外消旋值略有下降,L-谷氨酸的外消旋值变化不大;并且高温灭菌工艺也会提升部分氨基酸的外消旋程度[8]。Chang等[26]研究了蛋清和蛋黄中的氨基酸在碱性条件处理下的消旋程度变化,发现蛋清中氨基酸的消旋值依次为:丝氨酸>天冬氨酸>谷氨酸>苯丙氨酸>亮氨酸>缬氨酸>苏氨酸=异亮氨酸(消旋能力依次减弱),而蛋黄中氨基酸的消旋值顺序依次为:天冬氨酸>谷氨酸>苯丙氨酸>亮氨酸>缬氨酸,进而指出氨基酸外消旋化趋势与其侧链的性质、pH值和处理时间密切相关。
2 食品中D-氨基酸的检测方法
食品中D-氨基酸的检测可为控制加工食品的品质、研究食源性D-氨基酸的营养代谢及生理功能等方面的研究提供不可或缺的信息。
2.1 高效液相色谱/超高效液相色谱法
HPLC的原理为利用高压输液系统,通过将不同极性的流动相泵入内置固定相色谱柱中而分离出样品中的不同成分,最后经检测器完成检测。在食品D-氨基酸的检测中,基于不同的检测原理又可将HPLC或UPLC分为直接法和间接法。
直接法是指基于手性固定相或非手性衍生试剂的方法,然后在手性固定相或流动相上分离氨基酸对映体[3]。Sardella等[40]优化了一套基于手性配体交换型固定相分离检测氨基酸对映体的方法,用以评估两种西班牙奶酪样品中D-丙氨酸、D-天冬氨酸和D-谷氨酸的含量变化。首先用强阴离子交换树脂和离子强度梯度洗脱法提取氨基酸,通过优化反向HPLC流动相中的离子对试剂使丙氨酸、天冬氨酸和谷氨酸与其他氨基酸完全区分开,再利用基于七氟丁酸为离子对试剂的离子对反相-HPLC(配备蒸发光散射检测器)进行分离检测。Xu Yu等[41]基于HPLC-四极杆飞行时间质谱建立了一套针对茶叶中D-氨基酸的检测方法,将茶叶提取物通过离子交换固相萃取富集后,利用配备手性柱的HPLC分离氨基酸对映体,随后使用高分辨率四极杆飞行时间质谱进行检测和鉴定。
间接法是指基于手性试剂的柱前衍生方法,通过将氨基酸对映体与手性试剂进行衍生化反应,拆分后形成非对映体,然后通过色谱进分离和检测,具有准确性高、分析时间短、适应范围广等特点[42]。邻苯二甲醛(o-phthalaldehyde,OPA)已被广泛用作拆分对映体氨基酸的衍生化试剂。OPA在碱性介质以及手性硫醇化合物存在的环境中,与氨基酸对映体反应生成可发荧光的非对映异构体产物,故能够利用配备荧光检测器的HPLC进行分析[43]。Inoue等[25]将米酒经OPA和N-异丁酰基-L-半胱氨酸衍生化处理后,利用反向HPLC进行分析,发现了米酒中的L-天冬氨酸在陈年过程中会经美拉德反应消旋为D-天冬氨酸。Csapo等[44]为探究不同水解条件对牛乳蛋白中氨基酸消旋的影响,将乳蛋白水解物经OPA和2,3,4,6-O-四乙酰基-1-硫代-β-D-葡萄糖(2,3,4,6-tetra-O-acetyl-1-thio-β-D-glucopyranoside,TATG)衍生化后,通入氮气混合均匀并静置,再进行HPLC分析。Casado等[8]在探究不同碱性加工条件对橄榄中D-氨基酸形成的影响时,将橄榄中提取的氨基酸经OPA和N-异丁基L-Cys(N-isobutyryl-L-cysteine,IBLC)或N-异丁基D-Cys(N-isobutyryl-D-cysteine,IBDC)衍生化,再进行HPLC分析。1-氟-2-4-二硝基苯基-5-L-丙氨酸酰胺(1-fluoro-2-4-dinitrophenyl-5-L-alanine amide,FDAA)[45]是一种常用的衍生剂,在40 ℃碱性环境中,FDAA可在不发生外消旋反应的情况下,与L-和D-氨基酸的α-氨基发生化学计量反应而产生非对映体,因其各自产生的非对映体的容量因子差异较大,因此可以通过HPLC进行分离和检测,其精度可达纳摩尔级别[46]。Manabe[47]采用薄层色谱和HPLC相结合的方法分析纳豆黏液中的D-氨基酸组成,其将纳豆黏液部分提取出的氨基酸经FDAA衍生化处理后,将衍生物经薄层色谱分离,再将分离得到的组分通过HPLC进一步分析,结果表明其中含有的D-氨基酸为D-谷氨酸、D-丙氨酸和D-天冬氨酸。最近,Jin Yueying等[29]合成了一种新型荧光衍生试剂DBD-(S)-2-甲基脯氨酸(DBD-trans-2-methyl-L-proline,DBD-M-Pro)并应用于UPLC分析,该试剂可以用于高效、灵敏地检测纳豆中游离D/L-氨基酸。从纳豆中提取的氨基酸与DBD-M-Pro在60 ℃下反应60 min后,经BEH C18柱梯度分析20 min即可完成检测;4 种氨基酸(D/L-谷氨酰胺、D/L-天冬氨酸、D/L-谷氨酸和D/L-丙氨酸)衍生后的非对映体分辨率为1.65~3.50,检测限达0.25~2.50 pmol,平均回收率为86.65%~118.70%。
2.2 气相色谱-质谱法
气相色谱与质谱仪串联使用可达到更高的灵敏度、选择性、检测精度和分析效率,更适用于分析氨基酸含量较低的食品样本。利用GC-MS法检测氨基酸对映体时通常使用手性固定相(如Chirasil-L-Val毛细管柱)分离对映体。Ali等[35]用GC-MS在选择离子监测模式下测定了25 种欧洲鼻烟和8 种咀嚼烟草中游离L-和D-氨基酸的含量,以探究不同烟草样品中的D-氨基酸谱。在此方法中,烟叶中的氨基酸通过阳离子交换剂纯化而得,再经乙酰氯衍生化,在Chirasil-L-Val毛细管柱上通过GC-MS-选择离子监测模式对氨基酸对映体进行分离和定量。与之相类似,Pätzold等[34]使用阳离子交换剂从可可豆及其制品中分离氨基酸,并将其转化为挥发性氨基酸衍生物,并在Chirasil-L-Val毛细管柱上通过配备火焰离子化检测器的GC-MS进行分析。Abe等[48]建立了一种检测葡萄酒中氨基酸对映体的气相色谱法。葡萄酒中的氨基酸对映体先在碱性水介质中与新戊酰氯酰化,再与甲基硅基重氮甲烷发生酯化反应,由此得到的氨基酸衍生物在涂有聚二甲基硅氧烷的毛细管柱上进行分离。Casal等[49]为对比研究不同品种咖啡豆中的氨基酸谱,将咖啡豆中提取出的氨基酸经2,2,3,3,4,4,4-七氟-1-丁醇/吡啶混合物和氯甲酸乙酯衍生,利用氯仿萃取后经Chirasil-L-Val毛细管柱并通过氢火焰离子检测器进行分析;该方法的回收率在90.5%~102.6%,定量限为0.3~12.0 mg/kg。
2.3 毛细管电泳法
毛细管电泳是一种结合了电迁移和色谱技术的检测方法,因其具备分析成本较低,短时高效等特点而越来越广泛地应用于食品中氨基酸对映体的分析。此方法通常需使用衍生化试剂(如异硫氰酸荧光素(fluorescein isothiocyanate,FITC)并结合质谱或微电动色谱(micellar electrokinetic chromatography,MEKC)等进行检测分析[50]。Sánchez-Hernández等[51]优化了基于电泳-串联质谱测定蛋白水解物中氨基酸对映体的方法。提取的游离氨基酸经FITC衍生化处理,一方面使氨基酸在电喷雾电离-质谱检测中具备更高的灵敏度;另一方面,氨基酸的衍生化部分与环糊精产生额外的相互作用也助于分离性能的提高。在环糊精作为手性选择剂的体系中,通过毛细管电泳-串联质谱法测定水解蛋白肥料中所含游离氨基酸的外消旋程度。在分辨率高于1.0且检测限为0.02~0.80 μmol/L的条件下,实现了多达14 种氨基酸对映体的分离,此方法被应用于控制水解蛋白肥料的纯度[51]。虽然手性电泳-质谱方法已具有良好的选择性以及可以通过分子质量测定以准确定性的优点,但为了进一步提升检测灵敏度,与毛细管电动色谱-激光诱导荧光(micellar electrokinetic chromatography-laser-induced fluorescence,MEKC-LIF)相结合的氨基酸对映体检测方法因运而生。Carlavilla等[52]优化了一种基于MEKC-LIF能够高效灵敏地定量分析醋中D-/L-氨基酸的方法。提取出的氨基酸经FITC衍生后,通过手性MEKC-LIF程序得以检测,实现了5 对氨基酸对映体(脯氨酸、丙氨酸、精氨酸、谷氨酸和天冬氨酸)的分离,20 min内即可完成分析且检测限在16.6 nmol/L以下。
为适应更高的检测要求,各种新型检测方法仍在不断优化与更新,例如基于传感器检测食品中D-氨基酸的新方法已有一定范围的应用[53-54]。此外,新型衍生化试剂、检测器等也在不断地发展与完善[55]。
3 D-氨基酸的生理功能
长期以来,D-氨基酸的生理功能未得到充分关注,人们对其功能尚未形成系统性认知,目前关于其功能的认知主要集中于以下两方面:1)部分D-氨基酸作为细菌细胞壁的肽聚糖层的组成成分[56];2)D-氨基酸作为少数抗生素的组成成分。
3.1 神经调节功能
在哺乳动物的神经系统中发现存在多种D-氨基酸,主要为D-丝氨酸、D-天冬氨酸、D-丙氨酸和D-半胱氨酸。这些D-氨基酸的存在引起了研究人员的兴趣,其对于神经系统的调节功能正在逐步被揭示。在神经系统中,N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体介导突触传递从而调节神经元活动,且在调控学习和记忆活动中的作用至关重要[57-58]。研究发现,D-丝氨酸、D-天冬氨酸和D-丙氨酸都能与NMDA受体结合。其中,早在20世纪90年代,D-丝氨酸已被发现是哺乳动物大脑内的一种神经递质,参与着多种神经信号传导活动[59]。进一步研究揭示,D-丝氨酸是NMDA受体的共激动剂,通过丙氨酸-半胱氨酸转运体-1或其他途径进入突触,从而调节NMDA受体的活性,参与大脑皮层的信号传递[59]。D-丝氨酸水平下降可能导致NMDA受体功能受到抑制,从而引发类似精神分裂症的症状[60]。在一项由28 名精神分裂症患者参加的为期6 周的双盲安慰剂对照实验中,患者在服用抗精神药物的同时亦口服D-丝氨酸(30 mg/(kgmbg d)),患者认知症状得到显著改善[60]。近年,一项以果蝇为模型的研究揭示了D-丝氨酸亦可通过作用于NMDA受体而调节睡眠[61]。此外,D-天冬氨酸也作为NMDA受体的激动剂,通过与NMDA受体的谷氨酸位点结合而参与调节神经活动[62]。在小鼠模型中发现,连续7 周摄入D-天冬氨酸可上调NMDA受体亚基的表达水平并改善学习记忆能力[63]。老年小鼠在灌胃D-天冬氨酸后,其海马体中的突触可塑性衰退得到缓解[64]。此外,D-天冬氨酸亦在增强学习记忆能力[65]和改善抑郁[66]方面具有潜在功能。早于1989 年,D-丙氨酸已被证实是N M D A 受体甘氨酸结合位点的一种有效的立体选择性协同激动剂,在神经调节中发挥重要功能[67]。在1 项由32 名精神分裂症患者参加的为期6 周的双盲安慰剂对照D-丙氨酸实验(100 mg/(kgmbg d))中,服用D-丙氨酸患者的临床症状得到明显改善[68]。D-半胱氨酸可以在D-氨基酸氧化酶的作用下产生H2S,从而间接促进NMDA受体的神经传导功能[69],其被视为一种潜在的新型神经保护剂[70]。
3.2 调节激素合成与分泌
生物体的内分泌系统中广泛存在着D-氨基酸,其中尤以D-天冬氨酸丰度最高。目前,D-天冬氨酸已多用于激素合成与释放方面的研究。在大鼠松果体中,D-天冬氨酸可抑制褪黑素合成(半抑制浓度为75 μmol/L)[71],并减少体外培养的松果体细胞中褪黑素的释放[72]。D-天冬氨酸可通过增强类固醇生成酶活性以上调大鼠大脑中的性激素水平[73]。一项大鼠模型实验结果表明,口服D-天冬氨酸使睾酮水平提升约110%,孕酮水平提升约40%,17β-雌二醇水平提升约35%[73]。在大鼠下丘脑中,D-天冬氨酸的水平在哺乳期间升高并会促进催产素生成。D-天冬氨酸可通过NMDA受体直接刺激催乳素的释放;D-天冬氨酸也可能通过减少垂体后叶γ-氨基丁酸的释放来刺激催乳素的释放[74]。在人体和大鼠实验中均证实D-天冬氨酸可促进垂体中黄体生成素的释放[75]。不仅如此,D-天冬氨酸可调节多巴胺的释放[76]。D-天冬氨酸亦在哺乳动物的生殖功能方面发挥关键作用。在睾丸内,D-天冬氨酸可促进睾酮的释放[75],上调雄激素受体的表达并下调雌激素受体的表达[77]。在一项临床试验中,服用D-天冬氨酸的亚生育期患者的精子的数量和活动性得到改善,且其配偶的怀孕率得以提高[78]。存在于垂体中分泌促肾上腺皮质激素的细胞和胰腺β细胞中的D-丙氨酸参与哺乳动物的血糖调节[79]。D-丝氨酸可能通过调节胰岛素分泌而参与调控机体的糖代谢[79]。
3.3 抗生物膜形成
抑制生物膜形成是一种新型有效的抗菌治疗策略,近年来,关于D-氨基酸在生物膜形成中的功能及应用已备受关注[80-81]。体外实验表明,D-组氨酸、D-半胱氨酸和D-色氨酸在4 mmol/L时抑制鲍曼不动杆菌的生物膜形成(抑制率分别为47%、92%、75%);D-半胱氨酸、D-色氨酸和D-酪氨酸在4 mmol/L时抑制铜绿假单胞菌的生物膜形成(抑制率分别为32%、19%、25%)[82]。D-天冬氨酸(50 μg/mL)可有效抑制白色念珠菌黏附及其生物膜形成[27]。D-丙氨酸、D-丝氨酸、D-蛋氨酸和D-色氨酸可通过靶向抑制丙氨酸消旋酶的水平而抑制并分解由空肠梭菌和大肠杆菌形成的生物膜,且D-氨基酸混合物可将D-环丝氨酸抗生素的功效增强32%[83]。D-酪氨酸、D-天冬氨酸、D-色氨酸和D-亮氨酸可降低从自污泥中分离的混合微生物的黏附性和抑制生物膜形成[84]。单种D-氨基酸(D-亮氨酸、D-蛋氨酸、D-色氨酸和D-酪氨酸)和被等离子体聚合物包埋后的复合物均可破坏不同成熟度的粪肠球菌生物膜[85]。
3.4 免疫调节活性
哺乳动物先天性和适应性免疫反应通过使用模式识别受体来检测保守的细菌和病毒成分[86]。虽然目前关于D-氨基酸与模式识别受体的识别结合作用尚不明晰,但已发现D-氨基酸可被一些受体(如G蛋白偶联受体)和酶(如D-氨基酸氧化酶)识别,从而在机体发挥免疫调节活性[87]。肠道中的D-氨基酸在D-氨基酸氧化酶的作用下产生抗菌产物H2O2以保护小肠黏膜表面免受霍乱病原体的侵害,进而维护肠道内环境稳态[88]。在诱导哮喘前给小鼠喂食D-色氨酸可增加肺和肠道的调节性T细胞数量,降低肺部辅助型T细胞2反应,改善过敏性气道炎症及其高反应性[89]。D-苯丙氨酸和D-色氨酸通过激活G蛋白偶联受体GPR109B在人类中性粒细胞中引发趋化反应[90]。在金黄色葡萄球菌感染情况下,D-亮氨酸和D-苯丙氨酸可激活先天免疫反应,通过刺激T1R2/3甜味受体而抑制抗菌肽释放以减缓感染[91-92]。
3.5 保护皮肤稳态
部分D-氨基酸(D-丙氨酸、D-天冬氨酸、D-甲硫氨酸和D-谷氨酸)具有维护皮肤稳态的功能。其中,D/L-丙氨酸均可有效促进表皮角质形成细胞的层黏连蛋白332的生成,从而增强基底膜修复,并且D-丙氨酸表现出比L-丙氨酸高4~5 倍的促进效果[93]。在过氧化氢诱导的氧化损伤细胞模型上,D-天冬氨酸能减缓真皮成纤维细胞的氧化毒性损伤[93]。D-甲硫氨酸(0.1~10.0 μmol/L)能够显著提高经UVA 照射后真皮成纤维细胞的存活率,且在相同浓度下D-甲硫氨酸表现出较L-甲硫氨酸更强的保护作用[93]。D-谷氨酸是一种 NMDA 型离子通道的抑制剂,能够抑制Ca2+向细胞内流入,从而维持细胞膜内外电位差,进而促进皮肤屏障功能恢复[93]。
3.6 含D-氨基酸的肽的生物活性
目前,关于食品中含D-氨基酸的肽还鲜有报道,此类研究仅限于从低等生物中发掘出的含有D-氨基酸的生物活性肽[94]及人工合成含D-氨基酸的肽[95]。Carlo等[96]从南美树蛙的皮肤中分离出1 种含D-丙氨酸的蛙皮啡肽,其是与µ-型阿片受体高亲和力和选择性结合的多肽,其在深度长效镇痛方面较吗啡强1000 倍。漏斗蛛网毒素是从漏斗网蜘蛛的毒液中鉴定出的一种由48 个氨基酸组成的天然多肽,其第46位为D-丝氨酸,该多肽是神经系统中小脑浦肯野细胞的一种强效P型钙通道抑制剂[97]。此后,陆续在多种生物(包括甲壳类动物、软体动物和鸭嘴兽等)中也发现了具有各种生理活性的含D-氨基酸多肽[98]。此外,研究人员还发现了诸多含有D-氨基酸的细胞信号肽、宿主防御肽和多肽类激素[99-101]。多肽中的D-氨基酸通常会增强其结构的稳定性和活性[100]。目前的研究主要认为D-氨基酸不是在前体多肽中被异构酶转化的,而是在合成多肽的翻译后修饰过程中才被异构酶转化生成的[98,102]。
4 结语
近年来,以D-氨基酸为主要成分的功能性食品正在市场上崭露头角,如日本资生堂公司生产的富含D-氨基酸的美容养颜功能性食品(kireinosusume),其强调人类角质层中存在多种D-氨基酸,而补充D-氨基酸有助于激活皮肤角质层中的成纤维细胞以产生更多胶原蛋白[103];美国Doctor’s Best公司也上市了一款用于维护情绪健康的D-苯丙氨酸膳食补充剂。D-氨基酸的重要性已受到越来越多的关注,其有望作为潜在的新型营养补充剂进入功能性食品市场。
但相比于L-氨基酸,D-氨基酸的吸收代谢及营养功能方面的研究尚不充分,D-氨基酸作为天然存在于食品原料以及食品加工中产生的副产物,其在人体生理健康中发挥着的独特作用仍亟待挖掘。未来在D-氨基酸的研究中有待解决的关键问题有:1)食源性摄入的D-氨基酸在人体内吸收代谢机制,其中涉及是否存在尚未被鉴定的D-氨基酸转运体以及参与该过程的相关酶系等;2)食品中含D-氨基酸多肽的鉴定及功能机制研究;3)制备含有特定D-氨基酸的工业化产品以进一步打造新型功能性食品。
