葡萄籽原花青素通过Nrf2信号通路拮抗高糖高脂诱导的MIN6细胞铁死亡
2023-02-12张丽媛刘丹丹李海燕王同玲杨瑞瑞丁玉松
张丽媛,刘丹丹,李海燕,王同玲,陆 恒,杨瑞瑞,王 浩,丁玉松,*
(1.石河子大学医学院,新疆 石河子 832000;2.新疆第二医学院公共卫生学院,新疆 克拉玛依 834000)
2型糖尿病(type 2 diabetes mellitus,T2DM)是一类以糖脂代谢紊乱为特征的代谢性疾病[1],胰岛β细胞功能衰竭是T2DM发展的核心机制,有研究发现长期暴露在高水平的游离脂肪酸和葡萄糖条件下,最终导致胰岛β细胞受损引起胰岛素的分泌减少[2]。然而,高糖高脂(high glucose and high fat,GP)环境下胰岛β细胞受损的机制尚未完全阐明。
铁死亡是由于铁的过量累积导致活性氧(reactive oxygen species,ROS)水平升高,发生脂质过氧化,诱导细胞死亡的一种新型调节性细胞死亡形式[3],其主要表现形式为铁沉积、ROS累积、谷胱甘肽(glutathione,GSH)耗竭。流行病学研究发现过量的铁贮存与T2DM的高风险有关[4],体外实验研究证实饲喂高脂饮食的大鼠补充给予铁剂能够加重大鼠胰腺组织的炎症和氧化损伤[5],体内研究发现高糖能够诱导胰岛β细胞铁沉积[6]。Wei Sen等[7]的研究发现砷通过诱导细胞内铁沉积,增加脂质过氧化物的浓度导致胰腺组织发生铁死亡。因此,铁死亡有望成为治疗和预防T2DM的新靶点。
核转录因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)信号通路是细胞抗氧化的关键通路,Nrf2信号通路被认为在T2DM中起着重要的抗氧化作用[8],且已经成为脂质过氧化和铁死亡的关键调节因子[9]。研究发现,在高糖环境下,将Nrf2的基因特异性敲除后增加了细胞对铁死亡的敏感性,非诺贝特治疗通过上调Nrf2进而抑制细胞铁死亡[10]。葡萄籽原花青素提取物(grape seed procyanidin extract,GSPE)是一种天然的多酚类化合物,具有抗氧化和降低血糖、血脂的能力,本课题组前期实验发现,GSPE能够通过激活Nrf2信号通路降低糖尿病大鼠的血糖水平,增强组织的抗氧化能力[11],综上,GSPE是潜在的治疗糖尿病的天然药物。因此,本研究拟通过GP干预小鼠胰腺瘤细胞MIN6细胞,建立胰岛β细胞损伤模型。以GSPE进行干预,探讨GP是否通过抑制Nrf2信号通路导致细胞铁死亡,进而探讨GSPE是否通过调控Nrf2信号通路拮抗GP诱导的MIN6细胞铁死亡。
1 材料与方法
1.1 材料与试剂
小鼠胰岛β细胞MIN6细胞(XF0390)购自上海富恒生物科技有限公司。
G P 试剂盒 西安鲲鹏科技有限公司;G S P E北京索莱宝公司;ROS、MDA、GSH试剂盒 南京建成生物工程研究所;去铁胺(deferoxamine,DFO)(10 μmol/L)、RAS选择性致死(RAS-selective lethal,RSL3)(10 μmol/L)、Erastin(20 μmol/L)、坏死抑制剂坏死抑素1(necrostatin-1,Nec-1)(10 μmol/L)、泛Caspase抑制剂(pan caspase inhibitor,Z-VAD-FMK)(10 μmol/L)、自噬抑制剂氯喹(chloroquine,CQ)(10 μmol/L) 美国Med Chem Express公司;细胞计数试剂盒(cell counting kit-8 assay,CCK8) 安徽白鲨生物公司;兔抗Nrf2多克隆抗体、兔抗血红素氧化酶1(heme oxygenase-1,HO-1)单克隆抗体、兔抗醌氧化还原酶1(NADPH: quinone oxido-reductase-1,NQO1)单克隆抗体、铁代谢指标兔抗转铁蛋白受体1(transferrin receptor 1,TfR1)单克隆抗体、兔抗二价金属离子蛋白转运体(divalent metal transporter 1,DMT1)单克隆抗体、兔抗铁蛋白(ferritin)单克隆抗体、铁死亡的指标蛋白兔抗溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)单克隆抗体、兔抗谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)单克隆抗体、兔抗酰基合成酶长链家族成员4(acylcoa synthetase long-chain family member 4,ACSL4)单克隆抗体 英国Abcam公司;羊抗兔免疫球蛋白(immunoglobulin,Ig)G、羊抗鼠IgG 北京中杉金桥生物技术有限公司;抗鼠β-actin单克隆抗体武汉博士得生物工程有限公司;焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水 苏州吉玛基因股份有限公司。
1.2 仪器与设备
FC酶标仪 赛默飞世尔(上海)仪器有限公司;3111二氧化碳培养箱 世尔科技(阿什威尔)有限公司;SW-CJ-2FD净化工作台、SSW-420-2S电热恒温水槽、GZX-9070MBE电热鼓风干燥箱 上海博迅医疗生物仪器有限公司;101电热鼓风干燥箱 北京市永光明医疗仪器有限公司;KQ-500DE数控超声波清洗器 昆山市超声仪器有限公司;SCIENTZ超声波细胞粉碎机宁波新芝生物科技股份有限公司;Ti2-LAPP荧光显微镜尼康仪器(上海)有限公司;TDL-50B离心机 上海安亭科学仪器厂;MLS-530L立式压力蒸汽灭菌器普和希健康医疗器械(上海)有限公司;5200化学发光仪 上海天能科技有限公司。
1.3 方法
1.3.1 细胞培养与分组
将细胞培养于1640完全培养基(由10%(体积分数,下同)胎牛血清、体积分数1%青霉素链霉素以及体积分数0.1%β-巯基乙醇配制),放置于37 ℃和5% CO2的无菌培养箱中,待细胞密度达至80%~90%下进行后续操作。
在GP诱导MIN6细胞发生铁死亡时,用25 mmol/L葡萄糖和200 μmol/L棕榈酸钠混合作为GP试剂,分别干预细胞0、12、24、48 h,测定细胞活性,筛选GP干预细胞最佳时间;将细胞分为对照组(Control组)(仅添加1640完全培养基)、GP组(25 mmol/L葡萄糖和200 μmol/L棕榈酸钠)以及不同试剂(10 μmol/L DFO、10 μmol/L RSL3、20 μmol/L Erastin、10 μmol/L Nec-1、10 μmol/L Z-VAD-FMK、10 μmol/L CQ)分别联合GP干预组,干预细胞24 h,测定细胞活性。
在测定GSPE对GP诱导MIN6细胞毒性损伤的影响时,通过不同质量浓度0、10、20、30、40、50、75、100 mg/L GSPE分别干预细胞24 h,筛选GSPE适宜干预细胞的质量浓度;然后用质量浓度10、20、30 mg/L GSPE联合GP分别处理MIN6细胞24 h,测定细胞活性。
在测定不同质量浓度GSPE对GP诱导的MIN6细胞内铁沉积、脂质过氧化、铁死亡以及通过Nrf2/HO-1对细胞发挥保护作用的影响时,将细胞分为Control(仅添加1640完全培养基)、GP、10 mg/L GSPE+GP(L-GSPE)、20 mg/L GSPE+GP(M-GSPE)组和30 mg/L GSPE+GP(H-GSPE)组,分别测定细胞活性。
1.3.2 细胞活性检测
将MIN6细胞按照7000 个/孔接种于96 孔板,在无菌培养箱中培养24 h后,进行实验操作。根据CCK8说明书,每孔加入90 μL完全培养基和10 μL CCK8试剂,置于培养箱1~3 h,检测450 nm波长处每孔的吸光度,以1640完全培养基为空白组,细胞存活率计算公式如下所示,以细胞存活率表示细胞活性。

1.3.3 MDA、GSH含量测定
MDA、GSH含量按照相应试剂盒说明书进行测定。
1.3.4 ROS水平测定
使用2’,7’-二氯荧光素二乙酸酯(2’,7’-dichlorofluorescein diacetate,DCFH-DA)作为探针评估细胞ROS水平。将MIN6细胞以每孔2 mL接种于6 孔板中,与1 μmol/L DCFH-DA孵育30 min,然后用2 mL磷酸盐缓冲液洗涤3 次。用荧光显微镜拍摄细胞的所有荧光图像,放大倍数200,用荧光强度表征ROS水平。
1.3.5 Nrf2小干扰RNA转染
为了探究铁死亡是否被Nrf2信号通路调控,用5 μL/孔Nrf2小干扰RNA(Nrf2 small interfering RNA,Nrf2 siRNA)转染MIN6细胞培养5 h后,用不同质量浓度GSPE(10、20、30 mg/L)联合GP培养MIN6细胞24 h后进行后续实验。将细胞接种于6 孔板中,使其均匀铺于板底部。取Nrf2 siRNA于10000 r/min离心5 min,将粉末离心至管底,加入62.5 μL的DEPC水,充分溶解。取1.5 mL的离心管。首先配制Nrf2 siRNA转染液,分为A液和B液,A液:取5 μL的Nrf2 siRNA溶液,加入250 μL的无血清的1640完全培养基,孵育5 min。B液:5 μL的脂质体(lipofectamine,Lip)2000溶液,加入250 μL的无血清的1640完全培养基,孵育5 min。将A液和B液混合,超净台中静置20 min后,加入6 孔板中,放置于培养箱中,培养4 h后吸出,加入pH 7.4、10 mmol/L磷酸盐缓冲溶液(phosphate buffered saline,PBS)清洗,之后加入GSPE或GP进行干预,Nrf2基因序列:GCAGGACAUGGAUUUGAUUTT(目的RNA序列5’-3’),AAUCAAAUCCAUGUCCUGCTT(目的RNA互补序列5’-3’),分别检测Nrf2、HO-1、NQO1、GPX4、SLC7A11的蛋白表达水平。
1.3.6 Western blot分析
用含1 mmol/L苯甲基磺酰氟的冰冷RIPA裂解缓冲液(phenylmethylsulfonyl fluoride,PMSF)提取蛋白,煮沸在-20 ℃备用。配制分离胶和浓缩胶后在每孔中加入各组的细胞蛋白,用不同的恒压电辐电泳,采用恒压电辐“三明治”法转膜,封闭2 h,洗膜,孵一抗过夜,洗膜,孵二抗,洗膜,进行曝光,用Image J软件定量分析蛋白灰度。
1.4 数据处理与分析
实验结果采用平均值±标准差表示,用SPSS 26.0软件进行数据统计分析。多组间的比较采用单因素方差分析,所有检验均为双侧检验,检验水准α=0.05,以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 GP诱导MIN6细胞发生铁死亡
用25 mmol/L葡萄糖和200 μmol/L棕榈酸钠联合分别处理细胞12、24、48 h,结果如图1A所示,相较于0 h组,随着时间的延长,细胞活性逐渐下降,呈现出时间效应关系,综合考虑选取24 h作为后续实验条件。使用不同的试剂(10 μmol/L DFO、10 μmol/L RSL3、20 μmol/L Erastin、10 μmol/L Nec-1、10 μmol/L Z-VAD-FMK、10 μmol/L CQ)分别联合GP干预MIN6细胞24 h,DFO是一种小分子铁螯合剂,被认为是一种有效的铁死亡抑制剂。RSL3是一种通过抑制GPX4活性来诱导铁死亡的小分子化合物,被认为是一种有效的铁死亡触发剂,Erastin抑制胱氨酸/谷氨酸反向转运体活性,同时也是一种有效的铁死亡诱导剂。Nec-1是一种细胞坏死抑制剂、Z-VAD-FMK是泛Caspase抑制剂、CQ是一种自噬抑制剂。图1B显示,与GP组相比,DFO能够缓解GP诱导的MIN6细胞死亡(P<0.05),RSL3和Erastin加重了GP诱导MIN6细胞死亡(P<0.05),同时发现凋亡抑制剂Nec-1、坏死抑制剂Z-VAD-FMK、自噬抑制剂CQ对GP诱导的MIN6细胞存活没有显著改善作用(P>0.05),结果表明,铁死亡可能存在于GP诱导的MIN6细胞死亡。

图1 不同培养时间(A)和试剂(B)干预对MIN6细胞活性的影响Fig.1 Effect of culture time (A) and drug (B) interventions on the cell viability of MIN6 cells
2.2 GSPE对GP诱导MIN6细胞毒性损伤的影响
用不同质量浓度(0、10、20、30、40、50、75、100 mg/L)的GSPE干预MIN6细胞24 h后,结果如图2A所示,与0 mg/L组相比,GSPE质量浓度在10~30 mg/L时细胞存活率无显著差异(P>0.05),表明质量浓度10~30 mg/L的GSPE对MIN6细胞存活率没有显著影响。因此,为了研究GSPE处理对GP诱导的MIN6细胞是否具有保护作用,进一步用质量浓度10、20、30 mg/L GSPE联合GP处理MIN6细胞24 h(后同),结果如图2B所示,GSPE能够减轻GP诱导MIN6细胞的毒性损伤,H-GSPE组(质量浓度30 mg/L GSPE)相较于GP单独干预组,细胞存活率显著升高(P<0.05)。
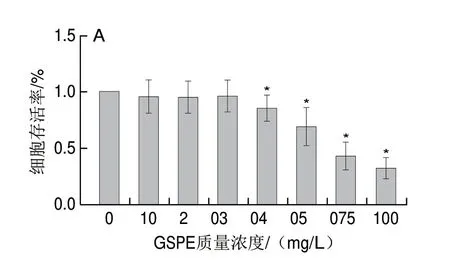

图2 不同质量浓度GSPE对MIN6细胞活性的影响Fig.2 Effect of GSPE on the cell viability of MIN6 cells
2.3 不同质量浓度GSPE对GP诱导的MIN6细胞内铁沉积的影响
图3显示,与Control组相比,GP组中的TfR1、DMT1、Ferritin蛋白表达水平显著升高(P<0.05),经过GSPE的处理后,与GP组相比,TfR1、DMT1、Ferritin蛋白表达水平显著下降(P<0.05)。以上结果表明GP诱导MIN6细胞死亡过程中伴随着铁水平的升高,经过GSPE处理后能够减少细胞内的铁水平。

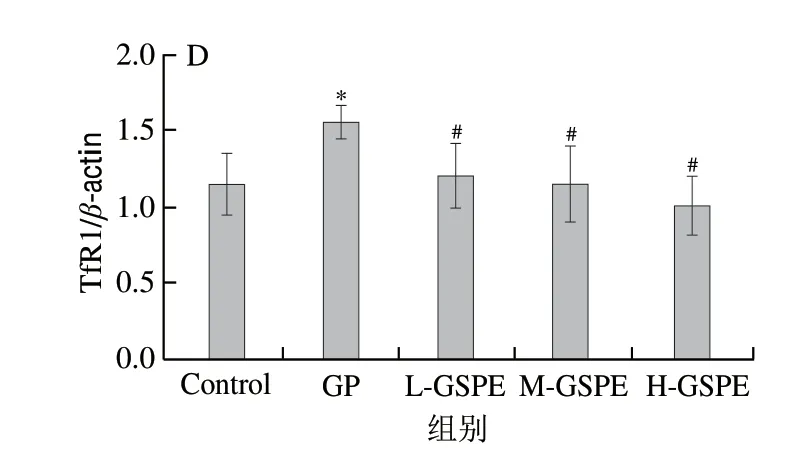
图3 不同质量浓度GSPE对MIN6细胞内铁代谢指标Ferritin、DMT1、TfR1蛋白表达水平的影响Fig.3 Effect of GSPE on protein expression levels of Ferritin,DMT1 and TfR1 in MIN6 cells
2.4 不同质量浓度GSPE对GP诱导的MIN6细胞脂质过氧化和铁死亡的影响
如图4A所示,与GP组相比,质量浓度20、30 mg/L的GSPE干预组MDA含量显著下降(P<0.05),GSH含量显著升高(P<0.05)(图4B)。相较于Control组,GP组的绿色荧光增强,GSPE处理后细胞内的荧光强度减弱(图4C),这表明GSPE可能是通过提高细胞内GSH含量,从而增加细胞内的抗氧化能力,降低MDA含量和ROS水平。本实验进一步研究了SLC7A11和GPX4、ACSL4的蛋白表达水平变化,结果显示,与Control组相比,GP组的SLC7A11和GPX4的蛋白表达水平显著降低(P<0.05),ACSL4的蛋白表达水平显著升高(P<0.05)。经过GSPE处理后,与GP组相比,中、高剂量GSPE组的SLC7A11蛋白表达水平显著升高(P<0.05),低、中、高剂量GSPE组的GPX4蛋白表达水平显著升高(P<0.05);中、高剂量GSPE组的ACSL4蛋白表达水平显著降低(P<0.05)。以上结果表明,GP诱导MIN6细胞死亡的过程中会引起脂质过氧化,这可能是因为MIN6细胞发生铁死亡的过程中存在脂质过氧化。因此,GP诱导MIN6细胞死亡的机制是铁死亡,GSPE能够通过减轻细胞内脂质过氧化,抑制MIN6细胞铁死亡。
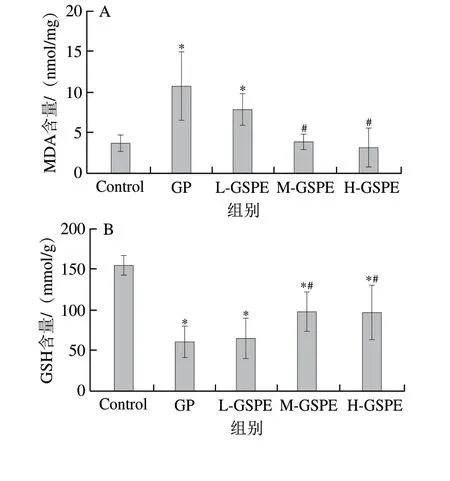
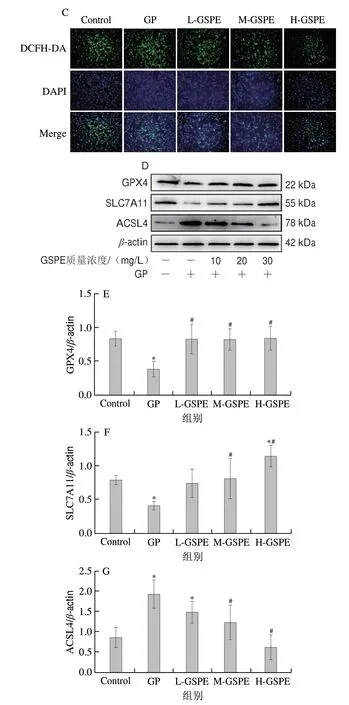
图4 不同质量浓度GSPE对MIN6细胞内MDA含量、GSH含量、ROS荧光强度和铁死亡指标GPX4、SLC7A11、ACSL4蛋白表达水平的影响Fig.4 Effect of GSPE on levels of MDA and GSH,fluorescence intensity of ROS,and protein expression of GPX4,SLC7A11 and ACSL4 in MIN6 cells
2.5 不同质量浓度GSPE通过Nrf2/HO-1对MIN6细胞发挥保护作用
由图5可知,与GP组相比,低、中、高剂量组的GSPE的NQO1蛋白表达水平显著上调(P<0.05),中、高剂量组GSPE的HO-1蛋白表达水平显著上调(P<0.05),高剂量组的GSPE的Nrf2蛋白表达水平显著上调(P<0.05),这表明GSPE能够激活Nrf2,从而提高下游的抗氧化酶HO-1、NQO1蛋白表达水平,增加MIN6细胞的抗氧化能力,改善细胞的损伤,GSPE可能是通过Nrf2信号通路来拮抗GP诱导的MIN6细胞铁死亡。

图5 MIN6细胞内Nrf2信号通路水平Fig.5 Expression levels of proteins associated with Nrf2 signaling pathway in MIN6 cells
2.6 Nrf2 siRNA与GSPE对MIN6细胞的作用
以上结果表明,GSPE可能是通过Nrf2信号通路改善GP诱导的MIN6细胞铁死亡,为了进一步研究Nrf2信号通路与铁死亡的关系,用siRNA法对MIN6细胞转染,特异性地沉默Nrf2,对MIN6细胞转染5 h后,用GP与质量浓度30 mg/L GSPE单独或者联合干预24 h。由图6可知,在相同条件下,与GSPE siNrf2组细胞相比,GSPE组细胞中Nrf2、HO-1、NQO1、GPX4、SLC7A11的蛋白表达水平显著升高(P<0.05),结果表明抑制Nrf2后细胞的抗氧化能力降低,GSPE的保护作用减弱,从而增强了GP诱导MIN6细胞铁死亡的敏感性。


图6 抑制Nrf2信号通路后MIN6细胞内GPX4、NQO1、HO-1、SLC7A11、Nrf2蛋白表达水平Fig.6 Protein expression levels of GPX4,NQO1,HO-1,SLC7A11 and Nrf2 in MIN6 cells after Nrf2 signaling pathway inhibition
3 讨论
高血糖和脂质代谢紊乱可能诱导胰岛β细胞功能障碍和细胞死亡[12],研究表明,在长期高水平的葡萄糖以及脂肪酸作用下,能够导致胰岛β细胞失代偿,即胰岛β细胞出现胰岛素分泌不足,无法维持机体正常的血糖水平,胰岛β细胞损伤是T2DM的关键标志[13]。Shu Tingting等[6]研究发现,在高糖环境下诱导的胰岛β细胞死亡是由于细胞内铁沉积导致ROS过度产生发生氧化应激,细胞内过量的铁沉积以及脂质过氧化物的增加是诱发铁死亡的主要原因[14]。Bruni等[15]研究发现,铁死亡诱导剂Erastin和RSL3处理能够损伤胰岛组织的功能和活力,但在使用DFO处理后能够改善这种损伤。在本次研究中首先建立胰岛β细胞损伤模型,研究发现随着时间的延长,GP对MIN6细胞的损伤加重,细胞存活率不断下降。加入DFO后改善细胞损伤,加入RSL3和Erastin加重了细胞损伤,但是加入Nec-1、Z-VAD-FMK、CQ并没有对细胞存活率有改善作用,并且发现GP能够导致ROS水平、MDA含量升高,这提示GP可能诱发MIN6细胞铁死亡。
铁死亡是铁依赖的,以脂质过氧化为特征的程序性死亡,其形态学变化主要是线粒体嵴消失,线粒体膜密度增加,且已被证实与多种疾病有关[16]。血清铁蛋白升高是T2DM的危险因素,能够作为T2DM的早期诊断指标之一[17-18]。Yasumura等[19]研究发现,在糖尿病肾病模型中肾Ferritin蛋白表达水平升高;然而,Varghese等[20]研究发现高脂饮食喂养的雄性鼠中肝脏Ferritin蛋白表达水平降低。本研究发现GP会导致MIN6细胞Ferritin蛋白表达水平升高。TfR1和DMT1是铁的关键性调节因子,TfR1是一种跨膜的糖蛋白,是铁进入细胞必需的蛋白,并能够调节细胞内铁的浓度,TfR1的上调是细胞铁死亡的显著特征[21]。研究表明,DMT1上调会导致T2DM小鼠胰腺组织β细胞ROS水平升高和铁的沉积[22]。研究发现,GP能够诱导铁代谢指标TfR1、DMT1、Ferritin蛋白表达水平升高,因此,以上结果表明GP诱导MIN6细胞发生铁沉积。
GSH是细胞中主要的非酶抗氧化剂,GSH是由谷氨酸、半胱氨酸以及甘氨酸缩合而成,具有直接的抗氧化作用,也是GPX4的合成底物[23],MDA作为脂质过氧化的终产物。胱氨酸/谷氨酸转运体系统(cystine/glutamate transporter system,XCT)的表达也可用于鉴定铁死亡的生物标志物[24]。XCT是由溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)和溶质载体家族3成员2(solute carrier family 3 member 2,SLC3A2)组成的异二聚体,其功能是将胱氨酸导入进细胞内进行GSH的合成和发挥抗氧化作用[25]。Wang Guoyan等[26]研究发现T-2毒素通过增加ROS的水平以及下调SLC7A11蛋白表达诱导细胞发生铁死亡。ACSL4被证明是监测铁死亡的一个有用的生物标志物,通过产生5-羟基二十基四烯酸介导的脂肪毒性来促进铁死亡发展[27]。下调抗氧化酶GSH、GPX4、SLC7A11表达,上调ACSL4蛋白表达水平表达,这表明GP会导致MIN6细胞铁沉积,降低细胞的抗氧化能力。
GSPE属于多酚化合物,含有低聚物和单体黄酮聚合物,除了具有强的抗氧化能力,还具有抗病毒、抗菌、抗炎的作用,既往的研究表明GSPE能够通过发挥其强的抗氧化能力减轻GP饮食诱导的大鼠肝脏脂肪沉积,改善大鼠的血糖和脂代谢紊乱[28]。天然产物角鲨烯通过下调细胞中TfR1、ACSL4蛋白表达,上调SLC7A11和GPX4蛋白表达,增加细胞GSH含量,降低ROS荧光强度和MDA水平,拮抗Erastin诱导细胞铁死亡[29]。Li Dan等[30]研究发现,天然多酚类化合物槲皮素通过抑制胰腺铁沉积和胰岛β细胞铁死亡改善T2DM的病理发展过程。在本研究发现,质量浓度10~30 mg/L GSPE对MIN6细胞活性没有影响,GSPE可以提高GP诱导的MIN6细胞的活性,能够逆转GP干预下MIN6细胞的铁死亡特征,其中包括降低MDA含量、ROS水平,下调TfR1、DMT1和Ferritin、ACSL4蛋白表达水平表达,上调GSH、GPX4、SLC7A11蛋白表达水平表达。以上结果证实,GSPE能够抑制GP诱导的MIN6细胞铁死亡。
Nrf2是细胞关键的维持氧化稳定的调节因子,有证据表明Nrf2和铁死亡有关,且铁超载相关基因和脂质过氧化基因是Nrf2的靶基因[31]。在氧化应激或其他刺激下,能够促进Nrf2积累和核易位当进入细胞核后,Nrf2与一种小的Maf蛋白结合启动抗氧化酶基因调控区的抗氧化/亲电反应元件(antioxidant/electrophile response elements,ARE)激活下游的II相解毒酶基因[32]。研究发现,Nrf2可通过调节SLC7A11、HO-1蛋白表达抑制酒精性肝病铁死亡[33]。经动物实验发现,Nrf2基因特异性敲除地小鼠中肝脏和脾脏含铁含量增加以及ROS水平升高,进而加剧小鼠的氧化应激反应[34],Liu Zixuan等[35]研究发现,Nrf2基因特异性敲除会降低SLC7A11表达,抑制GPX活性进而加强Erastin诱导的PC12细胞铁死亡的敏感性。本研究发现,MIN6细胞在受到GP刺激下,Nrf2表达水平升高,GSPE能够通过激活Nrf2信号通路发挥其抗氧化能力,从而抑制GP诱导的细胞铁死亡,此外,在抑制Nrf2后,GSPE抗氧化能力降低,下游的抗氧化酶HO-1、NQO1、GPX4、SLC7A11蛋白表达水平表达降低,细胞铁死亡加速。
本研究结果表明,GSPE可能是通过激活MIN6细胞内的Nrf2信号通路,上调抗氧化酶表达,进而减轻GP诱导的细胞铁死亡,提高细胞存活率。
