鱼腥草对葡聚糖硫酸钠诱导小鼠溃疡性结肠炎的缓解及保护作用
2023-02-12邓代霞李凤兰李潮云吴天祥
邓代霞,李凤兰,李潮云,付 平,吴天祥,2,*
(1.贵州大学酿酒与食品工程学院,贵州 贵阳 550025;2.贵州食品工程职业学院,贵州 贵阳 551400)
溃疡性结肠炎(ulcerative colitis,UC)是一种以肠黏膜损伤、溃疡、炎症为主要特征的炎症性肠病(inflammatory bowel disease,IBD)[1],主要发病于直肠和结肠,在临床上,常见的IBD还包括克罗恩病[2-3]。由于UC具有易发作、难治愈、病因病机尚不明确等特性,世界卫生组织将其列为难治病症之一[4]。目前普遍认为UC的发病机制与遗传、环境、免疫异常、肠道菌群紊乱等相关,由诸多因素相互作用引起[5-7]。其临床症状表现为体质量减轻、腹痛、腹泻、粪便带血或严重血便,严重者可诱发结直肠癌[8]。据统计,我国UC的发病率逐年上升[9-10]。目前,常用的治疗IBD的药物种类主要以氨基水杨酸、免疫抑制剂、糖皮质激素等为主[3,11]。但长期服用副作用大、可引起诸多不良反应。一些传统中草药具有较好的抗炎效果,且中草药具有高效、副作用小等特点,因此,从天然资源中开发新型药物得到广大研究者的关注[12]。
鱼腥草(Houttuynia cordata)又名折耳根、蕺菜,含有丰富的营养物质,其味辛、性微寒,主要产于贵州、四川、云南等西南地区,作为贵州常见的药食同源食物之一[13-14],鱼腥草主要含有多糖、脂肪酸、挥发油、多酚、生物碱、黄酮、萜类等生物活性物质[15],具有清热解毒、利尿通淋[16]、抗炎抗菌[17]、抗病毒[18]、抗肿瘤[19]等作用。
目前,鱼腥草抗炎药理疗效已取得一定的研究成果,相关研究表明,鱼腥草素可增加动脉粥样硬化模型大鼠体内白细胞介素(interleukin,IL)-10水平,降低肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6及IL-1β水平,从而发挥抗炎疗效[20]。鱼腥草的水提物可以降低乙酰氨基酚诱导的小鼠肝损伤体内IL-6、TNF-α等炎症因子的水平[21],吴苹等[22]研究发现鱼腥草多糖能降低结肠炎小鼠血清中促炎因子、血清肌酐、谷丙转氨酶等的含量,调节肠道菌群紊乱及减轻肠道损伤,董晶等[23]证实鱼腥草多酚可通过降低结肠炎小鼠血清TNF-α、IL-1β、IL-6等促炎因子水平缓解肠道炎症反应,根据现有报道,鱼腥草在治疗结肠炎方面的研究还比较少,故本实验采用质量分数3%葡聚糖硫酸钠(dextran sulfate sodium,DSS)溶液构建UC小鼠模型,评价鱼腥草鲜汁对小鼠UC的缓解效果,以丰富鱼腥草治疗结肠炎的基础研究,更好地验证鱼腥草对小鼠结肠炎的改善作用,为鱼腥草功能性产品的开发提供理论依据与技术支持。
1 材料与方法
1.1 动物、材料与试剂
C57BL/6J雄性小鼠,8 周龄,体质量(22±2)g,SPF级,购于斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2019-0010。所有小鼠饲养于贵州大学酿酒与食品工程学院实验动物中心,饲养条件:12 h/12 h明暗交替,温度20~24 ℃,相对湿度60%~80%,动物实验经贵州大学动物实验伦理委员会批准(编号:EAE-GZU-2021-P008)。
小鼠基础饲料、垫料购于重庆腾鑫生物技术有限公司;鱼腥草产于贵阳市花溪区,洗净后不添加水直接榨成鱼腥草汁。
DSS 美国MP Biomedical公司;美沙拉嗪肠溶片葵花药业集团佳木斯鹿灵制药有限公司;粪便隐血试剂盒 江苏艾迪生生物科技有限公司;质量分数4%多聚甲醛溶液 武汉赛维尔生物有限公司;TNF-α、干扰素γ(interferon-γ,IFN-γ)、IL-1β、IL-4、IL-6、IL-10、超氧化物歧化酶(superoxide dismutase,SOD)、髓过氧化物酶(myeloperoxidase,MPO)、丙二醛(malondialdehyde,MDA)、蛋白质定量试剂盒(bicinchonininc acid,BCA)、D-乳酸(D-lactic acid,D-La)、脂多糖(lipopolysaccharides,LPS)试剂盒泉州市睿信生物科技有限公司;其他用于本实验的化学试剂均为国产分析纯。
1.2 仪器与设备
CP114型电子天平 上海奥豪斯仪器有限公司;GL-200G-II型高速冷冻离心机 上海安亭科学仪器厂;SPECTRA MAX 190型酶标仪 昆明纳瑞科技有限公司;RM2016型病理切片机 德国徕卡仪器有限公司;Pannoramic DESKP-MIDIP250型扫描仪 匈牙利3Dhistech公司。
1.3 方法
1.3.1 动物分组及处理
所有小鼠适应性喂养一周后,随机分为6 组:空白组、模型组、阳性组及鱼腥草汁低、中、高剂量组,每组12 只。除空白组外,其余各组采用质量分数为3% DSS溶液建立UC小鼠模型,小鼠连续自由饮用7 d。于建模后第4天,按照0.1 mL/10 gmb的剂量开始灌胃不同试剂,其中空白组和模型组灌胃生理盐水,阳性组灌胃美沙拉嗪(剂量200 mg/kgmb),低剂量组灌胃鱼腥草汁(稀释4 倍),中剂量组灌胃鱼腥草汁(稀释2 倍),高剂量组灌胃鱼腥草原汁,连续灌胃10 d。
1.3.2 疾病活动指数评分
实验期间,每天早上9∶00称量小鼠体质量,并观察小鼠粪便性状及隐血情况,采用粪便隐血试剂盒测定粪便隐血分数,根据文献[24]中的方法,计算疾病活动指数(disease activity index,DAI)评分,具体评分标准见表1。DAI评分计算方法如公式(1)所示。


表1 DAI评分标准Table 1 Criteria for DAI evaluation
1.3.3 结肠长度的测定
解剖小鼠后,快速分离结肠,用镊子轻轻水平拉直,用直尺测量长度并记录。
1.3.4 免疫器官指数测定
解剖小鼠后,快速分离胸腺、脾脏,称量并记录其湿质量,按照公式(2)计算免疫器官指数。

1.3.5 血清LPS水平及D-La浓度测定
取小鼠血液静置30 min后,3000 r/min离心15 min,取血清于离心管中备用,按照试剂盒说明书测定血清LPS水平及D-La浓度。
1.3.6 结肠组织炎症因子的测定
用预冷的pH为7.2的0.1 mol/L磷酸缓冲盐溶液冲洗小鼠结肠组织并剪碎,在冰上研磨制成匀浆液,根据BCA试剂盒测定结肠组织蛋白质浓度后,再按照酶联免疫吸附试验试剂盒检测步骤测定小鼠结肠组织中炎症因子TNF-α、IFN-γ、IL-1β、IL-6、IL-4、IL-10质量浓度。
1.3.7 结肠组织氧化应激水平的测定
根据试剂盒操作说明书测定小鼠结肠组织中SOD、MPO活力和MDA含量。
1.3.8 组织病理学检查
解剖小鼠后,取距肛门处1~2 cm的结肠组织,置于质量分数为4%的中性甲醛溶液固定24 h后,经修剪、脱水浸蜡、包埋、切片(厚度4 μm)、苏木精-伊红染色法染色、封片后,在扫描仪下观察各组的肠黏膜病理变化,并用相机采集图像,参考文献[24-25]中的方法进行组织病理学评分,具体评分标准见表2。
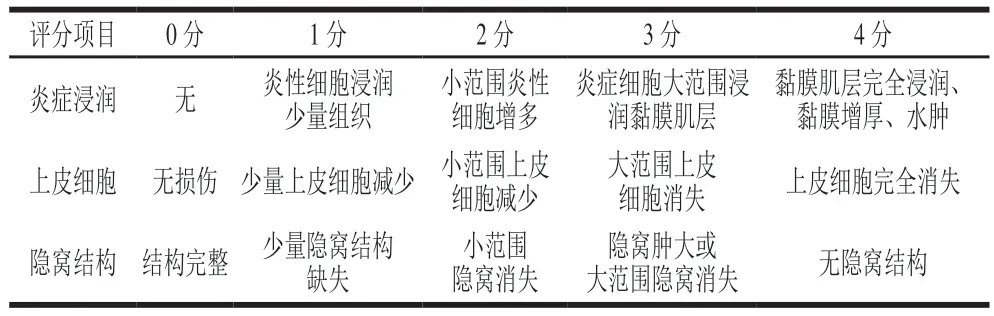
表2 结肠组织病理学评分标准Table 2 Criteria for histopathological evaluation of colon tissues
1.4 数据处理与分析
实验数据用平均值±标准差表示,使用Origin 2021软件作图,利用SPSS 26.0软件进行数据分析,使用单因素方差分析进行显著性分析,P<0.05表示数据具有显著性差异。
2 结果与分析
2.1 鱼腥草汁对UC小鼠体质量及DAI评分的影响
空白组小鼠在饲养期间反应灵敏、精神状况良好,粪便性状无异常;与空白组相比,模型组小鼠从饲养第5天开始出现精神萎靡、稀便、血便等症状;与模型组相比,鱼腥草汁低、中、高剂量组的小鼠精神状态有所好转且稀便和血便情况明显改善。
如图1所示,与空白组比较,模型组小鼠的体质量从第3天开始降低,持续降低至喂养结束,鱼腥草汁低、中、高剂量组与模型组比较,虽从第3天开始仍呈现降低趋势,但体质量均有所提高,DAI评分也有所降低;第14天,与模型组小鼠相比,鱼腥草汁低、中、高剂量组及阳性组小鼠体质量分别增加了26.70%、30.14%、35.54%、39.82%(P<0.01),DAI评分分别降低了26.54%、32.97%、53.99%、58.68%(P<0.01),呈剂量依赖性,其中高剂量组效果最好,效果接近阳性组。
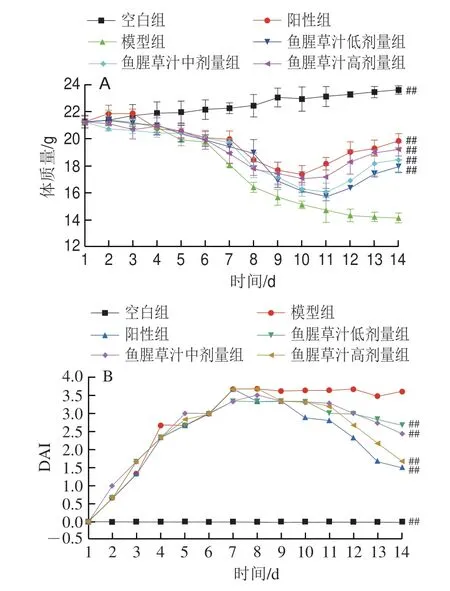
图1 小鼠体质量(A)和DAI评分(B)Fig.1 Body mass (A) and DAI score (B) of mice
DAI评分升高、体质量减轻、隐血、便血等是结肠炎重要特征[8],相关研究发现鱼腥草多糖可以降低结肠炎小鼠DAI评分,缓解腹泻及便血程度[22],本研究结果与此一致,与模型组比较,实验末期鱼腥草汁干预组均能减轻小鼠便血程度,中、高剂量干预组小鼠体质量极显著增加(P<0.01),DAI评分极显著降低(P<0.01),结果表明,鱼腥草可以改善UC小鼠生存状态及临床症状,具有较好的缓解作用。
2.2 鱼腥草汁对UC小鼠结肠外观及长度的影响
如图2所示,模型组小鼠结肠长度明显缩短、严重充血、黏连。各干预组小鼠结肠仍有部分充血、溃疡,但较模型组有所减轻,模型组小鼠结肠平均长度为4.60 cm,空白组平均长度为7.17 cm,模型组小鼠结肠平均长度较空白组缩减了2.57 cm,缩短了35.84%(P<0.01)。与模型组小鼠相比,鱼腥草汁低、中、高剂量组结肠长度极显著增加(P<0.01),因此,鱼腥草汁可以抑制UC小鼠结肠缩短。
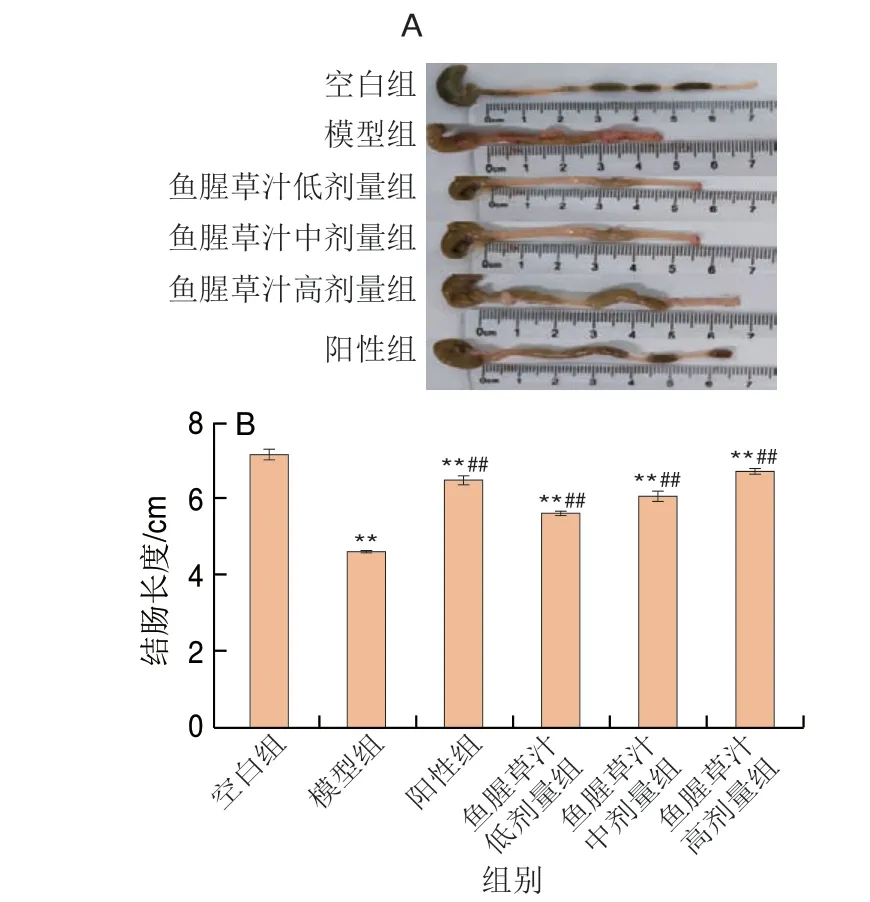
图2 各组小鼠结肠长度Fig.2 Colon length of mice in each group
2.3 鱼腥草汁对UC小鼠免疫器官指数的影响
胸腺和脾脏是机体中重要的免疫器官,在小鼠炎症和免疫反应具有至关重要的作用[26]。如图3所示,与空白组相比,模型组小鼠胸腺指数极显著降低(P<0.01)、脾指数极显著升高(P<0.01),经过鱼腥草汁干预后,低、中、高剂量组胸腺和脾脏指数逐渐向空白组趋近,其中,高剂量组胸腺指数较模型组升高了59.25%(P<0.01),脾指数较模型组降低了51.09%(P<0.01),综上,鱼腥草汁对结肠炎小鼠免疫器官指数具有调节作用。
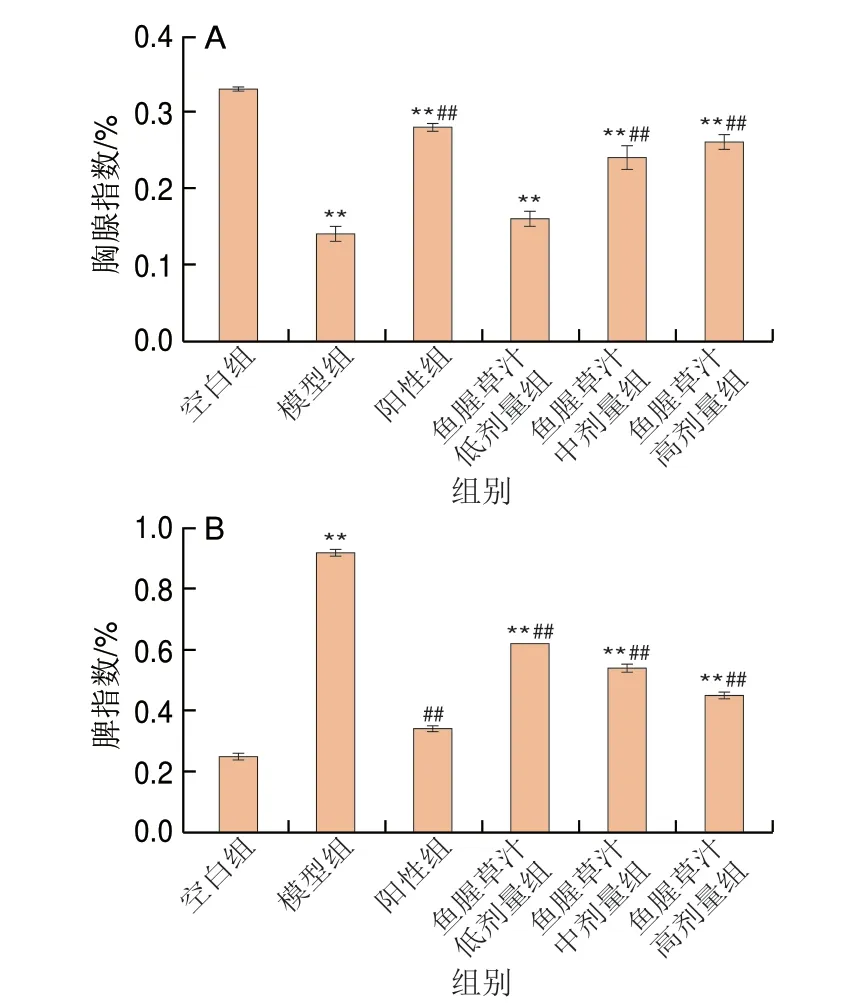
图3 鱼腥草汁对免疫器官指数的影响Fig.3 Effect of Houttuynia cordata juice on immune organ indexes
2.4 鱼腥草汁对UC小鼠肠道黏膜渗透性的影响
血清D-La浓度和LPS水平可间接反应肠炎小鼠肠道黏膜渗透性[27]。如图4所示,与空白组小鼠相比,模型组小鼠血清中D-La浓度和LPS水平极显著升高(P<0.01),表明肠黏膜屏障功能被破坏;与模型组相比,不同剂量的鱼腥草汁均可降低由DSS引起的小鼠血清D-La浓度、LPS水平升高,其中高剂量组血清D-La浓度、LPS水平较模型组分别降低25.92%、45.24%(P<0.01)。鱼腥草有多种功能性成分,其挥发油、萜类化合物、多糖等物质都具有较好的抗炎抗菌效果[15,17],本研究结果显示,鱼腥草汁能够降低DSS诱导的UC小鼠肠黏膜的通透性,可能是鱼腥草中各种成分相互协同作用,抵御有害病菌及毒物入侵结肠组织,从而减轻UC小鼠肠道黏膜损伤。
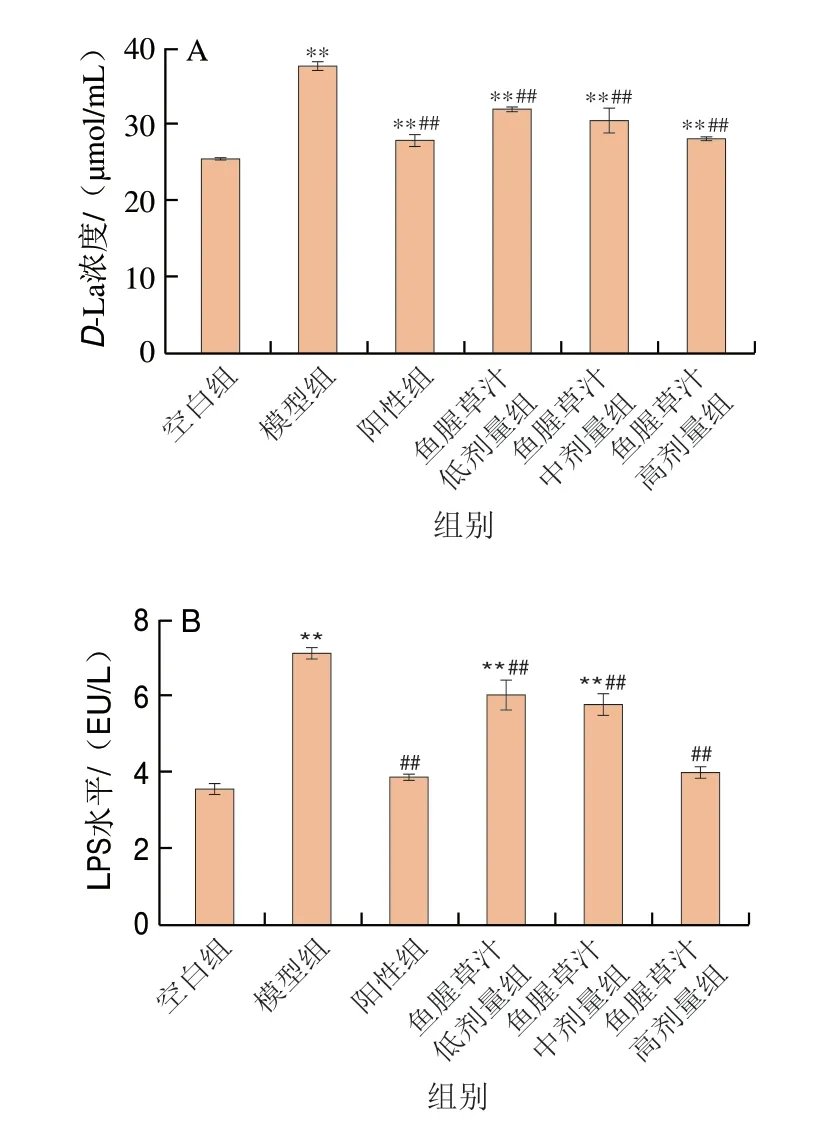
图4 鱼腥草汁对血清D-La浓度(A)和LPS水平(B)的影响Fig.4 Effect of Houttuynia cordata juice on serum D-La (A) and LPS levels (B)
2.5 鱼腥草汁对UC小鼠结肠组织中炎症因子的影响
TNF-α、IFN-γ、IL-1β、IL-6、IL-4、IL-10等炎症因子分泌异常是导致肠道黏膜的炎性损伤的主要原因之一[28]。如图5所示,与空白组相比较,模型组小鼠的结肠组织中促炎因子IFN-γ、TNF-α、IL-1β、IL-6分泌水平极显著增加(P<0.01),抗炎因子IL-4和IL-10分泌水平极显著降低(P<0.01),模型组小鼠结肠组织中TNF-α、IFN-γ、IL-1β、IL-6含量较空白组分别增加了129.53%、126.25%、69.06%、85.49%;而IL-4和IL-10水平较空白组降低了58.27%、41.23%。与模型组小鼠相比,鱼腥草汁中、高剂量组促炎因子分泌水平极显著降低(P<0.01),抗炎因子分泌水平极显著升高(P<0.01),其中,高剂量组TNF-α、IFN-γ、IL-1β、IL-6水平分别降低了33.21%、44.73%、32.88%、33.03%(P<0.01);IL-4、IL-10水平分别升高了76.10%、36.00%(P<0.01);前人研究表明DSS诱导的UC小鼠模型中TNF-α、IFN-γ、IL-1β等炎症因子在血清、结肠组织中表达水平升高[25,29],Lee等[30]研究发现,鱼腥草提取物可以通过抑制促炎因子的表达减轻肥大细胞介导的炎症反应;秦萍等[31]研究表明,鱼腥草挥发油治疗膝关节骨性关节炎大鼠后,能抑制血清中TNF-α、IL-1β及IL-6的表达;董晶等[23]研究发现鱼腥草多酚抑制了TNF-α、IL-1β、IL-6等细胞因子的分泌,本研究与前人研究结果一致。结果表明鱼腥草能够抑制促炎因子的释放,促进抗炎因子的释放,减轻结肠炎的炎性反应,保护结肠组织。

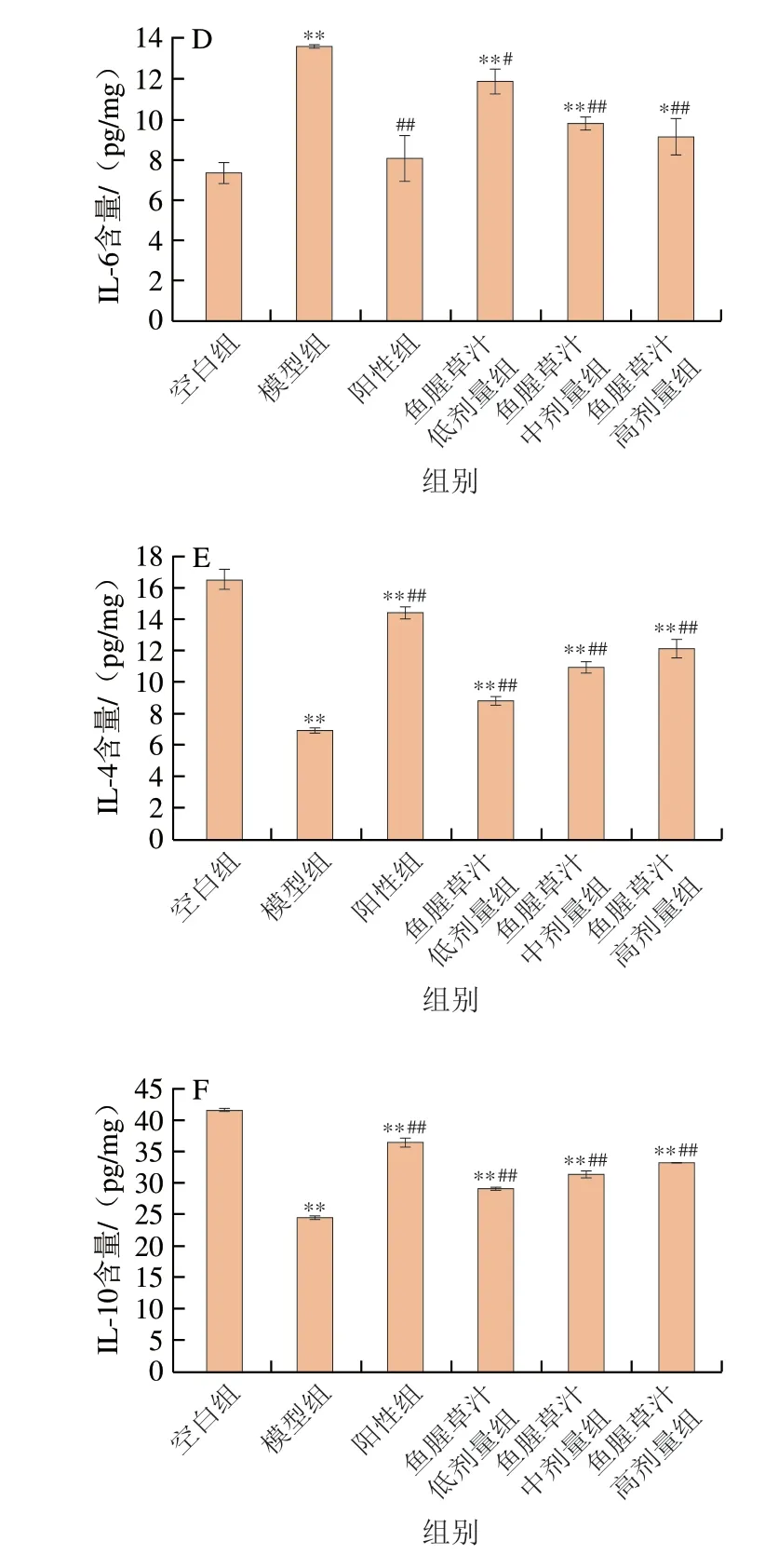
图5 鱼腥草汁对炎症因子分泌水平的影响Fig.5 Effect of Houttuynia cordata juice on inflammatory cytokine levels
2.6 鱼腥草汁对UC小鼠氧化应激水平的影响
氧化应激和氧化细胞损伤是结肠炎的重要标志之一[32],为评价鱼腥草汁对小鼠结肠组织氧化应激水平的影响,本实验测定了小鼠结肠组织中MDA含量和MPO、SOD活力。如图6所示,与空白组相比,模型组小鼠结肠组织中的MDA含量、MPO活力极显著升高(P<0.01),SOD活力极显著降低(P<0.01);与模型组相比,鱼腥草汁中、高剂量组小鼠结肠组织中MDA含量较模型组分别降低45.27%、56.16%(P<0.01),MPO活力分别降低了16.84%、34.05%(P<0.01),SOD活力分别增加了48.82%、76.37%(P<0.01)。有相关文献报道,鱼腥草多糖、黄酮具有较强的清除1,1-二苯基-2-三硝基苯肼自由基和羟自由基能力[33-34],马新方等[35]证明鱼腥草多糖可降低衰老小鼠体内MDA含量,提高SOD活力,具有较强的体内抗氧化活性。本研究表明,鱼腥草中能调节UC小鼠体内氧化应激水平,与前人研究结果[35]一致,应该是鱼腥草中多种功能性成分共同发挥作用减轻UC小鼠结肠组织炎症反应。

图6 鱼腥草汁对小鼠氧化应激水平的影响Fig.6 Effect of Houttuynia cordata juice on oxidative stress levels of mice
2.7 鱼腥草汁对UC小鼠结肠组织病理学及病理学评分的影响
如图7、8所示,空白组小鼠结肠黏膜结构完整,隐窝结构完整、腺体排列有序、杯状细胞清晰可见、无炎性细胞浸润;模型组小鼠结肠黏膜结构被严重破坏、严重充血、糜烂、隐窝及杯状细胞减少,大量炎性细胞浸润。前人研究表明,DSS对小鼠结肠组织结构破坏性较大,引起结肠充血、病菌浸染健康组织,导致大量上皮细胞凋亡[29,32],本研究模型组结肠病理分析与此结果一致。与空白组相比,模型组病理学评分极显著升高(P<0.01)。经过鱼腥草汁治疗,低剂量组对结肠组织隐窝结构有所修复,炎性细胞较模型组有所减少;中剂量组结肠组织结构较完整,但仍可见部分黏膜结构被破坏、隐窝结构部分丢失,仍有炎症细胞浸润;高剂量组小鼠结肠组织损伤较轻、炎性细胞明显减少、杯状细胞数量增多、隐窝结构较完整,病理学评分较模型组极显著降低(P<0.01),表明鱼腥草能保护结肠炎小鼠结肠黏膜不被破坏,对其结肠损伤有缓解作用。

图7 各组小鼠结肠组织病理切片Fig.7 Pathological sections of colon tissues of mice in each group

图8 各组小鼠结肠组织病理学评分Fig.8 Pathological score of colon tissue in each group
3 结论
IBD是一种病因不明、难治愈、易复发的慢性肠道炎症性疾病,以体质量减轻、便血、肠道炎症及肠黏膜损伤为主要特征[36-37]。研究表明鱼腥草具有较好的抗炎作用[38],本研究发现,鱼腥草可以降低DSS诱导的UC小鼠便血频率、DAI评分,抑制结肠缩短,降低促炎因子分泌水平,增加抗炎因子分泌水平,降低血清中D-La浓度和LPS水平,鱼腥草汁高剂量组较模型组分别降低了25.92%、45.24%(P<0.01),还可以通过调节UC小鼠体内的氧化应激水平及缓解肠道损伤;与模型组相比,鱼腥草汁中、高剂量组小鼠结肠组织中MDA含量较模型组分别降低45.27%、56.16%(P<0.01),MPO活力分别降低了16.84%、34.05%(P<0.01),SOD活力分别增加了48.82%、76.37%(P<0.01)。综上,鱼腥草可通过调节小鼠体内的氧化应激水平,降低肠炎小鼠肠道通透性及缓解肠道损伤,对小鼠UC起到缓解及保护作用,本研究可为鱼腥草预防UC等相关保健品的开发提供理论参考。但鱼腥草治疗UC小鼠的适宜剂量以及发挥抗炎作用的机制还有待进一步研究。
