乙酰基转移酶抑制剂对食管癌细胞KAT5、Survivin乙酰化水平及细胞增殖和迁移的影响*
2023-02-11梁宗英郑竞雄赵宝山侯继申孙光蕊
梁宗英,杨 阳,郑竞雄,赵宝山,侯继申,孙光蕊△
(1.承德医学院附属医院胸外科,河北承德 067000;2.河北省胸科医院临床实验室,石家庄 050000)
我国食管癌发病率和病死率均占世界范围内的50%以上,极大地危害了居民健康[1]。虽然手术切除、化疗及放疗等在一定程度上改善了食管癌患者的预后,但其总体生存率和生活质量仍较差[2]。赖氨酸乙酰化是表观遗传学中蛋白质转录翻译后主要修饰方式之一,乙酰化修饰和其他修饰之间的交叉调节对转录控制和表观遗传程序至关重要。除组蛋白外,许多核蛋白和肿瘤相关蛋白也可以发生赖氨酸乙酰化修饰,并在肿瘤的发生和发展过程中起到关键性作用[3]。研究表明,赖氨酸乙酰化修饰需要乙酰基转移酶参与完成,KAT5作为一种经典乙酰基转移酶通过调控组蛋白和非组蛋白的乙酰化修饰参与多种肿瘤的发生和转移[4],但其在食管癌中相关蛋白乙酰化修饰中的作用尚无研究报道。Survivin是细胞内凋亡抑制家族中抗凋亡能力最强的蛋白之一,在多种肿瘤中呈高表达,参与了肿瘤的增殖、凋亡、侵袭及转移[5]。前期研究显示,Survivin在食管癌组织及转移淋巴结中呈高表达并发生了乙酰化,且其高乙酰化水平与食管癌分期、组织分化及淋巴结转移相关[6]。然而,Survivin乙酰化促进食管癌发生及发展的具体机制尚不清楚。本研究观察乙酰基转移酶抑制剂NU9056对食管癌细胞乙酰基转移酶KAT5、Survivin乙酰化水平及细胞增殖、侵袭及迁移的影响,探讨KAT5与Survivin乙酰化修饰可能存在的内在联系及在食管癌发生和发展中的作用机制。
1 材料与方法
1.1 材料
人食管癌EC109细胞(中国科学院上海生命科学研究院细胞库);F12培养基、胎牛血清、胰蛋白酶消化液、Matrigel基质胶(广州锐博生物科技有限公司);SDS-PAGE蛋白凝胶电泳试剂盒、BCA蛋白定量试剂盒、细胞裂解液、MTT(北京碧云天生物科技有限公司);KAT5、Survivin、乙酰基赖氨酸AcetylatedLysine、细胞周期蛋白D1(Cyclin D1)、癌基因-Myc(c-Myc)、B淋巴细胞瘤-2(BCL2)和血管内皮生长因子(VEGF)单克隆抗体(英国 Abcam公司或美国CST公司);A/G琼脂糖珠(上海一基实业有限公司);DMSO和NU9056(上海斯百全化学有限公司)。
1.2 方法
1.2.1细胞培养和分组
取冻存的人食管癌EC109细胞,37 ℃水浴速溶,微量移液枪转入离心管内并加5 mL含10% F12培养基轻轻吸打混匀,常温离心;弃上清液,加7~10 mL F12培养基吸打混匀后转入培养瓶;37 ℃、5% CO2孵箱培养,24 h后换液并观察细胞生长情况,待细胞铺满培养瓶底部约95%进行相关实验。NU9056处理食管癌EC109细胞为实验组(NU9056组),DMSO处理食管癌EC109细胞为对照组(DMSO组)。用胰蛋白酶消化对数生长期EC109细胞,以每孔5×103个细胞/100 μL的密度接种于96孔板,待细胞贴壁后加药处理,NU9056按照浓度梯度0、0.1、0.5、1.0、5.0 μmol/L处理,每组3个平行孔。细胞处理24 h后进行MTT检测。每孔加入20 μL MTT(5 mg/mL),培养箱孵育4 h后终止培养,弃上清液,加入100 μL DMSO 10 min后,酶标仪检测570 nm处吸光度(A)值计算细胞增殖抑制率。计算药物对细胞生长的半数抑制浓度(IC50),后续实验均以NU9056 IC50值为细胞给药浓度。
1.2.2RT-qPCR
RNA提取试剂盒提取总RNA,取300 ng RNA,应用PrimeScriptTMRT Reagent kit,按说明书进行反转录为cDNA。应用SYBR Green qPCR Master荧光定量试剂盒检测mRNA表达。PCR反应条件:94 ℃预变性4 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s(30个循环)。溶解曲线参照仪器自动程序。使用U6和GAPDH作为内参,相对表达量以2-ΔΔCt计算。
1.2.3Western blot
提取细胞总蛋白,测定浓度;制备电泳蛋白上样液,行凝胶电泳。电泳后,转膜。加一抗4 ℃过夜。次日孵育二抗,重复洗膜后显影。采用Image proplus软件分析蛋白条带的积分光密度(IOD值)。
1.2.4免疫共沉淀实验
提取细胞总蛋白,测定浓度。加入目的蛋白纯抗体5 μL和A/G琼脂糖珠5 mL,混匀后2×裂解缓冲液补充至总体积450 μL,12 000 r/min离心3 min后,取上清液400 μL置入离心管,4 ℃ 15 r/min,共沉淀12 h。4 ℃ 12 000 r/min离心5 min,弃上清液。1×裂解缓冲液500 μL洗涤A/G琼脂糖珠。12 000 r/min离心3 min,弃上清液。重复洗涤3次。最后一次洗涤完毕后,弃去上清液。1×裂解缓冲液35 μL和等体积的2×SDS上样缓冲液混合,煮沸后离心;行Western blot。
1.2.5MTT
取处于对数生长期的细胞,消化后离心收集细胞沉淀。以F12培养基重悬,制成单细胞悬液。细胞计数后,以每孔8×103个细胞接种于96孔板,每孔加入100 μL。常规培养至每孔细胞密度达到80%进行转染。12、24、48、72 h后,每个时间点拿出一块板,每孔加入5 mg/mL MTT液30 μL,继续常规孵育4 h。离心,弃上清液。每孔加入DMSO 150 μL,水平摇床80 r/min 5~10 min。酶标仪检测每孔的570 nm处A值,绘制细胞生长曲线。
1.2.6划痕修复实验
收集细胞,10%胎牛血清的F12培养基配成单细胞悬液;以每孔8×103个细胞接种到96孔板,每孔100 μL。常规培养,待细胞铺满孔底,用10 μL无菌移液枪头垂直板面划痕,用无血清的培养基将掉下来的细胞洗去。每孔加入2 mL无血清的培养基继续培养48 h,倒置显微镜测量划痕的宽度。
1.2.7Transwell小室实验
取转染后铺满孔底细胞,用0.25%不含EDTA的胰蛋白酶消化为单细胞悬液,收集后计数细胞。将Transwell小室按顺序放入24孔板,无菌镊子取出小室,室外加入含15%血清F12培养基600 μL。小室内加入200 μL细胞悬液(细胞数2×104个),培养液为不含血清的F12培养基,每组细胞重复6个标本。24孔板放入CO2孵育箱内常规培养48 h。取出小室,PBS缓冲液淋洗3次,用棉签擦去微孔膜内层细胞。4%多聚甲醛固定30 min,0.1%结晶紫染色30 min。PBS缓冲液涮洗3次,每次更换液体;棉签擦干液体,显微镜下计数穿膜细胞数;每个小室随机计数10个视野。
1.3 统计学处理
2 结 果
2.1 NU9056对食管癌EC109细胞活力的影响
NU9056可浓度依赖性抑制食管癌EC109细胞增殖活力,差异有统计学意义(P<0.05);经计算IC50=0.946 μmol/ L,本研究选取0.9 μmol/L为 NU9056的终浓度,见图 1。
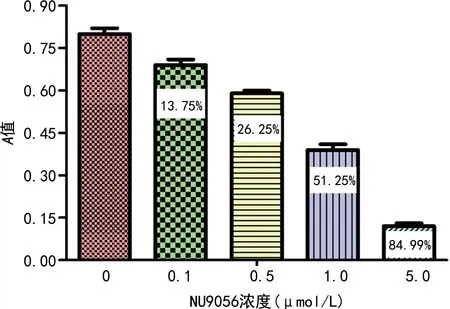
图1 不同浓度NU9056对食管癌EC109细胞抑制作用
2.2 NU9056对KAT5 mRNA和蛋白表达的影响
NU9056组KAT5 mRNA表达(0.12±0.02)明显低于DMSO 组(1.42±0.06),差异有统计学意义(P<0.05)。NU9056组KAT5蛋白表达(9.27±0.08)明显低于DMSO 组(75.67±1.34),差异有统计学意义(P<0.05),见图2。

图2 NU9056对食管癌EC109细胞KAT5 mRNA和蛋白表达的影响
2.3 NU9056对Survivin乙酰化水平的影响
NU9056组中Survivin乙酰化率为(24.74±1.36)%低于DMSO组(76.15±2.04)%,差异有统计学意义(P<0.05)。
2.4 NU9056对肿瘤增殖相关蛋白表达的影响
NU9056组中VEGF、BCL2、c-Myc和Cyclin D1蛋白表达水平分别为7.34±0.24、8.75±0.14、10.24±0.17和21.75±0.85,而DMSO组各蛋白的表达水平分别为67.84±1.12、60.72±1.34、70.38±2.04和72.34±1.71,差异有统计学意义(P<0.05),见图3。

图3 NU9056对食管癌增殖相关蛋白表达的影响
2.5 NU9056对食管癌EC109细胞增殖能力的影响
铺板培养48 h后NU9056组和DMSO组的A值分别为0.48±0.04和0.65±0.05,差异有统计学意义(P<0.05);铺板72 h后NU9056组和DMSO组的A值分别为0.56±0.03和0.78±0.05,差异有统计学意义(P<0.05),见图4。

图4 NU9056对食管癌EC109细胞存活能力的影响
2.6 NU9056对食管癌EC109细胞侵袭能力的影响
NU9056组穿膜细胞数(76.32±1.58)个低于DMSO组(127.32±2.46)个,差异有统计学意义(P<0.05),见图5。
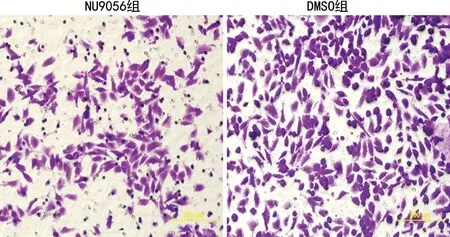
图5 NU9056对食管癌EC109细胞侵袭能力的影响(×400)
2.7 NU9056对食管癌EC109细胞迁移能力的影响
铺板培养48 h后NU9056组细胞划痕间距(356.42±2.56)μm低于DMSO组(64.54±1.38)μm,差异有统计学意义(P<0.05),见图6。

图6 NU9056对食管癌EC109细胞迁移能力的影响(×400)
3 讨 论
食管癌是临床上常见的上消化道恶性肿瘤。流行病学调查结果显示,近年来我国食管癌发病率虽有所下降,但总体病死率仍居高不下,严重威胁居民健康[7]。侵袭转移是导致癌症患者高病死率的主要原因,其中癌基因活化与抑癌基因失活是导致临床治疗失败的关键因素[8]。因此,有效抑制肿瘤细胞增殖、侵袭和转移对降低食管癌复发率并提升远期生存率至关重要。
乙酰化修饰是表观遗传学中较常见的一种组蛋白修饰方式,参与多种肿瘤的发生和发展。既往研究多关注于组蛋白的乙酰化修饰在肿瘤中的作用机制,而近年研究发现多种非组蛋白也可以发生乙酰化修饰,且与肿瘤的发生和发展密切相关[9]。Survivin基因是一种存在于多种恶性肿瘤及胚胎组织中的独特分子标记物[10]。大多数恶性肿瘤中Survivin呈过表达状态,可抑制肿瘤细胞的凋亡、促进肿瘤细胞增殖分化和肿瘤血管生成[11]。多项研究发现,Survivin可以抑制癌细胞的凋亡,导致肿瘤异常增殖,且与肿瘤的不良预后、侵袭转移行为、耐药和肿瘤复发密切相关[12-13]。课题组前期研究发现,食管癌组织中Survivin发生了乙酰化,且乙酰化水平与食管癌的分期、分化程度及淋巴结转移具有明显相关性[6]。然而,Survivin乙酰化与食管癌的发生和发展具体机制尚不清楚。本研究通过体外细胞实验进一步证实了食管癌EC109细胞内Survivin呈高乙酰化状态,说明Survivin作为一种非组蛋白同样可以发生乙酰化修饰,而且其乙酰化修饰可能参与了食管癌的增殖、侵袭和转移。
蛋白的乙酰化修饰需要在乙酰基转移酶的参与下完成,故乙酰基转移酶在乙酰化修饰过程中起到了至关重要的作用。食管组织中Survivin发生乙酰化同样需要乙酰基转移酶的参与,但催化其发生乙酰化的乙酰基转移酶尚未明确。乙酰转移酶KAT5属于MYST家族中的代表性成员,可以催化多种组蛋白和非组蛋白发生乙酰化,同时自身也参与并调控DNA 损伤应答、细胞周期、自噬、肿瘤发生及转移[14]。前期研究发现,食管癌组织中KAT5呈高表达,与肿瘤分期、分化和淋巴结转移相关,且其阳性表达与Survivin乙酰化呈正相关[15]。这提示KAT5可能通过自身功能或者靶向调控其他基因的途径,促进了食管癌发生和发展。KAT5可以通过催化多种组蛋白及非组蛋白发生乙酰化修饰参与癌症的发生和发展[14]。研究证实,抑制乙酰基转移酶的表达可以使肿瘤细胞内乙酰化蛋白的乙酰化状态发生改变[16]。理论上,通过抑制乙酰基转移酶的表达会改变食管癌组织中Survivin乙酰化修饰状态,进而改变食管癌的生物学行为。在沉默或下调乙酰基转移酶促进相关蛋白发生去乙酰化作用机制中,沉默KAT5有可能发挥更高的去乙酰化的作用。但在食管癌中,KAT5作为乙酰基转移酶是否参与Survivin乙酰化修饰的关系尚不明确。
本研究以食管癌EC109细胞为研究对象,通过应用乙酰基转移酶抑制剂NU9056对食管癌细胞进行处置,通过MTT实验检测证实,NU9056可浓度依赖性抑制食管癌EC109细胞增殖活力。乙酰基转移酶抑制剂在体内可以抑制多种乙酰基转移酶的活性,但其往往具有针对性的主要抑制一种乙酰基转移酶的活性和表达。本研究结果显示,NU9056可以明显抑制KAT5 mRNA和蛋白表达。说明乙酰基转移酶抑制剂NU9056可以有针对性地抑制KAT5的活性和表达,是乙酰基转移酶KAT5的特异性抑制剂。进一步通过免疫共沉淀实验检测Survivin乙酰化水平,结果显示KAT5表达下调后,食管癌细胞内Survivin乙酰化率明显降低,提示KAT5作为乙酰基转移酶催化了非组蛋白Survivin的乙酰化修饰,可能是调控Survivin发生乙酰化进而改变食管癌生物学功能的一个重要上游分子。
肿瘤的异常增殖、凋亡、侵袭和转移在恶性肿瘤的发生和发展过程中具有重要作用,抑制肿瘤增殖,诱导肿瘤细胞凋亡是治疗肿瘤的重要手段。本研究结果显示实验组细胞的增殖受到了明显的抑制,细胞的愈合迁移距离缩短,穿过滤膜的细胞数量明显减少。提示NU9056抑制乙酰基转移酶KAT5的表达使Survivin发生去乙酰化后,抑制了EC109细胞的增殖活力,延缓了细胞愈合迁移能力,且侵袭能力受到了明显抑制。肿瘤的异常增殖是肿瘤侵袭和转移的基础,肿瘤增殖过程中起到关键作用的基因分子主要包括肿瘤增殖相关蛋白Cyclin D1、c-Myc、BCL2和VEGF,也是预测肿瘤异常增殖的重要标志。研究表明,肿瘤细胞在异常增殖过程中Cyclin D1、c-Myc、BCL2和VEGF均呈表达上调状态。本研究通过Western blot检测4种蛋白表达证实,NU9056干预后的食管癌细胞中Cyclin D1、c-Myc、BCL2和VEGF蛋白表达均明显降低。笔者推测,NU9056干预食管癌EC109细胞后抑制了乙酰基转移酶KAT5的活性,使其催化的Survivin蛋白发生去乙酰化进而改变了Cyclin D1、c-Myc、BCL2和VEGF的表达。提示抑制KAT5表达可以降低Survivin乙酰化水平,抑制了细胞增殖通路,进而抑制了食管癌EC109细胞的增殖、侵袭和迁移。
综上所述,乙酰基转移酶抑制剂NU9056可通过下调乙酰基转移酶KAT5靶向调控Survivin乙酰化修饰,进一步通过调控肿瘤增殖过程中起到关键作用的基因,进而抑制食管癌EC109细胞的增殖、侵袭和迁移能力,为食管癌的临床治疗提供了新的思路和作用靶点。
