右美托咪定通过P2X7调控NLRP3/IL-1β通路减轻大鼠炎性痛
2023-02-11李屹张际政孙晓华车津立任万陆
李屹 张际政 孙晓华 车津立 任万陆
(天津医院麻醉科,天津 300211)
炎性疼痛是常见的临床症状,广泛存在于各种急慢性疾病中。一般情况下,急性炎症对于保护身体免受入侵的病原体及促进组织重塑和修复至关重要。持续6 w或更长时间的慢性炎症是严重影响患者生活质量的最常见不适之一,可导致组织损伤〔1〕。促炎介质(如前列腺素、细胞因子、趋化因子、蛋白酶、神经肽和生长因子)在炎症部位释放能够使周围的痛觉神经元敏感。目前,非甾体抗炎药和阿片类镇痛药仍是临床上常用的药物,但近50%的患者会感到疼痛缓解不足、胃肠道不适和其他严重的副作用(如便秘、抑郁)〔2,3〕。因此,开发高效、低毒的镇痛药一直受到医学界的关注。右美托咪定(Dex)是一种具有镇静、镇痛、辅助麻醉等作用的新一代高选择性α2肾上腺素能受体(α2 AR)激动剂;是美国食品药品监督管理局(FDA)批准的在重症监护病房(ICU)中对插管和机械通气患者进行镇静的常用药物〔4〕。研究发现其具有显著的抗炎镇痛作用,对2,4,6-三硝基苯磺酸(TNBS)诱导的大鼠慢性炎性内脏痛表现较强的镇痛作用〔5,6〕;研究发现Dex区域麻醉干预对术后镇痛非常有用,可以减少对阿片类药物的需求并提高术后患者的满意度〔7〕。
嘌呤能P2X7已被证明在伤害性炎症和神经性疼痛的动物模型中起核心作用,在患有慢性伤害性和神经性疼痛的患者外周血中可见P2X7明显上调和白细胞介素(IL)-1β释放增加〔8~10〕。动物研究也发现P2X7可通过激活VOD样受体热蛋白结构域相关蛋白(NLRP)3/IL-1β信号通路,参与大鼠炎性痛的形成〔11〕。Dex可抑制P2X4和NLRP3的表达,减弱糖尿病性神经性疼痛大鼠〔12〕;并可下调NLRP3的表达,降低IL-1β的释放,抑制小胶质细胞的炎症〔13〕。而Dex能否通过P2X7调控NLRP3/IL-1β减轻大鼠炎性痛还未可知,故本研究通过建立慢性炎性痛大鼠模型,探讨Dex在该模型中对P2X7及NLRP3/IL-1β通路的影响,为Dex能否作为安全、高效的镇痛药提供理论和实验依据。
1 材料与方法
1.1材料 SPF级雄性SD大鼠66只,体重(180±20)g,购自北京维通利华实验动物技术有限公司,许可证为SCXK(京)2019-0009。将所有大鼠放在可控制的光照下保持12 h明暗交替,温度(20±2)℃,相对湿度为45%~60%,可以自由获取食物和水。研究已由机构动物护理和使用委员会批准,并遵循《实验动物的护理和使用指南》。盐酸Dex注射液(江苏恒瑞医药股份有限公司,国药准字H20090248,2 ml:200 μg);2′(3′)-O-(4-苯甲酰苯甲酰)腺苷5′-三磷酸三乙铵盐(Bz-ATP,P2X7激动剂,≥93%,美国Sigma-Aldrich公司,CAS号:112898-15-4);完全弗氏佐剂(CFA,P2036)、RIPA裂解液(P0013B)和二喹啉甲酸(BCA)试剂盒(P0012S)均购自碧云天生物科技公司;大鼠IL-1β(RA20020)酶联免疫吸附试验(ELISA)检测试剂盒购自武汉贝茵莱生物科技有限公司;兔抗P2X7(ab109054)、NLRP3(ab263899)、半胱天冬氨酸蛋白酶(Caspase)-1(ab238972)、IL-1β(ab200478)、甘油醛-3-磷酸脱氢酶(GAPDH)(ab9485)、羊抗兔IgG H&L辣根过氧化物酶(HRP)(ab205718)、小鼠抗神经元特异核蛋白(NeuN,ab104224)、Alexa Fluor 647标记的山羊抗兔IgG H&L(ab150079)、异硫氰酸荧光素(FITC)标记的山羊抗小鼠IgG H&L(ab6785)均购自英国abcam公司;BME-403 Von Frey、BME-410C全自动热痛刺激仪均购自中国医学科学院生物医学工程研究所;iMark680多功能酶标仪、蛋白转膜装置(美国Bio-Rad公司);荧光显微镜(日本Olympus公司)。
1.2模型制备 大鼠适应性喂养3 d后开始实验。将60只大鼠随机分为对照组、模型组、Dex低、高剂量组(10、20 μg/kg)〔12〕、Bz-ATP组(Dex 20 μg/kg+P2X7激动剂Bz-ATP 15 μg/kg)〔11〕,每组12只。1%的戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,左后爪足底内注射20 μl的CFA诱发炎症性疼痛模型〔14〕。大鼠于建模前1 d、建模后即刻及建模后1、2、3 d进行腹腔注射给药,对照组和模型组注射生理盐水,Dex低、高剂量组分别注射相应剂量的Dex,Bz-ATP组在给予Dex的同时注射P2X7激动剂Bz-ATP(溶于无菌的0.9%生理盐水中,并稀释至所需浓度),1次/d,注射体积为1 ml。
1.3行为学测试
1.3.1机械痛敏 在大鼠注射前1 d及给药结束后30 min进行机械痛敏测定。实验前将大鼠连续3 d放置在测试笼中30 min以适应测试环境,每次测试前,将大鼠放进测试笼中适应15 min,然后用电子Von Frey刺激针刺激大鼠左侧足底,从1.0 g开始,逐渐增加纤毛折力,记录出现抬足或舔足反射的最小刺激强度为机械缩足反射阈值(MWT),每只大鼠测量5次,每次间隔5 min,计算其平均值。
1.3.2热痛敏 分别用移动的热辐射光源照射各组大鼠左侧足底,大鼠快速抬足或舔足即停止照射,记录热辐射持续时间即缩足反射潜伏期(PWTL),每只大鼠测量5次,每次间隔5 min,计算其平均值。为避免灼伤大鼠足底,刺激时间设置为15 s,若15 s内大鼠对热刺激无反应则记为15 s。
1.3.3ELISA检测脑脊液IL-1β水平 行为学检测结束后,使用戊巴比妥(80 mg/kg)深度麻醉大鼠,固定于脑立体定位仪上,剪开枕骨嵴附近皮肤,使用微量进样器穿过肌肉进入延髓池,缓慢抽取100 μl脑脊液,-80℃冰箱保存。按照ELISA试剂盒说明书的操作检测脑脊液中IL-1β水平。
1.3.4免疫荧光检测背根神经节(DRG)中P2X7、NLRP3与NeuN的共表达 取脑脊液完成后处死大鼠,经心灌注150 ml生理盐水和400 ml 4%多聚甲醛的0.1 mol/L磷酸盐缓冲盐水(PBS)。分离L4~L6 DRG,每组随机选取6只大鼠的样本,在4%多聚甲醛中固定3 h,然后转移至15%和30%的蔗糖进行脱水。OCT包埋后在冷冻低温恒温器上将DRG切成14 μm的切片。将切片用TBST(0.1%Tween-20)冲洗,并在37℃下用5%正常山羊血清封闭1 h。然后将切片与兔抗P2X7(1∶100)、NLRP3(1∶100)和小鼠抗NeuN(1∶200)于4℃孵育过夜。清洗后,与Alexa Fluor 647标记的山羊抗兔和FITC标记的山羊抗小鼠二抗IgG抗体(1∶200)进行第二次孵育2 h。4′6-二脒基-2-苯基吲哚(DAPI)孵育30 min,漂洗后使用荧光显微镜拍摄图像。每张切片选择四个区域,分别计算P2X7(红色)与NeuN(绿色)、NLRP3(红色)与NeuN(绿色)共表达的平均荧光强度(黄色)。
1.3.5Western印迹检测DRG中P2X7、NLRP3、Caspase-1、IL-1β蛋白表达 每组剩余6只大鼠DRG加入RIPA裂解液研磨后,置于冰上,静置后离心,提取上清液为总蛋白溶液。用BCA法测量组织裂解液中的蛋白浓度,变性后取等量蛋白质样品(30 μg/孔)上样,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,湿转法转膜,5%脱脂奶粉封闭,加入相应的一抗(P2X7、NLRP3、Caspase、IL-1β 1∶1 000,GAPDH按1∶2 000比例稀释)于4℃下孵育过夜,洗去一抗,加入HRP标记的羊抗兔IgG二抗(1∶5 000)室温孵育1 h,洗去二坑,电化学发光(ECL)显影,测量每个条带的蛋白表达,以GAPDH为内参,分析目的条带的相对表达水平。
1.4统计学方法 采用SPSS22.0和Image-Pro Plus6.0软件进行t检验、单因素方差分析及SNK-q检验。
2 结 果
2.1Dex对慢性炎性痛大鼠痛阈的影响 与建模前相比,建模后大鼠MWT、PWTL均显著下降(P<0.05);给药结束后,与对照组相比,模型组MWT、PWTL显著下降(P<0.05);与模型组相比,Dex低、高剂量组MWT、PWTL明显升高(P<0.05);与Dex高剂量组相比,Bz-ATP组MWT、PWTL明显降低(P<0.05);见表1。
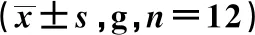
表1 各组痛阈、脑脊液中IL-1β水平及DRG中P2X7、NLRP3与NeuN共表达的比较
2.2Dex对慢性炎性痛大鼠脑脊液中IL-1β的影响 与对照组相比,模型组脑脊液中IL-1β水平显著升高(P<0.05);与模型组相比,Dex低、高剂量组IL-1β水平明显降低(P<0.05);与Dex高剂量组相比,Bz-ATP组IL-1β水平明显升高(P<0.05);见表1。
2.3Dex对慢性炎性痛大鼠DRG中P2X7、NLRP3与NeuN共表达的影响 与对照组相比,模型组DRG中P2X7与NeuN、NLRP3与NeuN共表达均显著升高(P<0.05);与模型组相比,Dex低、高剂量组P2X7与NeuN、NLRP3与NeuN共表达明显降低(P<0.05);与Dex高剂量组相比,Bz-ATP组P2X7与NeuN、NLRP3与NeuN共表达明显升高(P<0.05);见图1、表1。
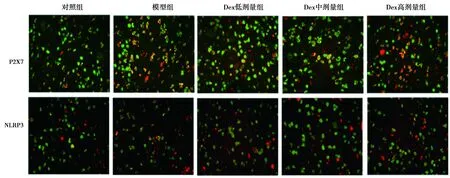
图1 各组DRG中P2X7、NLRP3与NeuN共表达水平(免疫荧光染色,×400)
2.4Dex对慢性炎性痛大鼠DRG中P2X7、NLRP3、Caspase-1、IL-1β蛋白表达的影响 与对照组相比,模型组DRG中P2X7、NLRP3、Caspase-1、IL-1β均显著升高(P<0.05);与模型组相比,Dex低、高剂量组P2X7、NLRP3、Caspase-1、IL-1β表达明显降低(P<0.05);与Dex高剂量组相比,Bz-ATP组P2X7、NLRP3、Caspase-1、IL-1β表达明显升高(P<0.05);见表2、图2。

表2 各组DRG中P2X7、NLRP3、Caspase-1、IL-1β表达的比较

1~5:对照组,模型组,Dex低剂量组,Dex高剂量组,Bz-ATP组
3 讨 论
慢性炎症疼痛是全球性的健康问题,尽管其发病机制和调节因子方面取得了重大进展,但是当前的疼痛疗法不能充分缓解慢性疼痛,寻找安全、高效的镇痛药仍然是研究的重点。促炎性细胞因子信号传导是病理性疼痛发展不可或缺的部分,这些通信的调制可能是改善疼痛的关键〔15〕。Dex是新一代高选择性α2 AR激动剂,具有镇静和镇痛,抑制交感神经,降低麻醉剂量,增加血液动力学稳定性及提高术后识别能力等多种优势〔16〕。它的安全性和有效性及可为患者提供一定程度的舒适感的能力,使其成为临床广泛应用的麻醉佐剂〔17〕。近年来,随着Dex临床研究的不断深入,发现该药物在各种神经痛〔18〕、术后疼痛和炎症控制〔19〕中表现出显著的镇痛抗炎作用,可降低患者血清肿瘤坏死因子(TNF)-α、IL-1β和C反应蛋白(CRP)水平,而且没有严重的副作用。因此,Dex是一种有前途的新型高效且安全的镇痛药。
三磷酸腺苷(ATP)是在所有组织和细胞中普遍存在的分子,在生理和病理条件下均会释放到细胞外环境中。ATP是感觉神经节中释放的主要递质,可激活嘌呤受体,嘌呤受体在外周(PNS)和中枢神经系统(CNS)中具有广泛组织分布,参与炎症和慢性疼痛的发病〔20〕。DRG中的嘌呤受体在促进细胞间通讯中起重要作用,特别是在疼痛信号传递方面。P2X7是ATP配体门控离子通道P2X受体家族的主要成员,在P2X家族中,P2X7具有ATP诱导激活的最高阈值,只有在细胞外ATP达到病理浓度时才会触发下游机制。在DRG中神经元可以通过ATP释放和P2X7激活进行通讯,参与调节炎症性和慢性疼痛〔21〕。IL-1β是第一种被描述为与炎性疼痛和痛觉过敏有关的促炎细胞因子。IL-1β可增强脊髓板层Ⅱ神经元的兴奋性突触传递并抑制抑制性突触传递,增强疼痛信号向大脑的传递;研究发现降低DRG中的P2X7的表达,抑制IL-1β的释放,可减弱大鼠脊髓炎症引起的痛觉过敏〔22〕。而IL-1β成熟和分泌的关键过程是ATP诱导的P2X7的激活,在我们的研究中获得了相似的结果,将CFA注射于大鼠左后爪的足底以诱发炎症性痛觉过敏,然后发展为持续的慢性炎性痛,其特征为强烈的局部发红,水肿和发热〔23〕。NeuN是神经元特异性标志物,本研究也证实P2X7广泛分布在神经元中。本文结果提示P2X7在Dex介导的镇痛作用中起重要作用。
研究还发现在CFA诱导大鼠炎性痛模型的DRG神经元中NLRP3表达也显著增加。而细胞外ATP刺激P2X7释放IL-1β的过程依赖NLRP3炎性小体的激活〔24〕。NLRP3与炎症反应密切相关,正常情况下,神经系统中NLRP3的表达很低,在感染、炎症、创伤等病理状态下,释放到胞外的ATP可通过激活靶细胞中P2X7,进一步激活NLRP3炎性小体〔25〕,随后活化半胱天冬氨酸蛋白酶前体(Pro-Caspase)-1分解为Caspase-1,促进促炎细胞因子IL-1β、IL-18的成熟和释放,进而影响感觉神经元功能〔26〕。本研究提示Dex可能通过下调P2X7,进一步抑制NLRP3/IL-1β通路。
综上,Dex可能通过下调P2X7,抑制NLRP3/IL-1β通路,减轻大鼠慢性炎性痛。慢性炎性痛有许多类型,本研究仅采用CFA诱导建立了一种炎性痛大鼠模型,在其他疼痛模型中Dex是否发挥相同的对P2X7的调控作用,有待研究。
