牙颌发育模式及分子机制
2023-02-10沈宗杉吴晓珊王松灵
张 然,沈宗杉,吴晓珊,王松灵
生物体的发育一直是生物医学领域高精尖前沿研究阵地,从一个受精卵细胞发育成各种细胞、组织、器官及生物个体,这种神奇复杂的生物学过程都是发育生物学研究范畴。在口腔医学领域,对牙和颌骨发育的研究可以全面认知口腔颌面基本结构及功能的形成过程,在此基础上可以进一步研究疾病的发生发展机制,进而为口腔疾病诊疗和再生医学打下基础。以往牙颌发育的理论体系大多基于模式动物——小鼠,但鼠牙发育与人类存在一定的差异,所以对与人类牙颌发育较近的小型猪进行牙颌发育研究具有重要意义。另外,学者们正在创造条件研究人类牙颌发育模式与分子调控系统,这将极大推进牙颌发育理论体系。
1 牙发育
牙发育分为三个主要阶段:牙胚发生期、牙冠形成期和牙根形成期。小鼠牙发育始于胚胎期第11.5天(E11.5),人牙发育始于胚胎第8周。口腔上皮在未来成牙的位置局部增厚形成牙板,随着进一步发育,牙板局部上皮增生,形成马蹄状的上皮细胞团,形似花蕾,是最早的成釉器,也是牙发育的起始阶段,叫蕾状期(bud stage)[1]。随后,蕾状期上皮不断生长、增大,约在人胚胎期第10周时,上皮细胞的形态开始发生变化。由于成釉器上皮外层的细胞生长速度较快,靠近釉结区的细胞生长较慢,使上皮细胞形成中央区凹陷,形状似帽子,称帽状期(cap stage)。约在人胚胎期第12周时,成釉器结构分化形成外釉上皮、内釉上皮和星网状层。随着成釉器的进一步增大,牙胚进入钟状期(bell stage),钟状期牙胚成釉器的发育接近成熟,从内向外可分为4层:内釉上皮层、中间层、星网状层、外釉上皮层。内釉上皮由单层的柱状细胞组成,外釉上皮由立方状细胞组成,两者在牙颈部相连,形成颈环结构。颈环进一步向未来根尖孔的方向生长,形成上皮隔,上皮隔的发育决定了牙根的数目[2]。
上皮隔形成后,其位置相对较为固定,此时牙冠已经形成并逐渐向冠方移动,颈环处细胞增生并逐渐延伸,形成赫特维希上皮根鞘(Hertwig′s epithelial rest,HERS)。伴随着HERS的形成,牙胚根方的间充质细胞被划分成两部分:HERS内侧的牙乳头细胞和包绕着HERS的外侧牙囊细胞。牙乳头细胞和内釉上皮的基底膜接触,在其诱导下分化形成未来的根部成牙本质细胞。成牙本质细胞分泌基质并矿化形成根部牙本质。随着根部牙本质的形成,HERS发生断裂,形成Malassez上皮剩余。外部的牙囊细胞通过断裂的HERS和新生成的根部牙本质相接触,分化形成成牙骨质细胞并分泌形成根部牙骨质[3-4]。与此同时,牙囊细胞分泌胶原纤维埋入新生成的牙骨质中,将牙根固定在牙槽窝内。牙根形成1/2或3/4时,牙尖开始萌出进入口腔内。牙萌出后的一段时间里,牙根还要继续发育,待根尖部完全形成时,牙的发育才算完成[5]。
1.1 牙发育精细化调控
牙发育是一个精细化调控的过程,包含关键基因的序列、时空性表达,上皮和周围间充质细胞之间相互作用,以及以釉结为代表的特殊细胞群对牙形态的精准调控等多事件。这些关键时期的关键生物学事件,对牙发育的精细化调控至关重要(图1)。
按照基因在牙发育中的功能,笔者将牙发育中的功能分子简要分类为:形态发生相关分子、能量代谢相关分子及微环境稳态相关分子。
1.1.1 形态发生相关分子
和牙胚形态发生密切相关的分子主要为经典的五大信号家族,Wnt、转化生长因子-β(transforming growth factor-β, TGF-β)、骨形态发生蛋白(bone morphogenetic protein, BMP)、Sonic hedgehog (Shh) 以及成纤维细胞生长因子(fibroblast growth factor, FGF)信号通路。
Wnt信号通路有19个Wnt蛋白配体和10个受体,经典的Wnt/β-catenin信号通路传递过程可概述为:当Wnt配体缺失的时候,细胞质内的β-catenin蛋白持续被Axin蛋白复合体(Axin/APC/CK1/GSK3)降解。CK1和GSK3可依次磷酸化β-catenin。特定位点被磷酸化的β-catenin被E3泛素连接酶β-Trcp识别,经历泛素化后被蛋白酶体降解,从而使胞质中的β-catenin维持在较低的浓度。当Wnt蛋白出现的时候,Wnt蛋白和细胞表面的卷曲蛋白(frizzled, Fzd)以及LRP5/6蛋白形成的共受体结合。结合后通过抑制下游Axin蛋白复合物活性,从而抑制细胞内信号分子β-catenin的降解。随后β-catenin进入胞核,与LEF/TCF转录因子家族结合,共同调节下游靶基因的转录。Wnt/β-catenin信号通路参与调节多个生物学发育过程,包括细胞增殖、细胞迁移以及细胞分化等[6]。
在早期牙发育启动中,Wnt信号通路非常关键。临床中,约46%的人类无牙症患者携带WNT10A或AXIN2基因的突变,在小鼠模型中Lef1或组织特异性在上皮或间充质细胞中失活β-catenin基因,小鼠牙发育停滞在蕾状期[7-10]。在小鼠口腔上皮细胞中过表达β-catenin则导致多生牙的发生[11]。Wntless(Wls)是调节Wnt配体分泌的一个重要蛋白,Wls基因的缺陷可导致Wnt配体分泌障碍,通过构建在早期牙源性上皮特异性Wls基因敲除的小鼠模型,阻断早期牙源性上皮中Wnt配体的分泌,发现牙乳头细胞分化障碍[12-13]。相比牙冠发育,Wnt信号通路在牙根发育中的研究较少。先前的研究观察到Wnt/β-catenin信号通路靶基因Axin2可聚集表达在发育中的HERS细胞以及根部牙乳头细胞中,与Wnt10a的表达模式较为一致,提示Wnt信号通路在牙根发育中具有一定功能[14]。通过在成牙本质细胞中过表达β-catenin基因,成牙本质细胞提前分化成熟,牙根发育异常[15]。值得一提的是,成牙本质细胞特异性敲除β-catenin基因后,其分化完全受阻,细胞增殖能力和对照小鼠相比明显减弱,根部牙本质缺如。这说明β-catenin介导的信号通路在根部成牙本质细胞分化、增殖中具有决定性作用[16]。此外,一些体内外研究均证实,在牙根发育的过程中,Wnt信号通路还可调节成牙骨质细胞的增殖和分化[17]。
TGF-β/BMP信号通路对成牙本质细胞分化具有重要的作用。在发育中的成牙本质细胞中,可以检测到TGF-β1的表达。分析其表达模式推测TGF-β1可促进成牙本质细胞的终末分化[18]。牙源性间充质细胞中特异性敲除Smad4,导致经典Wnt信号通路抑制分子Dkk1、Sfrp1的表达下调,成牙本质细胞中Wnt信号通路活化从而使其分化命运发生改变,髓腔中出现类似于骨样结构的钙化团块;在根部成牙本质细胞中敲除Tgfbr2同样可以导致细胞分化命运的改变,成牙本质细胞不再具有成牙本质细胞的特征(表达Dspp),转而表达成骨分化标志分子Ibsp[19-20]。先天无牙的患者可携带BMP4的基因突变,Bmp4突变的小鼠,牙胚发育停滞在蕾状期。在分化中的成牙本质细胞中敲除Bmp4可引起冠部、根部成牙本质细胞的分化障碍,冠部和根部的牙本质厚度均有明显的降低,髓腔变大,类似牛牙[21-22]。在HERS特异性敲除Smad4基因的小鼠中,发现牙源性上皮中Smad4介导的TGF-β/BMP信号通路对间充质中Nfic的表达非常关键,而Nfic正是调节根部成牙本质细胞分化的关键因子[23]。TGF-β1在牙周组织的形成中也具有重要的调控作用[24]。
Shh信号通路与牙冠、牙根的发育密切相关。Shh表达在早期牙上皮发育启动的位置,Shh信号通路相关的分子,Patched1、Smo、Gli1、Gli2和Gli3表达在周围间充质细胞中[25]。牙根发育过程中,Shh和Patched2表达在HERS中,Patched1、Smo和Gli1表达在HERS、根部牙乳头细胞以及牙囊细胞中[26]。在间充质突变Patched1的小鼠中,HERS周围的细胞增殖减弱,磨牙萌出异常伴随着所有磨牙牙根和对照小鼠相比均缩短,提示Shh信号通路在牙根发育中具有重要功能[27]。此外,Shh可部分挽救HERS特异性敲除Smad4而导致的无牙根小鼠表型,表明Smad4介导的Shh信号通路在调控牙根发育中起到了重要作用[23]。
在牙冠发育过程中,Fgfs可表达在牙源性上皮以及间充质中,然而在出生后小鼠牙发育过程中,Fgfs表达模式发生改变。在蕾状期和钟状期时Fgf3和Fgf10表达在间充质中,出生后其表达量显著下调。在小鼠切牙中,表达在切牙间充质中的Fgf3和Fgf10用以维持干细胞在切牙唇侧颈环处的增殖活性[28]。而在磨牙发育中,Fgf10在牙根发育前表达消失。如果在牙冠向牙根发育转化期间,在根部持续过表达Fgf10,HERS因无法延伸而膨大,牙根发育异常[29]。FGF-2表达在根部正在分化中的成牙本质细胞,以及成牙骨质细胞中,并且可以促进再植牙牙周膜的形成和防止牙根吸收[30]。
1.1.2 能量代谢相关分子
能量代谢对机体发育十分重要,牙早期发育的过程中,多种能量代谢相关分子参与牙发育过程,其中作为代表的有三磷酸腺苷(adenosine triphosphate, ATP)、环磷酸腺苷(cyclic adenosine monophosphate,cAMP)、去乙酰化酶(sirtuins 3, SIRT3)等。成牙本质细胞可以通过释放ATP来响应外界的物理刺激,从而产生痛觉。通过加入磷脂酶C抑制剂,阻断ATP受体和Gq/11蛋白的耦合,在成牙本质细胞中可观察到钙动员被抑制。钙相关的ATP受体亚型在牙某个特定的细胞亚群中特异性高表达,提示细胞外ATP是成牙本质细胞功能的潜在信号媒介。SIRT4是位于线粒体的基因,通过催化一系列反应来调节线粒体中ATP的生成。在成牙本质细胞分化过程中,SIRT4随着细胞分化而表达增强,Sirt4敲除引起成牙本质细胞分化和矿化的下调[31]。
1.1.3 微环境稳态相关分子
牙发育除了受内在因素的调控,还需要外在因素(微环境)的共同调节,其中微环境对决定细胞分化命运方面起着关键作用。微环境由直接影响细胞或细胞周围条件的因素构成,这些因素通过与细胞的动态相互作用直接或间接地影响细胞生物学行为。和微环境相关的因素包括炎性微环境、低氧微环境、力学微环境以及细胞外基质等,这些微环境相关的因素稳态维持对正常牙发育至关重要。
炎性介质如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)的产生可使牙髓等组织处于炎性微环境中。利用牙本质基质蛋白1(dentinmatrixprotein1,Dmp1)-Cre工具小鼠在牙髓和牙槽骨中过表达TNF-α可引起继发性的牙髓炎和骨丧失[32]。低氧条件对早期胚胎发育是一个关键因素,这一过程受缺氧诱导转录因子-1(hypoxia-inducible transcription factor-1,HIF-1)的调控,在体外牙胚培养体系中加入HIF-2α抑制剂可显著抑制牙胚大小,同时可以促进成釉细胞的分化[33]。外界的机械应力可刺激力学感受器激活细胞内信号通路,能改变细胞形态、结构甚至调控细胞的功能。机械应力在牙发育中广泛存在,在牙发育初期,牙板期向蕾状期转化时,上侧的牙板细胞平面收缩,产生引导牙板上皮弯曲的侧向拉力,导致牙上皮内陷,这种侧向拉力可能和细胞运动相关的蛋白,例如肌动蛋白、肌球蛋白有着联系。通过对机械应力系统重要分子肌动蛋白纤维(F-actin)、非肌肉肌球蛋白ⅡB(non-muscle myosin ⅡB,NMⅡB)在牙发育早期的各个时期免疫荧光染色发现,机械应力参与牙早期发育过程[34]。此外,笔者课题组的研究发现,乳恒牙之间的内应力可抑制恒牙的启动发育,该内应力的释放可激活恒牙的发育[35]。因此,力学微环境调控很可能会成为牙形态调控的一个有效靶点。多细胞有机体中,细胞周围由多种大分子组成的复杂网络称为细胞外基质(extracellular matrix, ECM)。每种组织的ECM都有特定的特征,指导该组织的分化、迁移以及免疫反应等功能。DMP1是一种酸性氨基酸的非胶原蛋白,在骨和牙本质的ECM中均有表达。DMP1通过和牙本质涎磷蛋白(dentin sialophosphoprotein, DSPP)的启动子区结合调控成牙本质细胞的分化。DSPP是小分子整联蛋白结合配体N-连接糖蛋白家族成员,DSPP在成牙本质细胞中富集高表达,在骨中表达量极低。DSPP可启动羟基磷灰石晶体的成核过程,在基质矿化和信号转导中具有广泛且关键的作用[36]。
1.2 上皮与间充质相互作用
以牙为代表的外胚层来源的器官在早期发育均离不开上皮和间充质的相互作用,在牙发育的不同阶段,上皮和间充质的相互作用具有不同特点(图2)。
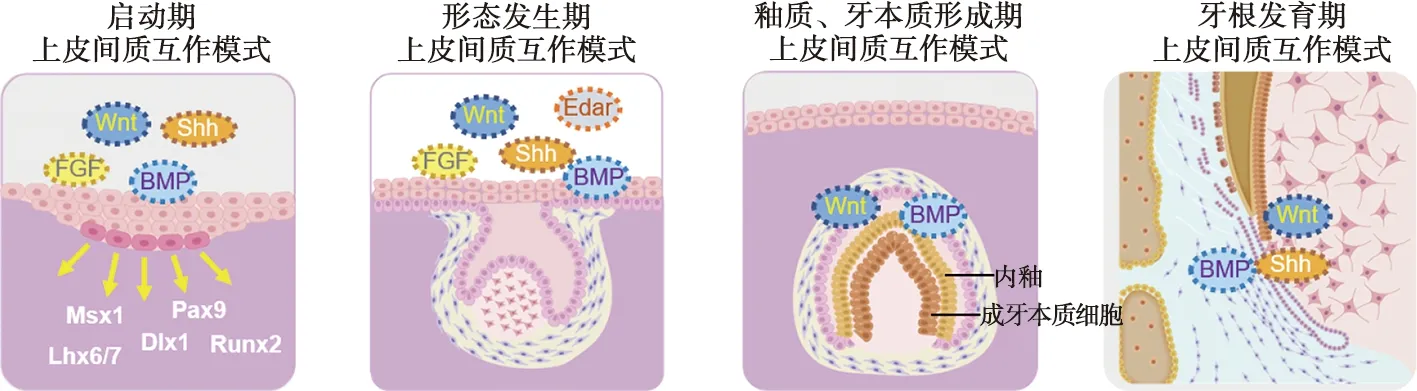
图2 牙发育期上皮和间充质相互作用模式图
1.2.1 牙发育早期上皮和间充质的相互作用
牙发育早期信号来自上皮,随后信号从上皮转移到间充质。在小鼠中,小鼠牙源性上皮成全牙能力在蕾状期由上皮转移到了间充质,表现为小鼠蕾状期之前的上皮可以诱导非牙源性间充质细胞成牙。而在人中,人牙源性上皮这种成牙能力从上皮到间充质的转换发生于帽状期到钟状期[37]。在E10小鼠中,未来形成前牙的口腔外胚层的部位表达Bmp4,在随后的蕾状期和帽状期,Bmp4表达从上皮细胞转移到上皮下方间充质,Bmp4表达异常引起牙发育停滞[22,38]。此外, 间充质细胞可响应来自牙上皮的信号,表现为Msx1、Pax9等基因表达上调。Msx1不仅调节Bmp4等牙发育重要基因,也可向牙上皮提供反馈信号[39]。
牙上皮释放Shh信号分子作用周围间充质,在牙发育早期同样起重要作用。Ptch1、Smo、Gli1、Gli2和Gli3等Shh信号相关分子在早期牙上皮尤其是釉结中高表达。牙上皮释放Shh 信号分子作用周围间充质,可促进间充质细胞增殖,调节牙形态发生。抑制Shh 信号分子,不仅导致牙上皮细胞的增殖活性受到抑制,不能发生内陷折叠,无法分化为具有成牙功能的成釉细胞,还会影响周围间充质细胞形成牙本质,导致牙发育异常[40]。
牙上皮分泌的 FGF信号分子诱导间充质Msx1、Pax9表达对于牙发育至关重要。牙上皮和间充质高表达FGF信号通路相应受体Fgfr1和Fgfr2,FGF信号通路异常导致牙上皮增殖异常,间充质细胞凋亡增加,影响牙形态及萌出[41]。牙上皮和间充质的 FGF信号受Wnt信号通路调节,抑制上皮中Wnt 信号会导致Eda表达减少,下游主要效应分子Fgf20下调导致牙数量、大小异常,牙尖扁平[42]。因此,FGF、Wnt信号在牙上皮细胞内陷、形态发生以及牙上皮、间充质增殖、分化中具有重要作用。
1.2.2 牙本质和牙釉质形成过程中上皮和间充质相互作用
牙本质和牙釉质形成于钟状期间充质和上皮交界,受上皮、间充质中BMP、FGF、Shh和 Wnt等信号调节。BMP信号通路具有诱导成釉细胞、成牙本质细胞分化的作用,在牙本质、釉质形成中起关键作用,相关分子异常导致牙本质和牙釉质形成障碍。例如,BMP信号通路关键分子Smad4缺失,小鼠成牙本质细胞分化缺陷,形成异位骨样结构而非牙的结构[43];Bmp2缺失,切牙牙釉质层变薄的、矿化程度降低[44]。Wnt信号同样参与成釉细胞、成牙本质细胞分化,与釉质、牙本质形成关系密切。上皮中Wnt信号缺失导致成牙本质细胞分化障碍,成牙本质细胞标志物Dspp下调,牙本质厚度减少,而上调β-catenin激活 Wnt 信号,会导致牙本质和牙骨质过度形成[45]。Wnt信号缺失也会引起牙源性上皮细胞增殖、存活受影响,成釉上皮形成受阻,牙大小、形态发生明显异常,而间充质的BMP等信号能反馈调节上皮细胞中的Wnt信号[46]。上皮和间充质间BMP、Wnt等信号通路的精密调节,在釉质、牙本质形成中至关重要。
1.2.3 牙根形成中上皮和间充质相互作用
牙根发育主要由牙上皮来源的HERS和神经嵴来源的牙髓干细胞介导形成。HERS作为信号中心,通过调控HERS基因表达,可影响牙根大小,形状和数量。BMP信号在牙上皮、间充质中高表达,参与HERS形成。BMP-Smad4-SHH-Gli1信号参与调节牙上皮干细胞的命运,牙上皮中BMP信号的缺失导致Shh信号激活,牙上皮干细胞持续存在,HERS的形成受阻,牙根不能形成[45]。HERS的上皮细胞分泌Shh在牙根形成中也至关重要,分泌Shh作用间充质细胞并介导其分化,最终形成牙根。核因子Ic(Nfic)敲除小鼠的牙冠正常,牙根形成缺陷,HERS缺失Shh会抑制周围间充质Nfic表达。因此,Shh是HERS-间充质相互作用的重要信号分子,调节牙根形成。
1.3 釉结对牙尖和牙冠形态的调控
牙板从蕾状期到帽状期发育过程中,原发釉结信号发挥重要作用。原发釉结位于牙上皮的基底层,通过产生Wnt、Shh、BMP、TGF-β和FGF等信号,调节周围牙上皮增殖并影响牙形态发生。原发釉结细胞表达Bmp2、Bmp4和细胞周期抑制蛋白P21(Cdkn1a),影响釉结细胞增殖、凋亡,调控釉结信号中心[47]。单尖牙、多尖牙对应釉结数目、大小也有所不同,单尖牙仅形成原发釉结,不形成继发釉结,而多尖牙则形成多个继发釉结。关于原发釉结和继发釉结的形成尚不清楚,原发釉结的大小和位置会影响继发釉结的形成。
1.4 牙萌出替换
与啮齿类动物不同,人类存在两副牙列,即乳牙和恒牙,乳恒牙的替换是精细调控的过程。非哺乳类脊椎动物一生中存在多个牙更换周期,在不同发育阶段牙板持续存在,人类只存在一套恒牙替换乳牙。恒牙牙板在乳牙处于牙胚的钟状期时,就已经独立存在于颌骨中,但恒牙启动发育以及替换的机制不清楚。目前初步发现,在乳牙萌出前,乳牙的快速发育可引发颌骨内应力,通过Integrin β1-RUNX2通路抑制恒牙牙板的启动发育;乳牙萌出可释放颌骨内应力,进而激活恒牙牙板的启动发育[48]。
牙板从帽状期到钟状期,形成内釉上皮、外釉质上皮等重要结构,并初步形成牙外形。内釉上皮位于牙上皮内侧,是未来成牙的重要结构,外釉上皮位于牙上皮的外侧,内釉、外釉上皮间的结构称为星状网层。牙上皮周围充满间充质,与内釉上皮相邻的间充质细胞称为牙乳头,而外釉上皮及牙乳头周围的间充质细胞称为牙囊。牙上皮延伸到下方的牙乳头形成颈环,每一侧颈环处有继发釉结。钟状期后期牙冠、牙根逐步形成,上皮来源的成釉细胞形成牙釉质,间充质来源的成牙本质细胞形成牙本质。颈环处牙源性上皮进一步伸长到下方的间充质,形成HERS。HERS通过与下方间充质相互作用或通过上皮间充质转换,未来形成牙根及牙周组织[45]。
牙冠形成后进入牙萌出期,牙穿过口腔黏膜向牙合面移动,并伴随牙根形成。牙根的生长速率与牙冠的移动速度相一致,但目前的研究表明,牙根发育缺失对牙萌出影响有限[16,49]。牙萌出过程涉及多个精密调控的生物学过程,例如:牙胚周围牙囊诱导破骨细胞活化,参与冠部牙槽骨的骨改建;牙冠表面的缩余釉上皮分泌多种酶,通过解离牙冠上方的软组织,解除牙萌出的阻力。总之,牙萌出涉及牙囊、破骨细胞等精密调控,任何环节异常,可引发牙萌出障碍。
2 颌骨发育
2.1 颌骨发育的过程
上、下颌骨来自第一鳃弓,由颅神经嵴细胞分化形成。在未来第一磨牙位置,神经嵴来源的间充质发生聚集,分化成软骨细胞并形成双侧棒状软骨,即梅克尔软骨(Meckel's cartilage),是下颌形成的模板[50]。下颌骨骨化在梅克尔软骨周围发生。上颌骨也由神经嵴来源的间充质聚集分化形成,骨化时间略迟于下颌骨[51]。目前关于第一鳃弓如何差异形成上、下颌骨还未完全阐明,有学者提出的“铰链和盖帽”模型可部分解释上下颌骨形成的差异[52]。此外,下颌骨发育模式较上颌骨复杂,前、中、后份成骨方式有所区别。一般认为下颌骨前份以软骨成骨的方式形成正中联合,后份髁突由次级软骨的软骨内成骨形成,而下颌骨的主体中间段以膜内成骨方式形成[51]。尽管目前认为下颌骨中间段以膜内成骨方式形成,梅克尔软骨在其中可能起到重要作用,因为在人类疾病和小鼠模型中,梅克尔软骨发育受阻,影响整个下颌骨的发育。目前关于梅克尔软骨与下颌骨发育的具体机制以及它的转归还未完全阐明(图3)。
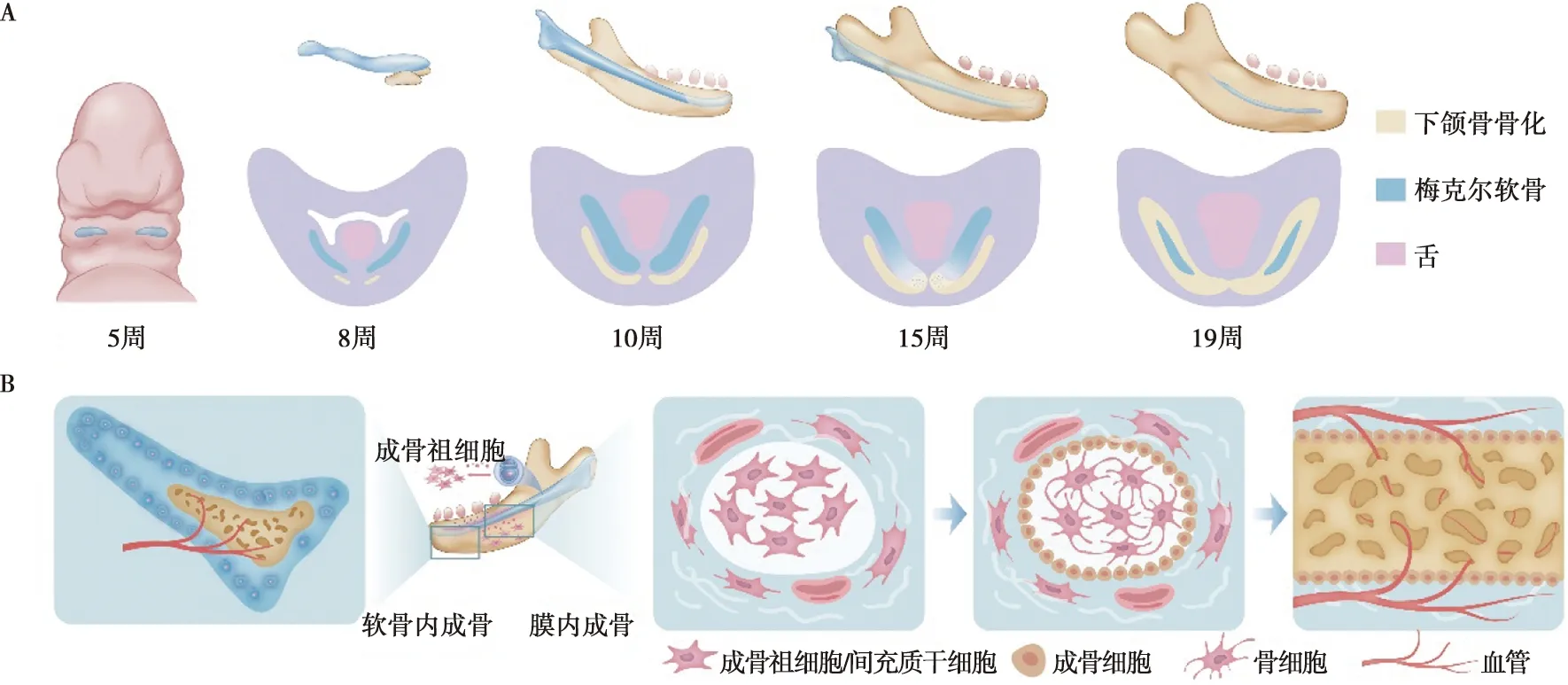
A:人梅克尔软骨及下颌骨骨化区域时间序列变化模式;B:下颌骨前份软骨内成骨、中份膜内成骨模式图
2.2 颌骨发育中的一些特殊结构和信号通路
2.2.1 梅克尔软骨
神经嵴衍生间充质在下颌骨形成位置发生聚集分化形成梅克尔软骨,作为下颌骨形成的始基。梅克尔软骨组织学上表现为典型的透明软骨,富含Ⅱ型胶原蛋白的细胞外基质包裹软骨细胞[53]。目前认为梅克尔软骨的正常增殖、延伸对于下颌骨发育必不可少。特定敲除颅神经嵴细胞Sox9基因,梅克尔软骨生长障碍,下颌骨发生严重缺陷,可见梅克尔软骨在下颌骨的发育中起重要作用[54]。此外,Shh信号对梅克尔软骨发育也至关重要,Shh缺失导致梅克尔软骨发育障碍,下颌骨细胞凋亡增加,导致严重的下颌短缩[55]。
梅克尔软骨转归不清楚,其降解转归机制是近年研究热点。目前认为梅克尔软骨降解与软骨细胞自噬、凋亡及生物应力相关。小鼠E15开始,在位于下颌前份梅克尔软骨中依次检测到自噬调节因子 Beclin1、LC3和凋亡相关分子Caspase 3,表明软骨细胞依次发生自噬和凋亡[56]。梅克尔软骨降解过程也受BMP信号调控,BMP信号过度激活可维持梅克尔软骨细胞高度增殖状态,梅克尔软骨中份不发生降解,经历软骨内骨化形成下颌骨[57]。表观遗传调控也是影响梅克尔软骨降解的因素,组蛋白H3赖氨酸残基的甲基化负向调控基因表达,缺乏Setdb1(负责合成组蛋白H3蛋白赖氨酸9残基甲基化酶)可引发BMP信号激活,小鼠梅克尔软骨降解延迟[58]。此外,周围环境生物应力在调控梅克尔软骨矿化和降解中也起一定作用[59]。
梅克尔软骨与机体其他部位软骨相比具有一些共性也存在异质性。Ihh、Sox9、Bmp7等基因在软骨分化中起重要作用,在梅克尔软骨与四肢软骨均高表达[50]。但也有多个信号分子在梅克尔软骨与四肢软骨中表达模式并不同。例如,四肢软骨在静止和增殖的软骨细胞中不表达热休克蛋白(heat shock protein, Hsp)25,仅在肥大软骨细胞中表达,但在梅克尔软骨增殖的成软骨细胞中也能检测到Hsp25[60]。此外,Rankl特定表达在四肢软骨肥大软骨细胞中,但在未成熟和成熟的梅克尔软骨细胞中也表达Rankl[61]。此外,与四肢软骨相比,梅克尔软骨的前体细胞来源不同,梅克尔软骨细胞主要来源于颅神经嵴,而肢体生长板软骨细胞来源于中胚层,表达不同的谱系标志。
梅克尔软骨发育缺陷在人类疾病和模式动物中均引起下颌发育异常。多种导致梅克尔软骨短缩或缺失的模式小鼠,下颌骨也出现不同程度的缩短。例如,在敲除颅神经嵴细胞Sox9的小鼠中,下颌骨严重缩短[54];Fuz基因缺失小鼠梅克尔软骨变小,下颌骨发育短缩[62]。软骨细胞内Fgfr3异常激活的小鼠,软骨细胞分化异常,肥大软骨细胞减少,导致梅克尔软骨和下颌骨异常[63]。与小鼠类似,梅克尔软骨缺陷会导致胎儿的下颌骨短小,从而导致无颌、小颌或下颌发育不全。短指发育不良综合征中,人类SOX9中发生致病突变,由于梅克尔软骨缺陷出现小颌畸形[64]。在Pierre-Robin综合征中,小颌畸形对上腭抬高产生连锁反应,从而导致腭裂[65]。在转铁蛋白受体敲除小鼠中,梅克尔软骨未能伸展,同样出现腭裂[50]。梅克尔软骨发育缺陷在人类疾病和模式动物中均可下颌发育异常,可见梅克尔软骨在下颌骨发育中发挥重要作用。
2.2.2 上下颌骨的成骨中的信号调控
上颌骨和下颌骨主要由颅神经嵴细胞通过膜内成骨的方式形成。上、下颌骨具有不同的形态,其早期发育模式的差异可能与接受不同的上皮信号有关。例如,内皮素1(endothelin1,ET1)参与介导上、下颌骨差异化形成。其主要表达在下颌突远端的外胚层,而内皮素受体 (endothelin receptor α, Ednra)仅在间充质中表达,ET1缺失导致下颌骨向上颌骨转变[66]。Six1主要表达在上颌和下颌突的口腔侧,负调节内皮素信号,维持上颌特征。Six1缺失小鼠,第一咽弓的近端内皮素信号上调,导致在颧弓处形成棒状软骨结构,发生类似下颌骨的转变[66]。可见,早期上、下颌骨受不同信号分子调控,发育模式存在差异。后期骨化过程上、下颌骨大致相同,即颅神经嵴细胞受Dlx5、Runx2等转录因子调控,逐步分化为成骨细胞。不同之处在于下颌骨的成骨受到梅克尔软骨等多个结构的调控更为复杂,下面主要介绍下颌骨的成骨方式。
下颌骨中份以膜内成骨的方式形成,其特征是间充质干细胞增殖并形成小而密的细胞簇,随后这些干细胞分化成成骨细胞,并伴随发生从梭形到柱状的转变。同时,成骨细胞产生类骨质的细胞外基质,富含Ⅰ型胶原纤维并能够结合钙盐。类骨质组织矿化形成原始骨组织,中间有成熟的骨细胞,成骨前缘有活跃的成骨细胞。膜内成骨受Dlx5、Runx2等基因调控。骨祖细胞中表达Dlx5,可通过诱导 Runx2表达促进成骨细胞生成。Runx2缺失小鼠成骨细胞分化受阻,不能形成骨组织。骨祖细胞分化后期,Alp和Osx表达上调,表明向成骨细胞分化。Osx也是膜内成骨的重要调控基因,Osx缺失导致几乎所有颅面骨缺陷[67]。
目前认为下颌骨前份通过软骨内成骨的方式形成正中联合。软骨内成骨中,间充质细胞凝聚并分化为软骨细胞,分泌胶原蛋白和聚集蛋白聚糖,软骨细胞历经增殖、成熟、肥大,最终由于微环境的剧烈变化发生细胞凋亡,留下软骨残余物作为成骨细胞铺设支架[68]。通过与报告小鼠杂交,Col10a1-Cre可示踪肥大软骨细胞,肥大软骨衍生细胞在骨组织发育中可形成表达Col1a1的成骨细胞,但在正中联合部位梅克尔软骨转归目前尚缺乏确凿证据。此外,敲除Ihh的小鼠下颌联合部位软骨祖细胞增殖受抑制,正中联合部位形成障碍[69],但该部位梅克尔软骨以何种方式影响成骨尚不清楚。
下颌骨冠状突、髁突和喙突主要由继发软骨的软骨内成骨形成。继发软骨成骨前沿部位,祖细胞同时表达Runx2、Osx 和 Sox9等成骨和成软骨标志物,因此被称为骨软骨祖细胞。骨软骨祖细胞的命运受TGF-β 等信号调控。例如,颅神经嵴细胞缺失Tgfbr2小鼠,骨软骨祖细胞成骨分化标志上调,即ColⅠ表达升高而Sox9表达下降,骨软骨祖细胞倾向于成骨而不是软骨,下颌骨近端区域的软骨生成异常,导致下颌骨短缩[70]。颞下颌关节形成和髁突生长需要Ihh信号传导。Ihh缺失的小鼠髁突软骨细胞增殖均受到抑制,颞下颌关节和髁突发育严重障碍[71]。综上,TGF-β、Ihh 等信号参与调控下颌后份软骨内成骨。
值得注意的是,下颌骨的成骨方式仍然存在很大争议。目前认为下颌骨主体通过膜内成骨形成,但膜内成骨的界面与梅克尔软骨紧密相连,梅克尔软骨是否参与调控膜内成骨过程以及哪一群细胞与梅克尔软骨关系紧密尚不清楚。尽管目前认为下颌骨前份可能通过软骨内成骨的方式形成正中联合,但这一结论主要通过组织学观察得出,缺乏特定转基因小鼠的证明。此外,下颌骨远端区软骨快速降解形成空隙,与软骨内成骨的骨、软骨交界面的组织学表现差异较大,两者间是否有区别尚不清楚。研究下颌骨成骨模式,有助于开发下颌骨乃至其他骨缺损的仿生治疗策略,具有重要社会意义。
3 牙和颌骨发育中的相互作用关系
牙和颌骨有一个共同的起源:它们都起源于第一鳃弓,牙、颌骨的发育过程是一个有机整体,发育过程协同,关系紧密,影响早期下颌骨发育的突变也会影响牙的形成。例如,Msx1基因缺失小鼠下颌、牙发育异常,牙发育终止于蕾状期。Pax9缺陷小鼠,牙槽骨缺失,牙发育停留在蕾状期。牙胚通过释放活性因子,介导周围牙槽骨的改建。例如,牙胚可释放破骨诱导因子RANKL,激活破骨细胞活性,促进牙槽骨吸收,为牙在颌骨内的发育提供空间[72]。牙和颌骨之间的机械力也可对两者发育及结构改建产生影响。牙脱落后对牙槽骨作用力降低,牙槽嵴高度下降,可见牙-颌骨间的机械力在维持颌骨稳态中也起重要作用[73]。
4 未来展望
虽然人和小鼠之间的基因相似性高达90%,但不可否认的是,在牙发育中,小鼠模型对于研究牙形态调控以及乳恒牙列替换仍具有局限性。经典的上皮和间充质重组实验证实,小鼠和人牙成牙能力从上皮到间充质转移的时期不同,开发大型哺乳动物作为牙发育的研究模型具有必要性。小型猪和人牙具有相似的数目,有前牙、磨牙丰富的牙类型,并且和人类似,存在乳恒牙双副牙列,作为牙发育的研究模型,极具开发和应用价值。
牙和颌骨发育为有机的整体,应用先进的测序手段,如单细胞联合空间转录组测序技术、单细胞开放染色质测序技术,对早期牙(尤其是启动期)及颌骨细胞亚群的动态演变规律,细胞之间的相互作用关系,结合拟时序分析及谱系示踪等技术手段,解析各细胞亚群的发育和分化轨迹。并且探究在分化过程中,特异性标志物的变化规律,筛选牙细胞亚群和颌骨亚群互相的特异性靶分子,通过牙、颌骨类器官及遗传修饰小鼠等功能模型加以验证。在完整地获得和验证以上信息后,筛选获取人牙源性上皮的祖细胞,作为真正的牙再生种子细胞植入适当的颌骨微环境中,人工构建牙和颌骨的一体化再生模型。相信通过几代人的不懈努力,这一理想的牙再生模式不再是梦想。
致谢:感谢周含章女士绘制本文图片。
