稽留流产绒毛组织中IGF-1、E-cadherin、微血管密度表达与药物治疗结果的相关性研究
2023-02-10刘竞,张兰,曾利,马丽
刘 竞,张 兰,曾 利,马 丽
(巴中市中心医院产科,四川 巴中 636000)
稽留流产指胚胎死亡或发育停止后稽留于宫腔内未能及时自然排出者[1]。流行病学研究发现,稽留流产发病率从2013年的24.14%上升到2018年的30.50%[2]。稽留流产受遗传、免疫缺陷、内分泌异常、感染等多因素影响,但病因仍不清楚[3]。胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)是具有促进滋养细胞增殖或侵蚀作用的细胞因子,对胚胎植入、发育有调控作用[4];E-钙黏附蛋白(E-cadherin)是一种调节细胞与细胞、细胞与基质间黏附作用的跨膜糖蛋白,对维持正常子宫功能有重要意义[5];微血管密度(microvessel density,MVD)降低可造成胎盘微循环障碍,严重时引起胚胎死亡[6]。稽留流产可引起宫壁粘连,宫内组织机化,纤维组织水肿变性,孕囊不易完全排出,临床上多采用米非司酮片配伍米索前列醇片序贯治疗稽留流产,但仍存在完全流产率低、阴道出血多等不足[7]。本研究通过检测IGF-1、E-cadherin和MVD在进行米非司酮配伍米索前列醇治疗的稽留流产和正常早孕患者绒毛组织中的表达情况,分析研究其表达与药物治疗结局的相关性。
1资料与方法
1.1研究对象
收集2019年9月至2021年8月在巴中市中心医院妇产科收治的,进行米非司酮配伍米索前列醇治疗的稽留流产患者95例为研究组,正常早孕患者108例为对照组。纳入标准:①研究组均符合《妇产科学》中稽留流产诊断标准[8];②对照组血清人绒毛膜促性腺激素检测阳性,B型超声检查可见胚芽或(和)心管搏动以证实胚胎存活;妊娠囊大小与停经天数相符合;③年龄在20~40岁之间;④妊娠时间在6~10周之间;⑤自愿参与试验并签署同意书。排除标准:①对本研究治疗药物过敏或有其他禁忌证者;②生殖道结构畸形、月经周期不规律、生殖道感染等;③妊娠期有毒物、药物、射线接触史、家族遗传史等。
1.2药物治疗
所有患者均采用米非司酮配伍米索前列醇的统一药物方案进行治疗,即第一天口服米非司酮25mg/次(国药准字H10950003,规格:25mg),早晚各一次,第二天早上50mg,第三天晨空腹口服米索前列醇0.6mg(国药准字H20000668,规格:0.2mg);患者服用药物3h后,观察宫缩情况,如未出现宫缩则再给予0.4mg米索前列醇口服,或将0.2mg米索前列醇置于阴道后穹窿处,据患者阴道出血情况及胚胎排出情况判断是否进行清宫术。
1.3实验方法
1.3.1标本采集
收集两组患者药物治疗后自行排出的绒毛组织,用生理盐水反复冲洗干净后,进行固定、脱水、包埋,制成切片,进行免疫组化染色检测。
1.3.2免疫组织化学法检测绒毛组织中IGF-1、E-cadherin和MVD的表达
取上述石蜡切片进行脱蜡、水化,利用磷酸盐缓冲液(phosphate-buffered saline,PBS)洗3次,分别加入IGF-1、E-cadherin和CD34抗体(北京博奥森生物技术有限公司)过夜孵育,PBS洗3次后分别加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔抗体(北京博奥森生物技术有限公司)室温孵育1h,PBS洗2次后加3,3′-二氨基联苯胺(3,3′-diaminobenzidine,DAB)孵育10min;复染5min,水洗分化、蓝化,最后脱水封片后由2名高年资病理医师采用双盲法独立观察染色情况,判读免疫组织化学结果。
结果判定:①IGF-1、E-cadherin免疫组织化学结果判定[9]:随机选取高倍视野5个,联合染色的强度和阳性细胞百分比进行计分,其中染色强度不着色计0分、浅黄色计1分、棕黄色计2分及棕褐色计3分;其中阳性细胞所占视野内细胞的百分比<5%计0分、5%~<25%计1分、25%~50%计2分、>50%计3分;然后取两者得分乘积为最终分数,判定0分为阴性(-),1~2分为(+),3~4分为(++),5~6分为(+++),后3者均视为阳性表达;②MVD免疫组织化学结果判定:用CD34的表达量代表MVD。CD34分布于细胞质,以细胞质内出现棕黄色颗粒为阳性。微血管计数参考1992年Weidner等计数的标准:凡标记清晰,着色强,与背景明显有别的单个染色的血管内皮细胞、管腔直径小于8个红细胞的血管或血管内皮细胞簇,不论是否形成管腔或管腔内是否有红细胞,只要不和临近的微血管、细胞及其他结缔组织相连,就作为一个微血管。管壁有平滑肌的血管不予计数。先在低倍镜下寻找新生血管最密集区,然后在200倍视野下选取5个视野,计数微血管染色数目,其平均值即该病例的MVD。
1.4疗效评价标准
药物治疗后效果评价标准[10]:药物治疗效果分为完全流产、不完全流产和治疗失败。①完全流产:接受药物治疗24h内出现宫缩等症状,阴道出血量在正常范围内,妊娠物完全排出,经B超检查确认宫腔内无组织残留物;②不完全流产:接受药物24h内排出部分妊娠物,阴道出血量较大,B超检查发现宫腔内仍有部分残留物,需要进行清宫术;③治疗失败:患者接受药物治疗后发生腹痛,出现少量阴道出血但无妊娠物排出,经B超检查确认宫腔内存在妊娠物,需进行清宫术。
1.5统计学方法

2结果
2.1两组患者一般资料比较
研究组平均年龄(26.45±4.17)岁,孕周(8.29±1.45)周;对照组平均年龄(26.56±3.98)岁,孕周(8.35±1.58)周;两组患者的年龄、孕周、体质量指数(body mass index,BMI)、痛经比例间差异均无统计学意义,具有可比性(P>0.05),见表1。

表1 两组患者的一般资料比较
2.2两组患者绒毛组织中IGF-1、E-cadherin和MVD的表达情况
两组患者绒毛组织中均有IGF-1、E-cadherin、MVD的表达,见图1;研究组绒毛组织中IGF-1的阳性表达率(3.16%)低于对照组(11.11%),差异有统计学意义(χ2=4.67,P=0.03);研究组绒毛组织中E-cadherin的阳性表达率(75.79%)低于对照组(96.30%),差异有统计学意义(χ2=18.43,P<0.01);研究组绒毛组织中MVD的相对表达量(7.56±0.62)低于对照组(13.78±1.16),差异有统计学意义(t=46.71,P<0.01),见表2。

表2 两组患者绒毛组织中IGF-1、E-cadherin和MVD的表达情况
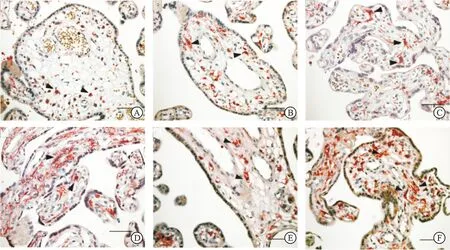
注:(A:研究组,B:对照组)为IGF-1的表达;(C:研究组,D:对照组)为E-cadherin的表达;(E:研究组,F:对照组)为MVD的表达;箭头为阳性表达区域;(标尺=100μm)。
2.3两组患者接受药物治疗后的不同结局发生情况
两组患者接受药物规范治疗后,发生完全流产共165例(81.28%),不完全流产38例(18.72%),无治疗失败病例发生;研究组患者不完全流产发生率(28.42%)高于对照组(10.19%),差异有统计学意义(χ2=11.05,P<0.01),见表3。
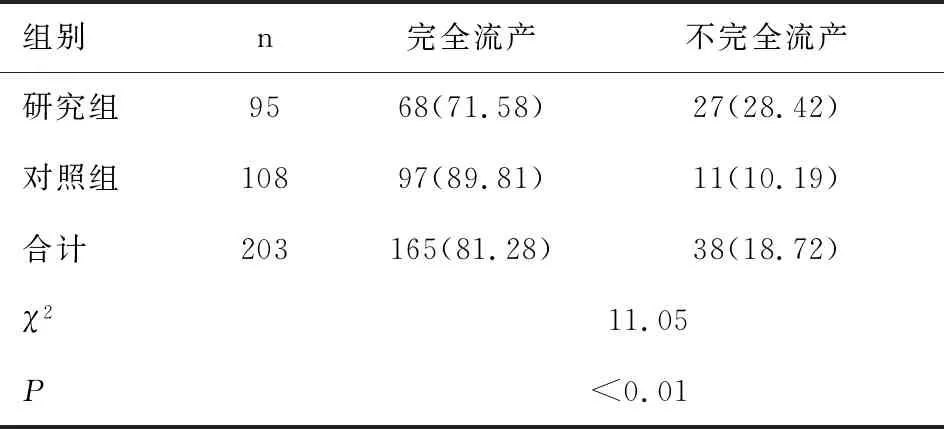
表3 两组患者接受药物治疗后不同结局发生情况比较[n(%)]
2.4影响药物治疗后发生不完全流产的单因素分析
单因素分析结果显示,药物治疗后不完全流产患者年龄及BMI偏大(t=5.05,P<0.01;t=5.62,P<0.01)、痛经比例偏高(χ2=17.78,P<0.01)、绒毛组织中E-cadherin阳性表达率较低(χ2=33.64,P<0.01)、MVD的表达量也低于完全流产患者(t=5.27,P<0.01),见表4。

表4 影响药物治疗后发生不完全流产的单因素分析
2.5影响药物治疗后发生不完全流产的多因素Logistic回归分析
以药物治疗后是否发生不完全流产为因变量,以单因素分析中有统计学差异的因素为自变量进行二分类多因素Logistic回归分析,结果显示,痛经(OR=2.24,95%CI:1.36~3.71,P<0.01)是药物治疗后发生不完全流产的独立危险因素;绒毛组织中E-cadherin的表达(OR=0.69,95%CI:0.55~0.70,P<0.01)和MVD的表达(OR=0.72,95%CI:0.68~0.78,P<0.01)均为患者接受药物治疗后发生不完全流产的独立保护因素,见表5。
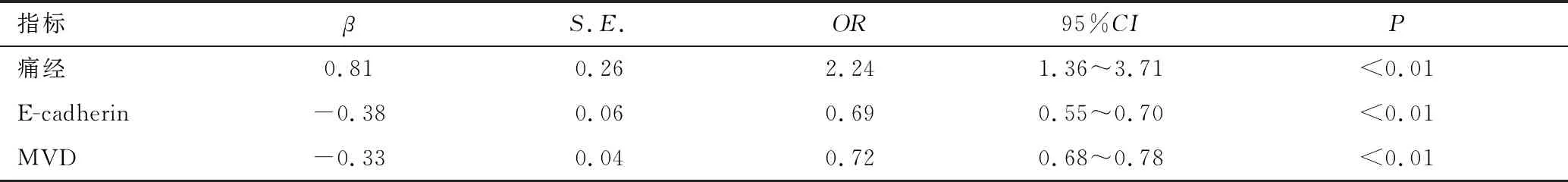
表5 影响药物治疗后发生不完全流产的多因素Logistic回归分析
3讨论
3.1稽留流产绒毛组织中IGF-1、E-cadherin、MVD表达及相关性
胎盘血管网的建立对胚胎的正常生长发育、保障胎儿获取其生长所需的血液灌注量至关重要。胚胎发育早期,机体绒毛膜的一部分细胞分化为胎盘,另一部分分化为胎盘血管网,对子宫螺旋动脉进行重塑,建立起母体与胎儿之间的联系,使胎儿能够通过母体血液获取自身发展所需要的营养[11]。若胎盘血管网建立受到阻碍,造成胎盘微循环障碍,则胎儿通过母体血液摄取必需物质(充足的氧气、免疫因子和营养物质等)接收不足,造成发育不良,甚至引发胎儿死亡[12]。本研究结果也显示,稽留流产患者绒毛组织中MVD的相对表达量明显低于对照组,提示稽留流产患者胎盘血管网发育不良。胎盘血管网的建立由多种生长因子与基因共同协调参与,若其表达过高或过低,都会对胎盘血管网的发育造成消极影响,使得胎盘功能不全,造成胎儿生长发育受限,最终导致流产或死胎等不良结局。
IGF-1对维持子宫内膜正常分泌与增殖有重要意义,其在妊娠早期通过局部组织分泌产生,发挥调控滋养细胞的增殖、分化等过程,对于胚胎的生长发育至关重要。有研究发现,IGF-1能够增强体外孕早期滋养细胞的生物活性,调节胎盘血流动力学,改善胎盘生理功能,促进胎儿的生长发育[13]。本研究结果显示,稽留流产患者绒毛组织中IGF-1表达低于正常流产患者,提示IGF-1低表达与稽留流产的发生存在相关性。其可能原因是由于IGF-1的表达对于滋养细胞的黏附作用有积极影响,可与整合素相互作用,对胚胎着床的信号转导发挥其介导作用。稽留流产患者体内IGF-1表达过低,致使其信号转导功能障碍,进而阻断胚胎着床信号传导,影响胚胎组织的正常生长分化[14]。E-cadherin是一种钙依赖性跨膜糖蛋白,其在同型细胞的相互黏附中有重要作用。既往研究表明E-cadherin表达水平异常升高时会使细胞间黏附增强,降低细胞浸润与迁移能力,对肿瘤的复发与转移有较强的抑制作用[15]。妊娠期间,E-cadherin在母胎蜕膜上皮细胞与滋养细胞中表达广泛,并在受精卵着床到胎盘浸润子宫等多个环节中均有参与[16]。在本研究中,研究组患者E-cadherin阳性率明显低于对照组,与既往研究结果基本一致,究其原因可能是E-cadherin表达下降,使其介导的细胞连接与黏附受到影响,进而造成滋养细胞黏附与浸润能力降低,子宫螺旋动脉的形成出现障碍,血管重塑被阻断,使胎盘血管网的建立被抑制,导致胚胎发育停止,造成稽留流产结局。
3.2米非司酮配伍米索前列醇治疗后发生不完全流产的影响因素
稽留流产因其特殊性,在临床研究中日益受到重视,以往临床治疗多以清宫术为主,虽然效果较好,但易引起感染、宫颈粘连等多种并发症,甚至导致患者继发性不孕,使患者生理、心理受到极大创伤。药物治疗作为一种简单方便、效果较好、患者易于接受的治疗方式,在临床治疗中亦有一定的应用价值[17]。米非司酮为抗孕酮类药物,与孕酮受体结合,表现出高度的受体和组织选择性,阻断绒毛组织供血,促进子宫收缩,使胎盘、胎膜与子宫壁发生剥离,且可扩张、软化宫颈,促进胚胎排出。米索前列醇为前列腺素衍生物,可诱发子宫平滑肌收缩,与米非司酮协同作用,能使宫颈结缔组织中的胶原纤维溶解,促进宫颈软化成熟和扩张,使孕囊排出,应用于终止早孕及小孕周的中期妊娠,取得较好临床效果[18]。
本研究结果也显示,药物治疗后发生不完全流产率约为18.72%,稽留流产患者不完全流产发生率高于正常早孕患者。稽留流产的发生机制尚不明确,目前认为可能与母胎之间的免疫平衡失调、孕酮分泌不足、染色体异常、社会环境及各种感染等多种因素共同作用有关。对于米非司酮配伍米索前列醇治疗后发生不完全流产的影响因素亦不明确[19]。本研究结果发现,药物治疗后不完全流产的发生率在不同年龄和BMI之间存在差异,多因素分析结果也发现,痛经是药物治疗后发生不完全流产的独立危险因素,绒毛组织中E-cadherin的表达和MVD的表达均为患者接受药物治疗后发生不完全流产的独立保护因素,提示稽留流产患者存在痛经史,则其接受药物治疗后发生不完全流产的风险较高,而其E-cadherin表达水平越高,MVD越大,则发生治疗后不完全流产的风险越低。
综上所述,稽留流产患者绒毛组织中IGF-1、E-cadherin表达和MVD含量较低,接受药物治疗后完全流产患者IGF-1、E-cadherin与MVD均高于不完全流产患者,E-cadherin表达水平越高,MVD越大,则出现不完全流产的风险越低。
