加味镇肝熄风汤对帕金森病肝肾阴虚型患者GSH-Px、Cys-C、S100-β及脑神经递质的影响
2023-02-10银罗熙张春玲王瑜韦辉燕陈刚王宝爱
银罗熙, 张春玲, 王瑜, 韦辉燕, 陈刚, 王宝爱
(海口市中医医院,海南海口 570216)
帕金森病(Parkinson’s disease,PD)是一种中枢神经系统退行性疾病,发病率仅次于阿尔茨海默病,是临床第二大中枢神经系统退行性疾病,以静止性震颤、肌张力提高、运动迟缓及姿势步态异常为主要表现,具有较高的致残率[1]。帕金森病以纹状体内多巴胺(dopamine,DA)含量下降、黑质致密部多巴胺能神经元凋亡、变性为病理特征,一旦发病则病情呈逐渐加重趋势[2]。随着帕金森病研究的不断深入,证实炎性因子失衡、氧化应激失衡等因素参与病情发展,并且还可引起神经因子水平失调,故减轻炎症反应、调节氧化应激反应已成为本病治疗的重要思路[3]。多巴丝肼片是本病的主要药物,由苄丝肼50 mg、左旋多巴200 mg组成,对于改善患者临床症状有积极意义,有助于提高患者生活质量,但长期应用效果有限且不良反应较大[4]。通过中药辅助治疗以提高疗效已成为当前的研究热点。本病好发于中老年人,中医认为,人至中年后,肝肾逐渐亏虚,阴液不足,形成肝肾阴虚证,阴虚不能制约阳气,阳气失于制约则化风,导致肝风内动而表现为震颤[5]。镇肝熄风汤是中医治疗肝肾阴虚型中风病的代表方,笔者对此进行调整,组成加味镇肝熄风汤,用以治疗帕金森病,取得较好的疗效,本研究将对其作用机制进行探讨。
1 对象与方法
1.1 研究对象及分组 选取2019年7月至2021年6月在海口市中医医院就诊且明确诊断为帕金森病(肝肾阴虚型)的患者,共92例。采用随机数字表法将患者随机分为观察组和对照组,每组各46例。本研究符合医学伦理学要求并通过海口市中医医院医学伦理委员会的审核批准,批准号为20171201。
1.2 诊断标准 西医诊断标准:参照《中国帕金森病的诊断标准(2016版)》[6],患者表现为静止性震颤,多始发于一侧上肢远端,情绪激动时加重,拇指与食指呈“搓丸样”动作,肌强直,运动缓慢,部分患者可引起姿势障碍,情绪抑郁,经左旋多巴治疗后症状缓解有助于诊断。中医辨证标准:参照《中药新药临床研究指导原则(试行)》[7],中医证型为肝肾阴虚型:患者乏力明显,五心烦热,腰膝酸软,肢体震颤,眼睛干涩,舌红苔黄,舌体瘦小,脉细数。
1.3 纳入标准 ①符合上述帕金森病诊断标准;②中医证型为肝肾阴虚型;③均为初次治疗,且近期未接受其他临床研究用药;④依从性较好,能配合相关治疗;⑤自愿参加本研究并签署了知情同意书的患者。
1.4 排除标准 ①对本研究受试药物过敏的患者;②既往存在甲状腺功能亢进、特发性震颤等疾病的患者;③伴有痴呆的患者;④存在精神障碍,不能配合治疗和观察的患者;⑤脑血管疾病、中毒等引起的继发性帕金森综合征患者;⑥肝肾功能障碍患者;⑦依从性差,未按规定进行治疗,或自行加用其他治疗措施的患者。
1.5 治疗方法
1.5.1 对照组 给予多巴丝肼片的西医常规治疗。用法:多巴丝肼片(上海罗氏制药有限公司生产,批准文号:国药准字H10930198;批号:20171203、20180602、20190601;规格:250mg/片),口服,每次1片,每天3次。疗程为12周。
1.5.2 观察组 在对照组的基础上联合加味镇肝熄风汤治疗。方药组成:熟地黄15 g,天冬15 g,玄参15 g,炒白芍15 g,茵陈15 g,枸杞子15 g,煅龙骨15 g,煅牡蛎15 g,麦芽15 g,怀牛膝15 g,龟板10 g,代赭石10 g,炙甘草5 g。随症加减:乏力明显者加党参10 g;五心烦热者加地骨皮15 g;腰膝酸软者加山茱萸15 g。上述中药均由海口市中医医院中药房统一提供。每日1剂,常规煎取300 mL,分2次服用,分别于上午和下午各服用150 mL,周一至周五给药治疗,周六和周日停药。疗程为12周。
1.6 观察指标 (1)抽取患者空腹静脉血,采用酶联免疫吸附法(ELISA)检测血清过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化酶(glutathione peroxidase,GSH-Px)、白细胞介素6(interleukin-6,IL-6)水平。严格按试剂盒说明书操作,试剂盒由上海研卉生物科技有限公司提供。观察2组患者治疗前后血清CAT、GSH-Px、IL-6水平的变化情况。(2)抽取患者空腹静脉血,采用ELISA法测定血清胱抑素C(cystatin C,Cys-C)、S100-β蛋白(S100-βprotein,S100-β)水平,严格按试剂盒说明书操作,试剂盒由上海研卉生物科技有限公司提供。观察2组患者治疗前后血清Cys-C、S100-β水平的变化情况。(3)抽取患者空腹静脉血,采用ELISA法测定血清5-羟色胺(serotonin,5-HT)、多巴胺(dopamine,DA)水平,严格按试剂盒说明书操作,试剂盒由南京建成生物科技有限公司提供。观察2组患者治疗前后血清5-HT、DA水平的变化情况。(4)观察2组患者治疗前及治疗6周、12周后统一帕金森病评分量表(United Parkinson’s Disease Rating Scale,UPDRS)评分[6]的变化情况,其中,UPDRSⅢ和UPDRSⅣ主要评估患者的运动功能,UPDRSⅡ和UPDRSⅠ主要评估患者的精神情感及行为方面。总分值越高,提示病情越严重。(5)安全性评价:观察2组患者治疗过程中肝功能异常、肾功能损伤、胃肠道反应、心律失常、情绪焦虑等不良反应发生情况,出现严重不良反应时及时给予药物干预并退出研究。
1.7 疗效评价标准 参照《中国帕金森病的诊断标准(2016版)》[6]的相关内容制定疗效评价标准,分显效、有效、无效3级。显效:治疗后患者UPDRS评分降幅>45%;有效:治疗后患者UPDRS评分降幅为15%~45%;无效:治疗后患者UPDRS评分降幅<15%。总有效率=(显效例数+有效例数)/总病例数×100%。
1.8 统计方法 应用SPSS23.0统计软件进行数据的统计分析。计量资料(均符合正态分布)用均数±标准差(±s)表示,组内治疗前后比较采用配对t检验,组间比较采用两独立样本t检验;计数资料用率或构成比表示,组间比较采用卡方检验。均采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2组患者基线资料比较 对照组46例患者中,男26例,女20例;年龄37~72岁,平均(50.16±5.87)岁;病程1~8年,平均(4.57±1.36)年;体质量55~86 kg,平均(64.17±4.63)kg;Hoehn-Yahr分级:Ⅲ级28例,Ⅱ级18例。观察组46例患者中,男25例,女21例;年龄40~73岁,平均(51.61±5.96)岁;病程1~9年,平均(4.75±1.09)年;体质量53~89 kg,平均(64.61±4.81)kg;Hoehn-Yahr分级:Ⅲ级26例,Ⅱ级20例。2组患者的性别、年龄、病程、体质量、Hoehn-Yahr分级等基线资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 2组患者治疗前后血清CAT、GSH-Px、IL-6水平比较 表1结果显示:治疗前,2组患者血清CAT、GSH-Px、IL-6水平比较,差异均无统计学意义(P>0.05)。治疗后,2组患者血清CAT、GSH-Px水平均较治疗前升高(P<0.05),IL-6水平均较治疗前降低(P<0.05),且观察组对血清CAT、GSH-Px水平的升高作用及对血清IL-6水平的降低作用均明显优于对照组,差异均有统计学意义(P<0.01)。
表1 2组帕金森病患者治疗前后血清过氧化氢酶(CAT)、谷胱甘肽过氧化酶(GSH-Px)、白细胞介素6(IL-6)水平比较Table 1 Comparison of serum CAT,GSH-Px and IL-6 levels between the two groups of Parkinson’s disease patients before and after treatment (±s)
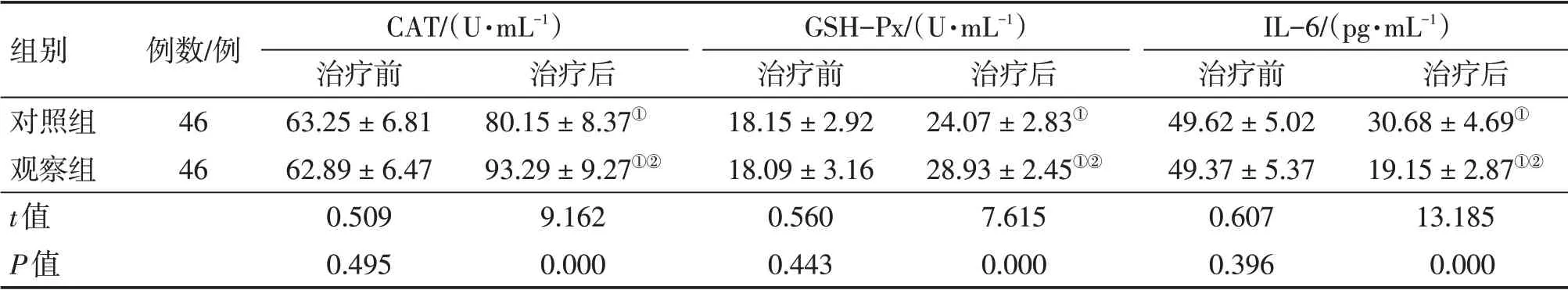
表1 2组帕金森病患者治疗前后血清过氧化氢酶(CAT)、谷胱甘肽过氧化酶(GSH-Px)、白细胞介素6(IL-6)水平比较Table 1 Comparison of serum CAT,GSH-Px and IL-6 levels between the two groups of Parkinson’s disease patients before and after treatment (±s)
注:①P<0.05,与治疗前比较;②P<0.01,与对照组治疗后比较
组别对照组观察组t值P值例数/例46 46 CAT/(U·mL-1)治疗前63.25±6.81 62.89±6.47 0.509 0.495治疗后80.15±8.37①93.29±9.27①②9.162 0.000 GSH-Px/(U·mL-1)治疗前18.15±2.92 18.09±3.16 0.560 0.443治疗后24.07±2.83①28.93±2.45①②7.615 0.000 IL-6/(pg·mL-1)治疗前49.62±5.02 49.37±5.37 0.607 0.396治疗后30.68±4.69①19.15±2.87①②13.185 0.000
2.3 2组患者治疗前后血清Cys-C、S100-β水平比较 表2结果显示:治疗前,2组患者血清Cys-C、S100-β水平比较,差异均无统计学意义(P>0.05)。治疗后,2组患者血清Cys-C、S100-β水平均较治疗前降低(P<0.05),且观察组对血清Cys-C、S100-β水平的降低作用均明显优于对照组,差异均有统计学意义(P<0.01)。
表2 2组帕金森病患者治疗前后血清胱抑素C(Cys-C)、S100-β蛋白(S100-β)水平比较Table 2 Comparison of serum Cys-C and S100-βlevels between the two groups of Parkinson’s disease patients before and after treatment (±s)
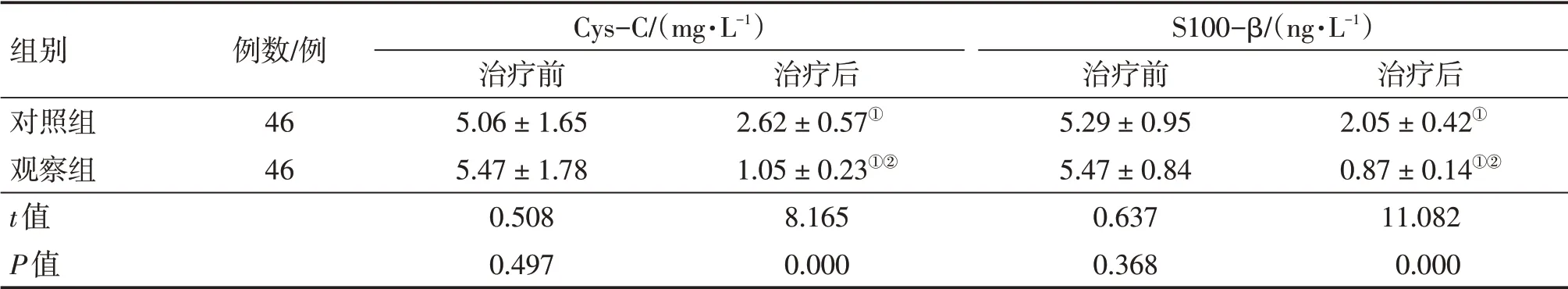
表2 2组帕金森病患者治疗前后血清胱抑素C(Cys-C)、S100-β蛋白(S100-β)水平比较Table 2 Comparison of serum Cys-C and S100-βlevels between the two groups of Parkinson’s disease patients before and after treatment (±s)
注:①P<0.05,与治疗前比较;②P<0.01,与对照组治疗后比较
组别对照组观察组t值P值例数/例46 46 Cys-C/(mg·L-1)治疗前5.06±1.65 5.47±1.78 0.508 0.497治疗后2.62±0.57①1.05±0.23①②8.165 0.000 S100-β/(ng·L-1)治疗前5.29±0.95 5.47±0.84 0.637 0.368治疗后2.05±0.42①0.87±0.14①②11.082 0.000
2.4 2组患者治疗前后血清5-HT、DA水平比较 表3结果显示:治疗前,2组患者血清5-HT、DA水平比较,差异均无统计学意义(P>0.05)。治疗后,2组患者血清5-HT、DA水平较治疗前升高(P<0.05),且观察组对血清5-HT、DA水平的升高作用均明显优于对照组,差异均有统计学意义(P<0.01)。
表3 2组帕金森病患者治疗前后血清5-羟色胺(5-HT)、多巴胺(DA)水平比较Table 3 Comparison of serum 5-HT and DA levels between the two groups of Parkinson’s disease patients before and after treatment (±s)

表3 2组帕金森病患者治疗前后血清5-羟色胺(5-HT)、多巴胺(DA)水平比较Table 3 Comparison of serum 5-HT and DA levels between the two groups of Parkinson’s disease patients before and after treatment (±s)
注:①P<0.05,与治疗前比较;②P<0.01,与对照组治疗后比较
组别对照组观察组t值P值例数/例46 46 5-HT/(μg·L-1)治疗前192.41±28.13 193.74±27.39 0.483 0.524治疗后247.63±35.20①351.17±41.29①②11.083 0.000 DA/(pg·mL-1)治疗前38.92±5.63 39.28±5.37 0.617 0.386治疗后57.01±6.19①68.02±5.64①②9.835 0.000
2.5 2组患者治疗前后UPDRS评分比较 表4结果显示:治疗前,2组患者的UPDRS评分比较,差异无统计学意义(P>0.05)。治疗6周和12周后,2组患者的UPDRS评分均较治疗前明显降低(P<0.05),且观察组在治疗6周和12周后对UPDRS评分的降低作用均明显优于对照组,差异均有统计学意义(P<0.01)。
表4 2组帕金森病患者治疗前后统一帕金森病评分量表(UPDRS)评分比较Table 4 Comparison of UPDRS scores between the two groups of Parkinson’s disease patients before and after treatment (±s,分)

表4 2组帕金森病患者治疗前后统一帕金森病评分量表(UPDRS)评分比较Table 4 Comparison of UPDRS scores between the two groups of Parkinson’s disease patients before and after treatment (±s,分)
注:①P<0.05,与治疗前比较;②P<0.01,与对照组同期比较
组别对照组观察组t值P值例数/例46 46治疗前49.18±4.15 49.47±3.87 0.516 0.487治疗6周后36.08±2.83①29.76±2.58①②7.614 0.000治疗12周后16.15±1.83①11.75±1.43①②9.195 0.000
2.6 2组患者临床疗效比较 表5结果显示:治疗12周后,观察组的总有效率为95.65%(44/46),对照组为76.09%(35/46),组间比较,观察组的疗效明显优于对照组,差异有统计学意义(χ2=7.256,P<0.01)。
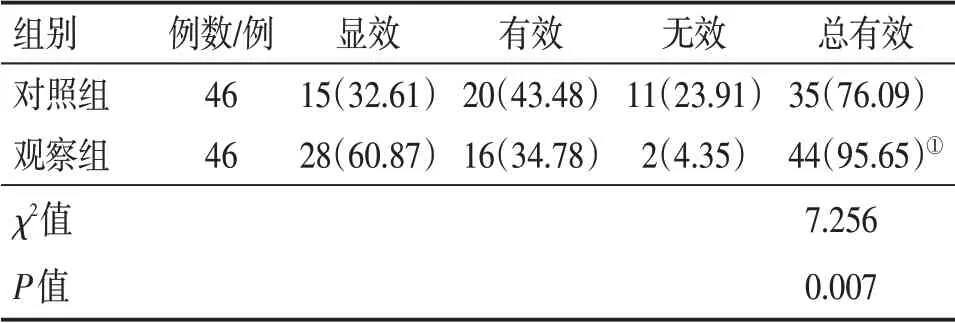
表5 2组帕金森病患者临床疗效比较Table 5 Comparison of clinical efficacy between the two groups of Parkinson’s disease patients [例(%)]
2.7 2组患者不良反应发生情况比较 表6结果显示:2组患者的不良反应均以肝功能异常、肾功能损伤、胃肠道反应、心律失常、情绪焦虑为主,观察组的不良反应总发生率为13.04%(6/46),对照组为17.39%(8/46),组间比较,差异无统计学意义(P>0.05)。

表6 2组帕金森病患者不良反应发生情况比较Table 6 Comparison of the incidence of adverse events between the two groups of Parkinson’s disease patients[例(%)]
3 讨论
帕金森病(Parkinson’s disease,PD)病机复杂,病因目前尚未完全阐明,有学者认为年龄是本病发生的关键因素,即随着年龄增长,脑黑质多巴胺能神经元退化,多巴胺水平逐渐降低[8-9]。基因突变也被认为与本病相关,机体内突触核蛋白基因过表达可显著提高活性氧水平,进而使多巴胺分泌减少[10]。同时,环境因素参与帕金森病发生,一氧化碳、锰尘、除草剂等毒性成分也被认为与本病发生相关[11]。多巴丝肼片是由苄丝肼及左旋多巴组成,左旋多巴可透过血脑屏障,是多巴胺合成的中间产物,左旋多巴口服后可快速脱羧合成多巴胺,导致其大部分不能到达神经节而起效[12]。苄丝肼是一种脱羧酶抑制剂,可补充神经节中多巴胺水平,与左旋多巴合用起协同作用,从而发挥治疗目的,但长期应用效果有限,可出现“开关现象”(是指帕金森病患者长期应用左旋多巴类药物后出现的药效波动现象,是该类药物产生的一种副作用)等,且可增加不良反应发生率[13]。
帕金森病患者体内可存在持续神经炎症。白细胞介素6(IL-6)由Th2细胞分泌,炎症反应时其数值显著升高,可激活小胶质细胞、巨噬细胞等,对神经元造成损伤并加重其退化[14]。IL-6在体内具有较高的稳定性,可促进IL-8等促炎性因子分泌,引起血管内皮功能损伤,诱发血小板功能活化。胱抑素C(Cys-C)是由人体有核细胞分泌产生的小分子蛋白质,主要经肾小球滤过,参与炎症反应形成,其数值升高可增强血管内皮损伤,加强炎症反应,促进血栓形成[15]。近年来Cys-C与帕金森病关系逐渐得到重视,研究表明Cys-C高表达时可损伤神经功能,而寿津[16]的研究发现,帕金森病患者血液中Cys-C水平显著升高。
氧化应激参与帕金森病病情发展,随着年龄增长,患者的抗氧化能力降低,氧自由基水平升高,从而形成氧化损伤[17]。单胺氧化酶B可降解多巴胺,而该过程中可生成过氧化氢(H2O2),引起脂质过氧化反应,从而损伤神经元[18]。因此,抗氧化已成为帕金森病治疗的重要思路,其有助于保护神经元,延缓神经变性,从而起到延缓病情发展的目的。过氧化氢酶(CAT)、谷胱甘肽过氧化酶(GSH-Px)具有抗氧化活性,帕金森病患者体内CAT、GSH-Px水平降低是自由基大量生成的重要原因,从而加速多巴胺能神经元损伤,加速病情发展[19]。本研究结果显示,治疗后观察组患者血清CAT、GSH-Px水平高于对照组,IL-6水平低于对照组,表明联合加味镇肝熄风汤治疗,可有效纠正氧化应激失衡。
S100-β蛋白主要分布于神经胶质细胞和施旺细胞,脑组织损伤后可经血脑屏障进入外周血,是评估神经功能损伤的重要指标,既往研究多强调其与脑卒中的关系[20]。随着研究的不断深入,S100-β蛋白水平失衡与帕金森病的关系得到证实,患者存在神经细胞凋亡及坏死,导致血液及脑脊液中S100-β蛋白浓度均明显降低,其数值降幅与病情严重程度呈正相关[21-22]。5-羟色胺(5-HT)和多巴胺(DA)是机体内重要的神经递质,在正常状态下5-HT可对DA的生成产生抑制作用,但帕金森病患者体内多巴胺能神经元的变性及丢失,可导致5-HT释放明显减少[23]。侯英娟等[24]发现帕金森病患者5-HT水平明显降低,对照组单用普拉克索,观察组联合补肾活血通络胶囊,结果显示治疗后观察组5-HT水平明显高于对照组。本研究结果显示,治疗后观察组S100-β水平明显低于对照组,5-HT、DA水平则明显高于对照组,表明联合加味镇肝熄风汤治疗,可有效调节脑神经递质分泌。
本病应归属于中医学的“震颤”“颤证”等范畴。明代著名医家孙一奎认为:“此病壮年鲜有,中年以后乃有之,老年尤多,夫年老阴血不足。”提出年龄增大,患者肝肾亏虚是本病发生的基础。《灵枢·邪客篇》曰:“邪气恶血,固不得住留,住留则伤筋络骨节,机关不得屈伸,故拘挛也。”认为肝疏泄不利是关节类疾病发生的重要机制。《素问·至真要大论》曰:“诸风掉眩,皆属于肝。”首次提出内风与肝脏关系密切,而肢体震颤符合风邪致病特点。人至中年后,肝肾日渐亏虚,阴液不足,无以制约阳气,虚阳化风而引起震颤,故治疗当以滋补肝肾、熄风止痉为法。基于此,本课题组采用加味镇肝熄风汤治疗,效果显著。方中熟地黄滋补肝肾,填精,为君药。天冬、玄参养阴清热、生津;枸杞子滋补肝肾、明目;龟板养阴填精,上述4味药为臣药。白芍柔肝止痛,养血,促进肝之疏泄功能恢复;茵陈清热化湿,疏肝,从而平抑肝阳;煅龙骨、煅牡蛎、代赭石共奏平肝潜阳、镇静安神功效,上述药物为佐药。甘草调和诸药,为使药。全方合用,共奏滋补肝肾、熄风止痉之功效。
本研究结果显示,UPDRS评分方面,观察组联合加味镇肝熄风汤治疗6周、12周后,患者的UPDRS评分均明显低于对照组(P<0.01);疗效方面,观察组的总有效率为95.65%(44/46),对照组为76.09%(35/46),组间比较,观察组的疗效明显优于对照组(P<0.01);不良反应方面,观察组的不良反应总发生率为13.04%(6/46),对照组为17.39%(8/46),组间比较,差异无统计学意义(P>0.05)。表明联合加味镇肝熄风汤治疗,可显著提高临床疗效,且具有较高的安全性。
加味镇肝熄风汤的作用机制复杂[25-27],本研究主要包括以下方面:(1)加味镇肝熄风汤可有助于降低IL-6等促炎性因子,从多途径入手以减轻炎症反应;(2)可调节氧化指标,具有较强的抗氧化作用,可有效保护神经功能,更有助于促进多巴胺能神经元修复,延缓病情的进一步发展。
综上所述,笔者认为对于帕金森病肝肾阴虚型患者而言,联合加味镇肝熄风汤治疗有重要意义,可有效纠正患者氧化应激失衡,调节脑神经递质分泌,提高临床疗效,且具有较高的安全性,可为临床医师制定治疗方案提供新的选择。
