新鲜银耳与热风干燥银耳营养成分和风味特征比较
2023-02-09孙海斓席嘉佩张军淼胡秋辉赵立艳
孙海斓,席嘉佩,张军淼,陈 潇,胡秋辉,2,赵立艳,*
(1.南京农业大学 食品科技学院, 江苏 南京 210095;2.南京财经大学 食品科学与工程学院, 江苏 南京 210023)
银耳(Tremellafuciformis)又名雪耳、白木耳或银耳子等,中医认为银耳性平味甘,具有滋阴润燥、健脾和胃的功效,是典型的药食兼用菌。银耳中富含蛋白质、氨基酸、膳食纤维、多种维生素和矿物质等基本营养成分;此外,银耳中还含有多糖、多酚、黄酮和萜类等生物活性物质[1],具有抗肿瘤、抗氧化、抗衰老、改善记忆和保护胃肠等多重益生作用[2]。新鲜银耳子实体由多个扁形瓣片组成,半透明、质软而富有弹性、泡发和炖煮时间短、口感软糯。随着育种技术的提高,通过代料种植和智能化菌室培育,使得新鲜银耳产量大幅提高,且一年四季均可采收。但新鲜银耳含水量高,易腐烂变质,不利于运输贮存,故传统银耳的销售形式以干制品为主。随着冷链运输技术的逐步升级,新鲜银耳的获取不再受产地的限制,在市场上流通量增大,新鲜银耳越来越受到消费者的青睐[3]。目前对于银耳营养的研究主要集中在干制银耳[ 4-5],尤其是热风干燥后的银耳,关于新鲜银耳的营养成分和生物活性成分的研究较少,以至于消费者对鲜、干银耳的选购缺乏科学依据。除了营养品质外,风味也是影响消费者选购银耳的重要因素。常用的热风干燥处理不仅会影响食用菌原料的营养品质,对其风味也有一定程度的影响,而挥发性风味化合物的测定是研究食用菌风味的重要指标。目前气相色谱- 质谱(gas chromatography-mass spectrometer,GC- MS)技术是常见的挥发性风味化合物分析手段,但其无法鉴定出一些微量的低沸点又对风味至关重要的挥发性化合物,且其预处理步骤和时间限制了其应用。近年来,气相色谱- 离子迁移谱(gas chromatography-ion mobility spectroscopy, GC- IMS)技术因其快速、无损和高通量检测的特点,也被广泛应用于食品风味分析研究[6]。
本实验拟以新鲜银耳为研究对象,对新鲜银耳样品中的营养和风味品质进行全面分析,对其营养价值进行综合评价;同时对比新鲜银耳和经60 ℃热风干燥处理后银耳中的基本营养成分、生物活性成分及挥发性风味化合物的区别,并通过GC- IMS和GC- MS技术联用初步探究新鲜和干燥银耳的风味特征及差异,以期为消费者选购新鲜银耳提供参考,进一步为新鲜银耳精深加工产品的开发和利用提供理论基础。
1 材料与方法
1.1 材料与试剂
新鲜银耳,福建省宁德市古田县;色氨酸标准品,上海麦恪林生化科技有限公司;芦丁标准品,上海源叶生物科技有限公司;没食子酸标准品、齐墩果酸标准品、邻二氯苯,上海阿拉丁生化科技股份有限公司;氨基酸混合标液,日本Wako公司。
1.2 仪器与设备
DHG- 9030A型电热恒温鼓风干燥箱,上海一恒科技有限公司;H- 400A型高速多功能粉碎机,浙江省永康市哈瑞工贸有限公司;TDL- 5型台式离心机,上海安亭科学仪器厂;KQ- 250型数控超声波清洗器,昆山市超声仪器有限公司;HH- 6型数显恒温水浴锅,江苏国华电器有限公司;1200型高效液相色谱仪,美国Agilent公司;L- 8900型全自动氨基酸分析仪,日立高新技术公司;Multiwave Pro型微波消解仪(附有聚四氟乙烯消解罐),奥地利Anton Paar公司;FlavourSpec®型风味分析仪,德国G.A.S公司;Varioskan LUX型多功能酶标仪、iCAP_Qc型电感耦合等离子体质谱仪、TSQ9000型三重四极杆GC- MS/MS,赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1原料预处理
挑选新鲜无虫害的银耳,洗净晾干,随机选取部分作为鲜样备用;其余于60 ℃干燥箱中热风烘干,至水分质量分数在15%以下(银耳水分含量的控制参考GB 7096—2014《食品安全国家标准 食用菌及其制品》中理化指标规定)。取出干燥后样品打粉过60目筛,制得干银耳粉末,避光保存于干燥器中作为干样备用。
1.3.2粗蛋白、粗脂肪等营养成分的测定
分别依据GB 5009.5—2016《食品中蛋白质的测定》、GB 5009.6—2016《食品中脂肪的测定》、GB 5009.4—2016《食品中灰分的测定》、GB 5009.88—2014《食品中膳食纤维的测定》,测定样品中的蛋白质、脂肪、灰分和不溶性膳食纤维、可溶性膳食纤维和总膳食纤维含量。
1.3.3生物活性成分的测定
1.3.3.1 样品前处理
分别称取适量研磨充分的鲜、干银耳样品,按照提取料液比(g∶mL)1∶40(干基),加入适量80%(体积分数)的乙醇,于35 ℃下超声提取1 h,取出冷却后以12 000 r/min离心10 min,取上清液于4 ℃冰箱冷藏,作为提取液待测。
1.3.3.2 总多酚含量的测定
参考姬妍茹等[7]的方法,采用福林酚分光光度法测定样品总多酚含量。
1.3.3.3 总黄酮含量的测定
参考董海胜等[8]的方法,采用亚硝酸钠- 硝酸铝- 氢氧化钠比色法测定样品总黄酮含量。
1.3.3.4 总三萜含量的测定
依据NY/T 3676—2020《灵芝中总三萜含量的测定分光光度法》,采用质量分数5%的香草醛- 冰醋酸显色法测定样品总三萜含量。
1.3.3.5 粗多糖含量的测定
依据NY/T1676—208《食用菌中粗多糖含量的测定》,采用苯酚硫酸法测定样品粗多糖的含量。
1.3.4氨基酸含量的测定
1.3.4.1 酸水解氨基酸含量的测定
准确称取研磨充分的鲜、干样品各0.200 g(以干基计),分别加到水解管中,加入6 mol/L的浓盐酸溶液15 mL,充分混匀,充氮气后封管,在(110±1) ℃的电热恒温鼓风干燥箱中水解22 h,取出后冷却至室温。打开水解管过滤至50 mL容量瓶中,用蒸馏水少量多次冲洗水解管,最后用蒸馏水定容至刻度线,混匀备用。准确吸取2.0 mL滤液至10 mL试管中用氮吹仪吹干,再用2.0 mL的0.02 mol/L稀盐酸复溶,震荡均匀,经0.22 μm有机滤膜过滤至样品瓶中,于4 ℃冰箱储存,待全自动氨基酸分析仪检测。
1.3.4.2 碱水解色氨酸含量的测定
利用高效液相色谱法测定色氨酸的含量,参考GB/T 15400—2018《饲料中色氨酸的测定》方法稍作修改。准确称取研磨充分的鲜、干样品各0.500 g(以干基计)分别加到水解管中,加入10 mL的 6 mol/L 氢氧化锂溶液,充氮1 min,隔绝空气,旋紧密封水解管于110 ℃干燥箱中水解20 h。取出水解管冷却,用乙酸钠缓冲液定容至25 mL,过0.22 μm水系滤膜至棕色样品瓶中,于4 ℃冰箱保存待测。
色谱条件:Zorbax-Eclipse XDB- C18型(250 mm×4.6 mm×5 μm)色谱柱,柱温为25 ℃;流动相为0.008 5 mol/L的乙酸钠缓冲溶液- 甲醇溶液(二者体积比为95∶5),等度洗脱,流速为1 mL/min,进样量为20 μL;紫外检测波长为280 nm。
1.3.5矿物质含量的测定
依据GB 5009.268—2016《食品中多元素的测定》中电感耦合等离子体质谱法(ICP- MS),测定样品中矿物质含量。
1.3.6GC-IMS分析
1.3.6.1 样品制备
分别称取研磨充分的鲜、干银耳样品各0.500 g(以干基计)于顶空瓶中密封作为GC- IMS的样品待测。
1.3.6.2 GC- IMS条件
参考Hou等[9]方法稍作修改。顶空进样孵化温度为50 ℃,孵化时间为15 min,孵化转速为250 r/min,顶空进样温度为80 ℃,进样量为500 μL;采用不分流模式;色谱柱温度为(60±1)℃;载气为高纯氮气(体积分数≥99.999%)。载气流速为0~2 min,2 mL/min;2~10 min,2~10 mL/min;10~20 min,10~50 mL/min;20~30 min,50~150 mL/min;分析时间共30 min。
1.3.7GC-MS分析
1.3.7.1 顶空固相微萃取条件
准确称取研磨充分的样品0.500 g(以干基计)于顶空瓶,加入40 μL邻二氯苯(质量浓度为2.61 μg/mL)内标后旋紧顶空瓶盖,将样品于50 ℃水浴平衡15 min。将老化后的萃取头(50/30 μm,DVB/CAR/PDMS)插入顶空萃取20 min,此后于GC进样口解析挥发性化合物,进样口温度及解析时间分别为220 ℃和2 min。
1.3.7.2 色谱条件
采用HP- 5MS(30 m×0.25 mm×0.25 μm)型色谱柱。GC柱温箱的升温程序为40 ℃的初始温度保持10 min,然后以5 ℃/min 的速度升至90 ℃保持5 min;以10 ℃/min 的速度升至150 ℃保持3 min;以10 ℃/min 的速度升至260 ℃保持3 min。载气 He 的流速为 1.0 mL/min;不分流进样,进样口温度为 260 ℃,解吸3 min。
1.3.7.3 质谱条件
离子源为EI源,温度为230 ℃,电子能量为70 eV,四极杆温度为15 ℃;无溶剂延迟;采集模式为全扫描,质量扫描范围m/z为35~650 u。
利用Xcalibur V4.2软件对HS- SPME- GC- MS检测结果进行分析。通过与NIST数据库比对定性化合物。采用内标法定量被测组分的相对含量,以邻二氯苯作为内标,挥发性化合物的含量计算方法见式(1)。
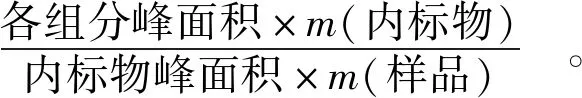
(1)
式(1)中,w(挥发性化合物),μg/kg;m(内标物),μg;m(样品),kg。
1.4 数据处理
采用Excel 2019和SPSS 20.0软件对数据进行统计学分析,采用Student’s t test进行显著性差异分析,每组样品重复测定3次,P<0.05表示差异显著。利用LAV软件中的VOCal插件对样品中挥发性化合物进行定性分析,利用Reporter插件对比样品间的差异得到差异谱图,利用Gallery Plot插件直观比较样品间挥发性成分的差异并得到指纹图谱。
2 结果与分析
2.1 鲜、干银耳粗蛋白、粗脂肪等营养成分分析
银耳的粗蛋白、粗脂肪等营养成分测定结果见表1。由表1可见,鲜、干银耳中脂肪含量均很低,是典型的高蛋白、低脂肪的食用菌。与鲜银耳相比,经过热风干燥的银耳中粗蛋白、粗脂肪和灰分含量显著减少(P<0.05),这可能是因为长时间热风干燥导致部分蛋白质水解成游离氨基酸后又进一步参与美拉德反应;干燥过程中脂肪也易出现氧化水解,导致干燥后银耳中脂肪含量减少。干燥前后银耳中不可溶和可溶膳食纤维含量无显著变化。银耳细胞壁是其不可溶性膳食纤维的主要来源,主要成分为木质素、纤维素、甘露聚糖和β-葡聚糖;银耳中可溶性膳食纤维一般为果胶、半乳甘露聚糖和少量葡聚糖等[10],是良好的益生元,有利于乳酸菌的增殖。可见,银耳中总膳食纤维含量高且可溶性膳食纤维占比大,具有很高营养价值,是重要的可溶性膳食纤维食物来源,具有广阔的开发应用前景。

表1 鲜、干银耳粗蛋白、粗脂肪等营养成分含量Tab.1 Content of crude protein, crude fat and other nutrient components of fresh and dried Tremella fuciformis g/100g
2.2 鲜、干银耳生物活性成分分析
食用菌中除了常见的营养成分也富含多种生物活性成分,近年来,从食用菌中提取多酚、黄酮类化合物成为研究热点[11]。银耳的生物活性成分测定结果见表2。由表2可知,鲜银耳样品中的生物活性物质(粗多糖、总三萜和总多酚)显著高于热风干燥后的样品(P<0.05)。经60 ℃热风干燥后银耳中粗多糖含量减少29.07%,这是因为,热风干燥过程可能会加速多糖降解为部分还原单糖,同时也会促进美拉德反应发生,导致部分还原糖类被消耗,从而降低银耳中粗多糖含量;总三萜含量减少56.55%,判断是热风干燥过程中长时间的高温可能会对三萜结构造成破坏[12];总多酚含量减少31.21%,这可能是因为热风干燥过程中,高温条件下银耳中酚类物质易被氧化分解,导致总酚含量下降[13]。此外,鲜银耳中4种生物活性成分含量由多到少依次为粗多糖、总三萜、总多酚、总黄酮,这可为后期银耳活性成分提取和功能性产品定向开发提供理论基础。

表2 鲜、干银耳生物活性成分含量Tab.2 Contents of bioactive ingredients of fresh and dried Tremella fuciformis g/100g
2.3 鲜、干银耳总氨基酸含量及组成分析
鲜、干银耳中氨基酸含量和种类丰富,银耳的水解氨基酸测定结果见表3。由表3可知,鲜、干银耳中均含有18种氨基酸,其中包括8种人体必需氨基酸。银耳中主要氨基酸为谷氨酸,其次为天冬氨酸和亮氨酸。鲜银耳中氨基酸总量(TAA)要显著高于干银耳(P<0.05),这可能是因为在长时间热风干燥过程中,加热使得银耳中的氨基酸(常见的有精氨酸、组氨酸和赖氨酸)和还原糖发生美拉德反应,从而消耗了银耳中的氨基酸;此外,热风干燥过程中随着水分的流失也会导致部分氨基酸含量减少。鲜银耳和干银耳中必需氨基酸(EAA)含量占比(EAA/TAA)为40.843%和40.110%,必需氨基酸占非必需氨基酸(NEAA)含量的比例为69.043%和66.973%,都要明显高于常见的苹果、梨、芒果和蒲桃等水果[14]。WHO/FAO标准规定的理想蛋白模式人体必需氨基酸与总氨基酸比值(EAA/TAA)为40%左右,人体必需氨基酸与非必需氨基酸比值(EAA/NEAA)在60%以上。可见鲜、干银耳的EAA/TAA和EAA/NEAA均接近WHO/FAO标准规定的蛋白模式。

表3 银耳中氨基酸含量Tab.3 Amino acid contents in Tremella fuciformis mg/g
将银耳的必需氨基酸占总氨基酸的质量分数与WHO/FAO模式和全鸡蛋模式谱中相应氨基酸的质量分数进行比较,结果如表4。由表4可见,银耳中NEAA/TAA值高于WHO/FAO模式,略低于全鸡蛋模式谱,其中鲜银耳中亮氨酸、甲硫氨酸和半胱氨酸质量分数还高于全鸡蛋模式谱,可见银耳是优质的甲硫氨酸和半胱氨酸来源。此外,食物中蛋白质的营养价值除了与必需氨基酸的含量有关,还与其组成比例有密切关联。本研究参考朱圣陶等[15]的氨基酸比值系数(RC)法对鲜、干银耳中必需氨基酸组成进行了分析,并结合WHO和FAO共同修订的理想蛋白必需氨基酸模式谱评价鲜、干银耳中氨基酸的营养价值,银耳中必需氨基酸的组成分析见表5。由表5可知:鲜银耳中苏氨酸、亮氨酸、苯丙氨酸和酪氨酸的RC值接近1,说明其含量接近模式谱;鲜、干银耳中色氨酸、甲硫氨酸和半胱氨酸的RC值大于1,说明其含量相对过剩;异亮氨酸、赖氨酸的RC值小于1,含量相对不足,异亮氨酸为鲜、干银耳的第一限制性氨基酸。此外,SRC值反映的是食物中氨基酸与模式氨基酸偏离程度,SRC值越接近100则该食物氨基酸营养价值越高。鲜银耳的SRC值为73.871,高于干银耳,可知鲜银耳的氨基酸营养价值更接近WHO/FAO推荐模式蛋白。
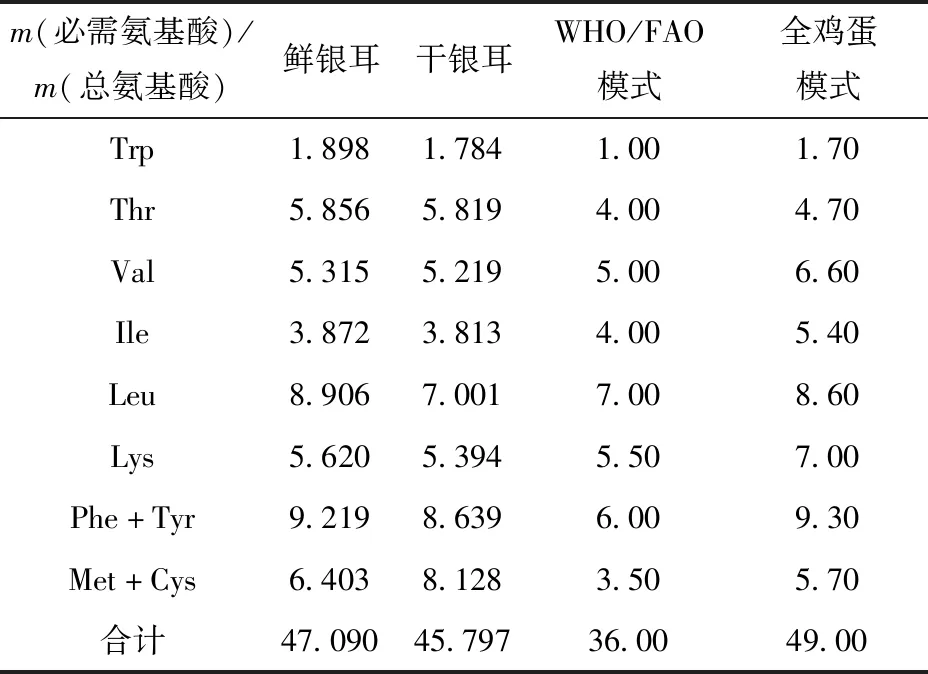
表4 银耳中必需氨基酸占总氨基酸的质量比Tab.4 Mass fraction of essential amino acids in total amino acid of Tremella fuciformis %

表5 银耳中必需氨基酸组成分析Tab.5 Analysis of essential amino acid composition in Tremella fuciformis
2.4 鲜、干银耳中矿物质含量分析
食用菌中矿物质元素种类丰富,银耳中矿物质元素含量测定结果见表6。表6显示,鲜、干银耳样品中测定到9种矿物质元素,其中包括钠、镁、钾、钙4种常量元素和锰、铁、铜、锌、硒5种微量元素。4种常量元素中,钾是鲜、干银耳中含量最高的元素,其次为钠、镁和钙;鲜、干银耳中钠钾比均远低于1,说明银耳是良好的高钾低钠食物,长期食用可对高盐饮食导致的高血压等疾病有明显的缓解作用[16]。此外,鲜、干银耳中5种微量元素含量由多到少依次为锌、铁、锰、铜和硒。鲜银耳中除了硒含量与干银耳无显著性差异外,其他所测微量元素均显著高于干银耳,这与马涛等[17]研究结果一致,即热风干燥过程会造成部分矿物质元素损失。
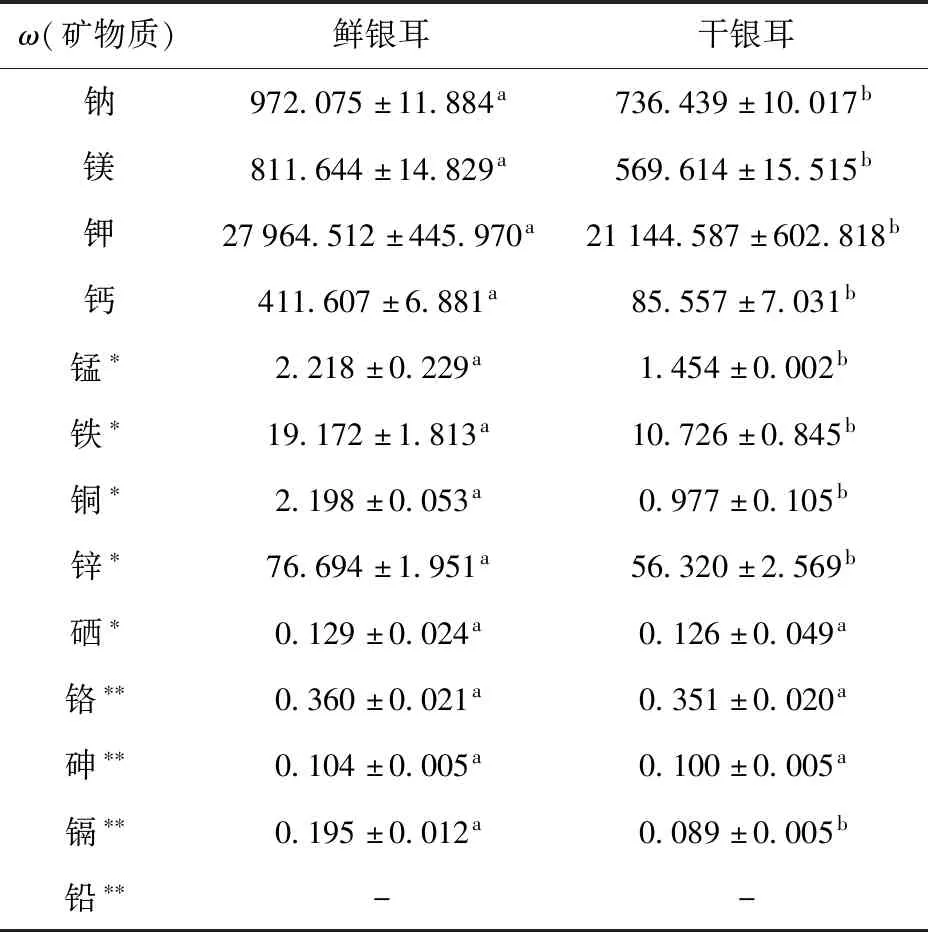
表6 银耳中矿物质含量 Tab.6 Mineral contents of Tremella fuciformis mg/kg
食用菌中除含有丰富有益矿物质元素外,还可有效富集土壤中的重金属元素[18],而重金属会通过食物链最终进入人体危害健康。由表6可知,本研究还测到了银耳中4种重金属元素含量;鲜、干银耳中均无铅元素检出,其他3种元素铬、砷和镉的含量也均低于GB 2762—2017《食品安全国家标准 食品中污染物限量》的要求[w(铬)<0.5 mg/kg,w(砷)<0.5 mg/kg,w(镉)<0.2 mg/kg,w(铅)<1.0 mg/kg],可放心食用。
2.5 鲜、干银耳中挥发性风味化合物的GC- IMS分析结果
图1为鲜、干银耳中挥发性风味物质的GC- IMS谱图。图1中横坐标为离子漂移时间、纵坐标为气相色谱保留时间。离子漂移时间为1.0 ms处为RIP峰,峰的右侧每一个点代表一种挥发性化合物,颜色深浅表示物质含量的多少[19]。由图1可知,利用GC- IMS技术,鲜银耳和干银耳中的挥发性风味物质都得到了较好分离。为了进一步分析鲜、干银耳挥发性风味物质的差异,利用Reporter插件绘制鲜、干银耳GC- IMS差异图,如图2。由图2可知,以鲜银耳为对照,干银耳样品谱图对相同的物质做颜色抵消,若相应风味物质浓度高于对照组则显现红色,低于对照组则显现蓝色。由图2可知,在保留时间110~250 s、漂移时间1.1~1.5 ms(图2中红色框区域),干燥后银耳样品相比较鲜银耳红色明显,说明这部分挥发性风味物质经过干燥后含量增加;而保留时间为260~740 s、漂移时间1.1~1.8 ms(图2中紫色框区域)的蓝色明显,说明这部分挥发性风味物质经过干燥后有所损失。
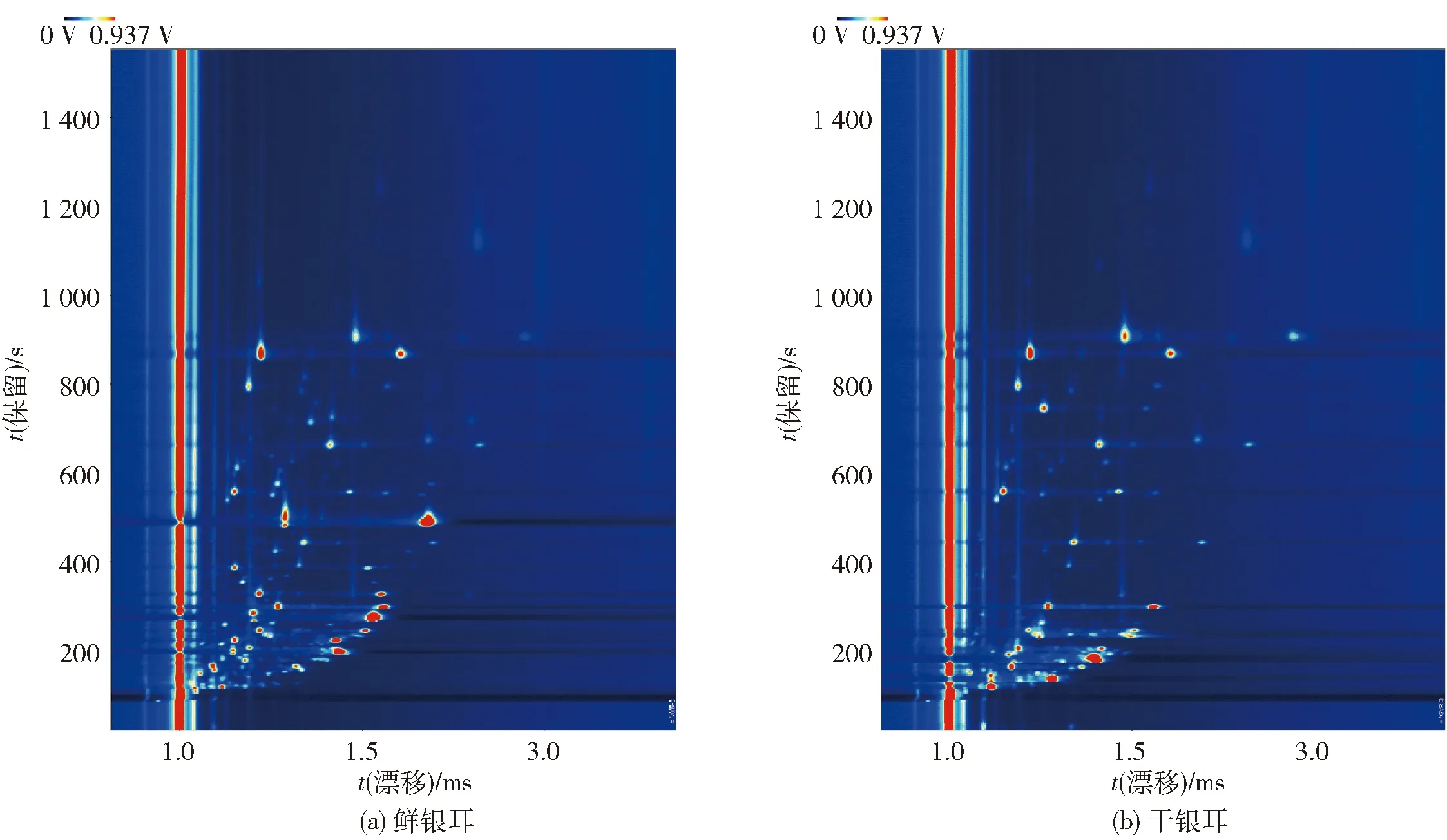
图1 鲜、干银耳中挥发性风味物质二维GC- IMSFig.1 Two-dimensional GC- IMS of volatile flavor compounds in fresh and dry Tremella fuciformis
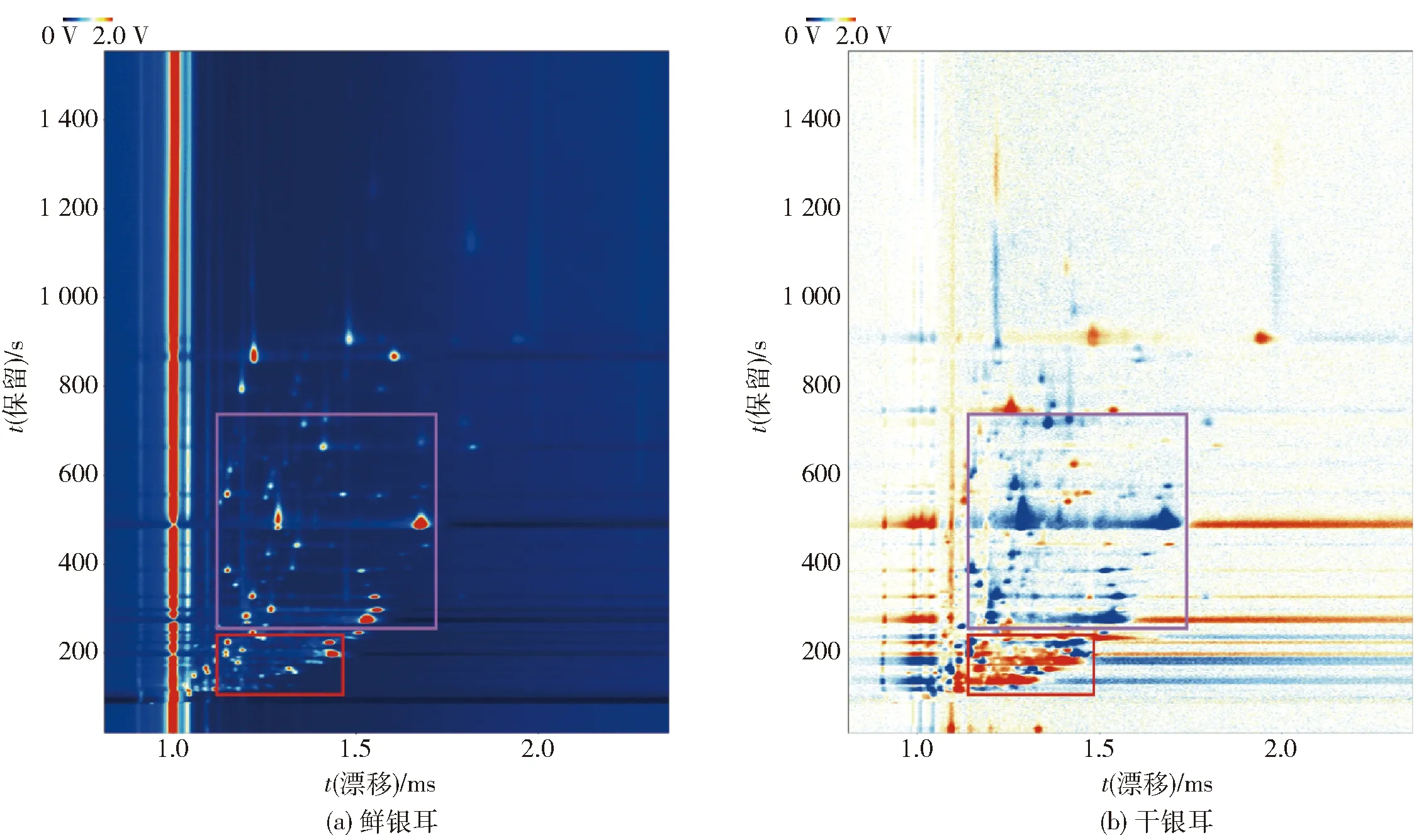
图2 鲜、干银耳GC- IMS的差异Fig.2 GC- IMS of difference in fresh and dry Tremella fuciformis
以二维谱图的峰信号利用Gallery插件绘制出鲜、干银耳样品挥发性化合物的指纹图谱,如图3。图3中每一行代表一个样品(每个样品重复测定3次),每一列对应一个挥发性化合物,每个点代表化合物含量,越亮代表其含量越高。从指纹图谱中可以更好地看出鲜、干银耳样品挥发性风味物质的差异。由图3可知,经过干燥处理后,与鲜银耳相比,干银耳中有15种挥发性风味物质含量增加(图3中绿色框区域),有15种挥发性风味物质含量减少(图3中红色框区域)。

图3 银耳中挥发性风味物质的GC-IMS检出成分指纹图谱Fig.3 Fingerprints of volatile flavor compounds in Tremella fuciformis by GC- IMS
为了进一步了解鲜、干银耳样品中挥发性风味物质的信息,利用GC- IMS内部的NIST数据库和IMS数据库对鲜、干银耳样品中的挥发性成分进行二维定性分析,其中包括部分高浓度的风味化合物的二聚体组分。二聚体比单体物质具有更高质子亲和力,故相比较单体迁移时间增加,利用单体和二聚体的二重数据可以更加精准地定性化合物[20]。每种化合物的保留指数(RI)由外标正酮(C4~C9)确定,通过比对 GC- IMS 质谱库的保留指数(RI)和漂移时间(DT)对挥发性化合物进行定性分析;根据分析软件LAV(Laboratory Analytical Viewer)获得的各个挥发性化合物的峰强度,采用归一化法计算样品中各个挥发性风味成分的相对含量。鲜、干银耳中挥发性化合物分析结果见表7。由表7可知:已经定性的30种挥发性风味物质中包括10种醇类、7种醛类、7种酮类、3种酯类和3种烯烃类;鲜银耳中醛类含量最丰富,其次是烯烃类和酮类化合物;干银耳中醇类含量最丰富,其次是醛类和酮类化合物;干燥前后银耳的挥发性风味化合物组成和含量发生了改变。
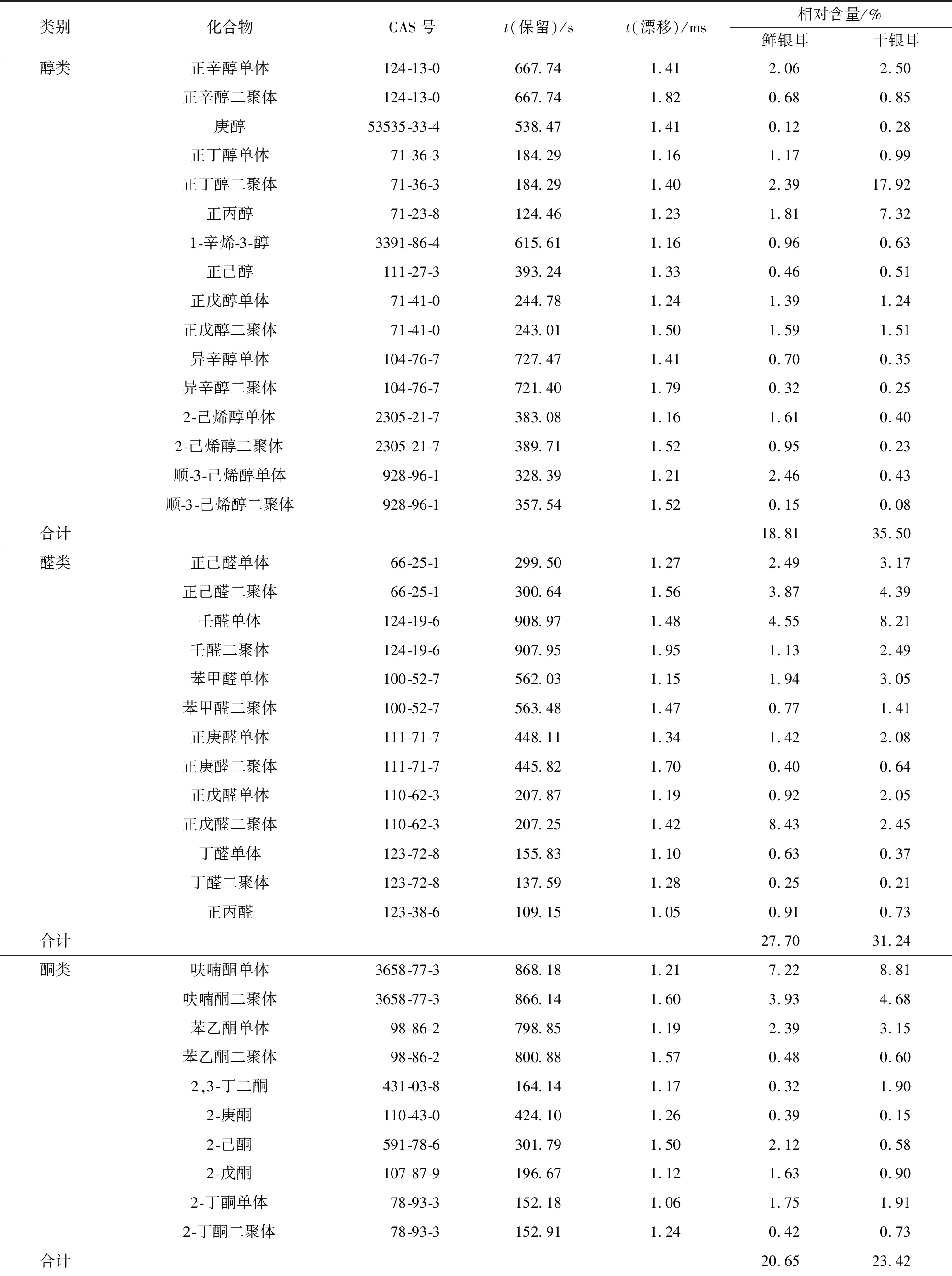
表7 银耳中挥发性风味化合物的GC- IMS检测结果Tab.7 Detection results of volatile flavor compounds in Tremella fuciformis by GC- IMS
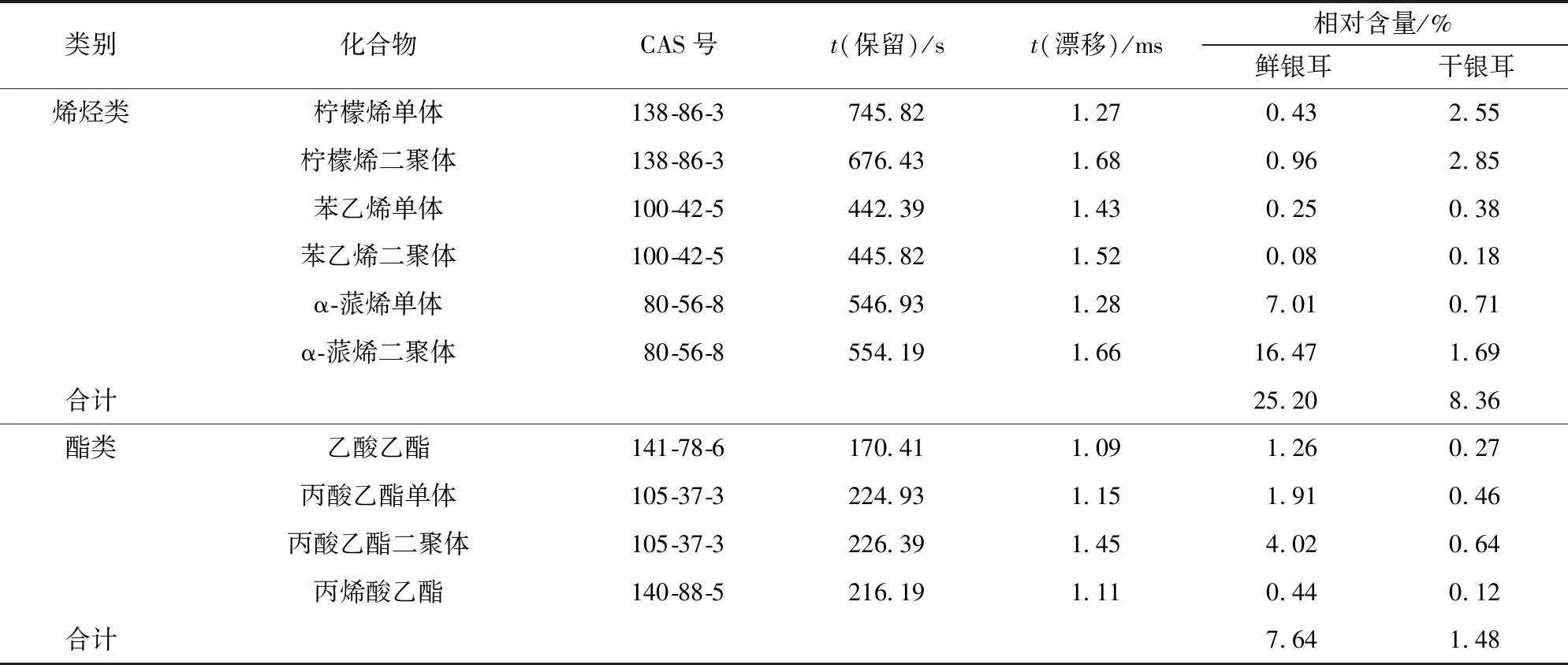
续表7
干燥处理对鲜银耳中风味组分影响明显,醇类挥发性风味物质在银耳中含量丰富,八碳醇类风味物质是食用菌中典型的风味化合物,其中1-辛烯-3-醇又名松茸醇,是赋予食用菌蘑菇味的关键风味组分。八碳醇类多为不饱和脂肪酸和脂肪氧化酶相互作用产生的,其挥发性强但热稳定性差[9]。由表7可知,鲜银耳中1-辛烯-3-醇和异辛醇等八碳醇含量丰富,经过干燥后其含量降低,说明长期的热风干燥处理会对银耳中部分醇类风味物质含量造成损失。低碳醛类的气味阈值低对食用菌香气有着重要作用,然而低碳醛类物质的热稳定性差,干燥处理后银耳中正丙醛和丁醛等低碳醛类含量明显降低;而 C5~C9醛类则主要来源于不饱和脂肪酸的氧化和美拉德反应中的Strecker降解,经过长时间的热风干燥,干燥银耳中苯甲醛、壬醛和庚醛含量上升,苯甲醛具有坚果和苦杏仁味,常由亚油酸氧化和异亮氨酸美拉德反应中的Strecker降解产生。低碳酮类物质具有类似丙酮气味,对银耳整体风味贡献不大,但是经过热风干燥处理后,2-丁酮和2,3-丁二酮的含量明显增加,这可能是因为部分有机酸在受热不均匀时易脱羧变成酮类物质。张毅航等[21]研究发现,热风干燥处理有利于2,3-丁二酮的形成。烯烃类挥发性化合物常具有果香味,但易氧化分解产生烷烃、醇类或含羰基的风味化合物。干燥后银耳中柠檬烯(果香、柠檬味)含量大幅上升,而α-蒎烯(松木香、草本味)含量明显降低。酯类挥发性风味物质阈值较低,常具有令人愉悦的果香,其含量越高气味就越浓郁。鲜银耳中富含有果香的丙酸乙酯和丙烯酸乙酯,而干燥后酯类物质含量大大减少。
2.6 鲜、干银耳中挥发性风味物质的GC- MS分析结果
采用顶空固相微萃取(headspace solid-space microextraction,HS- SPME)气相色谱质谱联用仪(gas chromatography-mass spectrometer,GC- MS)测定鲜、干银耳中挥发性化合物组成,结果如表8。由表8可知,在鲜、干银耳中共鉴定出41种挥发性成分,包括醇类6种、醛类5种、酮类3种、酯类13种和烷烃类化合物14种,其中鲜银耳中有40种,干银耳中有27种,包括26种共同挥发性化合物。与干银耳相比,鲜银耳中检测到更多种类的挥发性化合物,其中酯类组成和含量尤为丰富,包括丁酸甲酯、2-甲基丁酸甲酯、2-糠酸甲酯、己酸甲酯、苯甲酸甲酯等13种,而经过热风干燥后干银耳中酯类化合物种类和含量显著减少,这可能是因为酯类化合物在长时间加热的干燥条件下水解成醇类及羧基类化合物。GC- MS测定结果显示,新鲜银耳中富含具有果香味的酯类化合物和典型蘑菇味的八碳醇类化合物,经过干燥后酯类和八碳醇类化合物的含量均显著降低。

表8 银耳中挥发性风味化合物GC- MS检测结果Tab.8 Detection results of volatile flavor compounds in Tremella fuciformis by GC- MS
与GC- IMS测定结果相比,GC- MS鉴定出了相对更丰富的酯类化合物和长链烷烃类化合物,但GC- MS未检测到低碳、低沸点的重要挥发性风味化合物如正丁醇、丁醛、2-丁酮、2-戊酮等。通常GC- MS检测到的多为10个碳原子以上且含量高的挥发性化合物,而GC- IMS检测到的常为低碳小分子的挥发性风味化合物[22];因此将GC- IMS技术和GC- MS技术联用测定,可以弥补各自的局限性,获得更加全面的鲜、干银耳的风味轮廓。
银耳中除了具有典型蘑菇味的1-辛烯-3-醇和正辛醇等的八碳醇类化合物外,还包括醛类、酮类、烯烃类和酯类等多种挥发性化合物,这几类物质与八碳醇类化合物相互协调、平衡,赋予了银耳独特的风味。
3 结 论
本研究发现,热风干燥前后银耳中的主要营养成分和挥发性风味化合物存在一定差异。新鲜银耳中粗蛋白、粗脂肪、总氨基酸等基本营养成分和粗多糖、总多酚、总三萜等生物活性成分的含量都显著高于干银耳样品(P<0.05),说明新鲜银耳营养价值更高,热风干燥过程会对新鲜银耳中营养和活性成分含量造成一定损失。此外,利用GC- IMS技术和GC- MS技术协同分析,可以优势互补,获得更加全面的鲜、干银耳的挥发性风味成分信息。新鲜银耳热风干燥处理后的挥发性风味化合物的含量及组成发生明显改变,干燥后银耳中富有典型蘑菇味的1-辛烯-3-醇的含量明显下降,具有松木和果香的α-蒎烯、柠檬烯等烯烃类化合物含量大大减少;同时鲜银耳中富含的具有水果香味的乙酸乙酯、丙酸乙酯和丁酸甲酯等多种酯类化合物含量显著降低。干燥后银耳中苯甲醛、正己醛和正辛醛等挥发性醛类风味化合物含量上升。本研究初步对比了新鲜银耳和热风干燥后银耳的营养与活性成分及风味特征的差异,希望能为新鲜银耳的选购及加工过程中营养与风味的控制提供理论依据,同时为新鲜银耳精深加工产品的开发奠定基础。关于新鲜银耳风味特征轮廓及热风干燥处理对鲜银耳品质影响的机制仍需进一步研究。
